RIP3对BCG感染后小鼠巨噬细胞凋亡的调控作用研究*
2019-07-30张嘉美于嘉霖马臣杰邓光存吴晓玲
韩 璐, 张嘉美, 于嘉霖, 方 舒, 马臣杰, 邓光存, 吴晓玲
(西部特色生物资源保护与利用教育部重点实验室, 宁夏大学生命科学学院, 宁夏 银川 750021)
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacteriumtuberculosis)感染引起的一种严重的人类呼吸道传染病。据世界卫生组织2017年的报告显示,仅2016年全球感染结核病的就有1 040万例,且中国位于世界第3位[1]。由于结核病的致病机理较为复杂,加之多重耐药菌株的出现以及与HIV共感染导致结核病的形式更加严峻。
结核分枝杆菌是一种典型的胞内致病菌,当结核分枝杆菌感染宿主细胞时,机体会启动自身免疫调控机制来抵抗病原菌的侵染。一方面,巨噬细胞可通过细胞凋亡杀伤并清除病原菌;另一方面,结核分枝杆菌也可通过多种途径逃避巨噬细胞的免疫清除,包括抑制细胞凋亡和氧化应激反应等[2]。最终结核分枝杆菌的命运与这一场角力息息相关,此过程受到多种因素及蛋白调控。近期研究表明,受体相互作用蛋白3(receptor-interacting protein 3,RIP3)对细胞命运具有关键性调控作用。
受体相互作用蛋白家族(receptor-interacting proteins,RIPs)是一类具有丝氨酸/苏氨酸激酶活性的蛋白[3]。迄今为止,该蛋白家族共发现7种蛋白受体相互作用蛋白,RIP3作为受体相互作用蛋白家族的一员,在细胞程序性死亡和细胞增殖等信号转导过程中起着重要的作用,尤为重要的是,RIP3是细胞凋亡与细胞坏死的转换器[4]。早前研究发现,在293E细胞[5]、Phoenix-A细胞[6]和HeLa细胞[7]中外源过表达RIP3蛋白会诱导细胞发生Ⅰ型程序性死亡,即细胞凋亡,且RIP3过表达诱导的细胞凋亡依赖于caspase的活化[8]。亦有大量研究发现,RIP3在肝、脑、肺和心脏等正常组织中都有表达,而在肝癌和肺癌组织中表达量却非常低,这表明RIP3与肿瘤细胞的生物学功能可能具有密切联系[7]。但RIP3是否参与结核分枝杆菌感染后的细胞命运尚未见系统报道,因此深入探究RIP3在结核分枝杆菌引发巨噬细胞凋亡中的作用对结核病的防治及靶向药物研制具有重要意义。
本实验室前期研究发现牛结核分枝杆菌减毒株卡介苗(Bacillus Calmette-Guérin, BCG)感染巨噬细胞后细胞凋亡率增加,与此同时,细胞内RIP3表达量明显上调[9]。为了探讨RIP3是否参与了BCG诱导的细胞凋亡过程,本研究构建了RIP3腺病毒干扰载体感染小鼠巨噬细胞RAW264.7,并结合BCG进行感染,从而探讨RIP3是否参与调控BCG感染后RAW264.7细胞的凋亡,进而揭示RIP3在BCG感染小鼠巨噬细胞RAW264.7过程中对凋亡的调控作用。
材 料 和 方 法
1 细胞系与菌株
小鼠巨噬细胞RAW264.7购自中科院上海细胞研究所,保存于西部特色生物资源保护与利用教育部重点实验室。牛结核分枝杆菌卡介苗购自上海生物制品研究所有限公司。
2 主要材料和试剂
DMEM 培养基购自Gibco;胎牛血清购自BI;MTT细胞活力及细胞毒性检测试剂盒、Annexin VFITC/PI双染试剂盒、细胞凋亡线粒体膜电位检测试剂盒(JC-1)、活性氧(reactive oxygen species,ROS)检测试剂盒、全蛋白提取试剂盒和蛋白测定试剂盒均购自南京凯基生物科技发展有限公司;Western blot用 I 抗购自Proteintech;荧光 II 抗购自LI-COR;HRP化学发光试剂盒购自北京伯乐生物发展科技有限公司;其它生化试剂均为进口分装或国产分析纯。RIP3腺病毒干扰载体(shRIP3)由上海吉玛制药技术有限公司合成。
3 方法
3.1细胞培养 从液氮中取出冻存的RAW264.7细胞于37 ℃水浴中快速搅拌至细胞悬液完全溶解,将细胞悬液移至加有1 mL(含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素)培养液的离心管中,1 000 r/min离心5 min,弃掉上清,加入1 mL完全培养液将细胞轻轻重悬后移入细胞培养皿中,于37 ℃,含5% CO2的恒温、恒湿培养箱中培养,1~2 d传代1次,取3代以后的RAW264.7细胞用于实验。
3.2菌株培养 BCG菌株采用Middlebrook 7H10对BCG进行复苏,静置于37 °C培养箱中,每3个周传代 1 次。
3.3实验分组 取于37 ℃、含5% CO2的恒温恒湿培养箱中培养超过24 h且生长状态良好的细胞用于实验,以1×106个接种于6孔板中,每孔加培养液2 mL,设立4个处理组:对照(control)组、BCG组、shRIP3组及shRIP3结合BCG感染组。待细胞生长状态稳定后,进行病毒感染(MOI=1∶100),空载腺病毒感染control组和BCG组,RIP3干扰腺病毒感染shRIP3组和shRIP3结合BCG组;病毒感染24 h后最后一组再用BCG感染细胞,细胞与细菌之比为1∶10;继续培养24 h后进行实验。
3.4MTT法检测细胞存活率 取生长状态良好的RAW264.7细胞按1×103个接种于96孔板中,每孔加培养液200 μL,根据实验要求设计处理组和对照组,每孔设计5个复孔,培养结束后,每孔加入50 μL的1×MTT溶液,培养箱37 ℃继续抚育4 h,4 h后小心吸掉培养液,每孔加入150 μL DMSO,37 ℃平板摇床抚育30 min,于490 nm处检测每孔的吸光度(A)值。
3.5Annexin V-FITC/PI双染流式细胞术检测细胞凋亡率 取生长状态良好RAW264.7细胞以1×106个接种于6孔板,按实验设计处理后,用Annexin V-FITC/PI 细胞凋亡试剂盒检测细胞凋亡率。除实验组还需设计3个对照组,分别为Annexin V-FITC单染、PI单染和不染组,将各组细胞消化后用预冷的PBS洗涤1遍,1 000 r/min离心5 min,弃上清,加入400 μL 1×Binding buffer重悬细胞,各处理组细胞分别加入Annexin V-FITC 5 μL,混匀后加入PI染色液5 μL,轻轻混匀,室温,避光抚育20 min。1 h内上流式细胞仪检测,细胞凋亡率为Annexin V-FITC阳性细胞数占总细胞数的百分比。
3.6RAW264.7细胞ROS水平的测定 根据ROS试剂盒说明书,将RAW264.7细胞以1×106个接种于6孔板培养皿中,按实验设计处理后,用DCFH-DA荧光探针检测细胞活性氧含量。无血清的DMEM配置终浓度为10 μmoL/L的DCFH-DA工作液,细胞消化后用预冷的PBS洗涤,1 000 r/min,离心5 min,弃上清,1 mL DCFH-DA工作液重悬细胞,37 ℃避光抚育30 min。PBS洗涤2次,500 μL PBS重悬细胞。1 h内上流式细胞仪检测。
3.7RAW264.7细胞线粒体膜电位的检测 将RAW264.7细胞以1×106个接种于6孔板,按试验设计处理后,采用细胞凋亡线粒体膜电位检测试剂盒(JC-1)检测细胞线粒体膜电位。取500 μL 1×Incubation Buffer加入1 μL JC-1,涡旋混匀配成 JC-1 工作液。取500 μL JC-1工作液混匀细胞,37 ℃、5% CO2的培养箱中抚育20 min,离心,弃上清。用1×Incubation Buffer清洗细胞,吸取500 μL 1×Incubation Buffer 重悬细胞,1 h内上流式细胞仪检测。
3.8Western blot 检测蛋白表达 取生长状态良好的RAW264.7细胞以1×106个接种于6孔板培养皿中,按试验设计处理后,按蛋白提取试剂盒提取细胞全蛋白,根据需要测定的蛋白大小调整分离胶的浓度,将各组蛋白上样,SDS-PAGE 2 h,用湿转法将蛋白样品从胶转至 PVDF膜,5%脱脂奶粉37 ℃封闭1 h, 加入相应的 I 抗,4 ℃过夜,以β-actin作为内参照,次日TBST缓冲液洗掉残留的 I 抗,加入相应的 II 抗,室温抚育2 h,TBST缓冲液洗掉膜上残留的 II 抗,显影,曝片。结果用 ImageJ 软件分析各组条带的灰度值。
4 统计学处理
所有实验均重复3次,数据以均数±标准差(mean±SD)表示,实验结果通过GraphPad Prism 7.0软件进行分析,两组均数比较采用LSD-t法,多组均数比较采用单因素方差分析(one-way ANOVA),分析结果经过Bonferroni法矫正,以P<0.05为差异具有统计学意义。
结 果
1 BCG感染对RAW264.7细胞活力的影响
采用MTT法对BCG感染不同时点细胞活力进行检测,结果显示,与空白对照组相比,BCG处理后的细胞活力显著降低(P<0.01),且随着BCG感染时间的增加,细胞活力呈现逐渐下降的趋势,见图1。
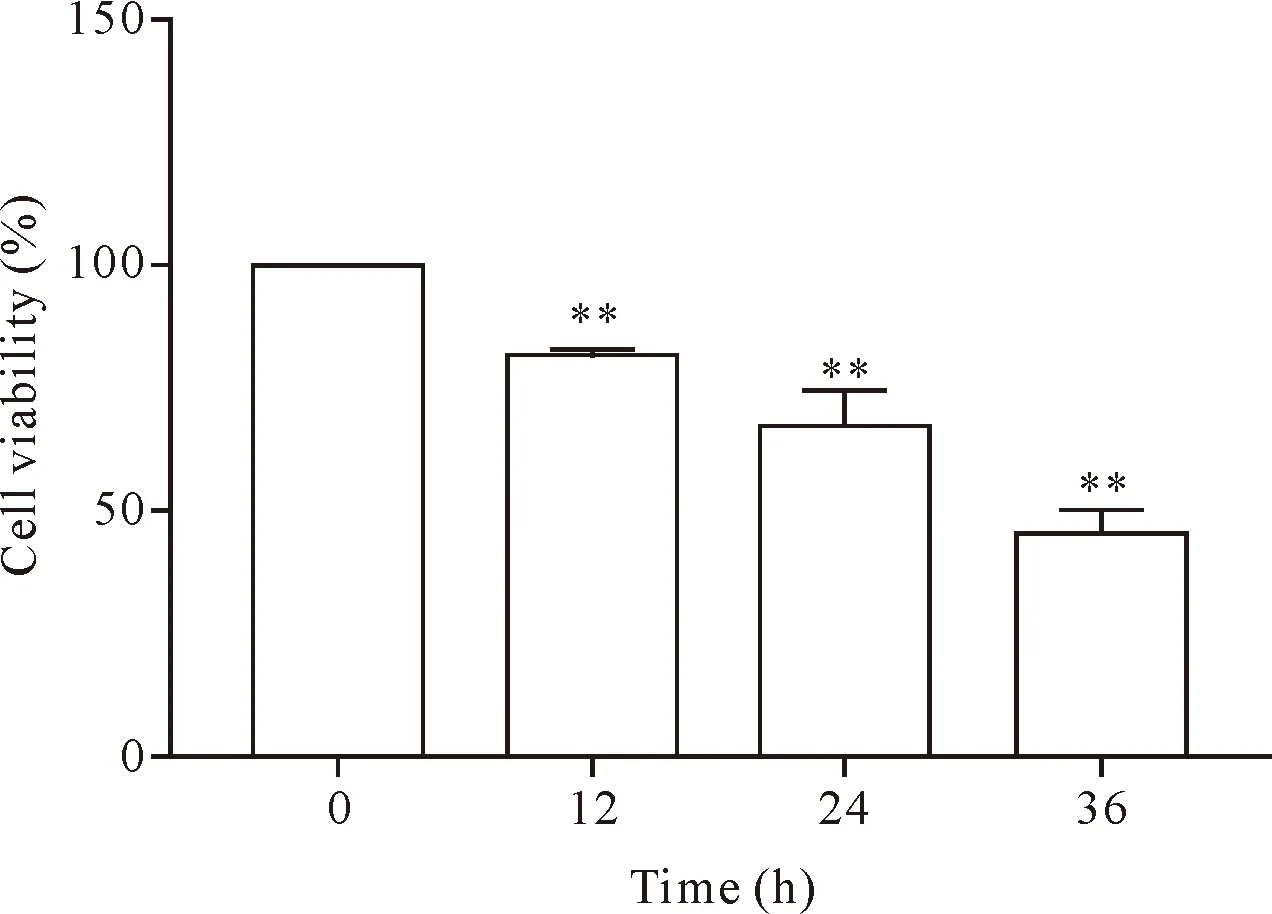
Figure 1.The effect of BCG on the viability of RAW264.7 cells at different time points. Mean±SD.n=5.**P<0.01vscontrol (0 h) group.
图1 BCG感染后对RAW264.7细胞存活率的影响
2 BCG感染 RAW264.7细胞后RIP3表达水平的变化及RIP3腺病毒干扰载体的验证
采用Western blot技术对RIP3蛋白的表达情况进行检测。与空白对照组相比,BCG感染RAW264.7细胞后细胞内RIP3表达量显著增加 (P<0.01),见图2A。为了验证RIP3的上调是否参与BCG诱导的细胞凋亡,我们构建了RIP3腺病毒干扰载体进行干扰实验,结果表明,与空载腺病毒载体组相比,RIP3腺病毒干扰载体组RIP3的蛋白表达量显著降低(P<0.01),见图2B,表明RIP3腺病毒干扰载体构建成功。
3 RIP3对 BCG感染后RAW264.7细胞凋亡率的影响
本实验进一步采用Annexin V-FITC/PI染色液对细胞进行染色,用流式细胞术检测RIP3对BCG感染后RAW264.7细胞凋亡率的影响,结果表明,BCG感染后RAW264.7细胞凋亡率与空白对照组相比显著上升(P<0.01),但是RIP3干扰结合BCG感染处理组与BCG组相比细胞凋亡率显著下降(P<0.05),见图3。这表明BCG诱导的细胞凋亡是由于RIP3上调所导致,当RIP3被干扰后其凋亡率显著下降。
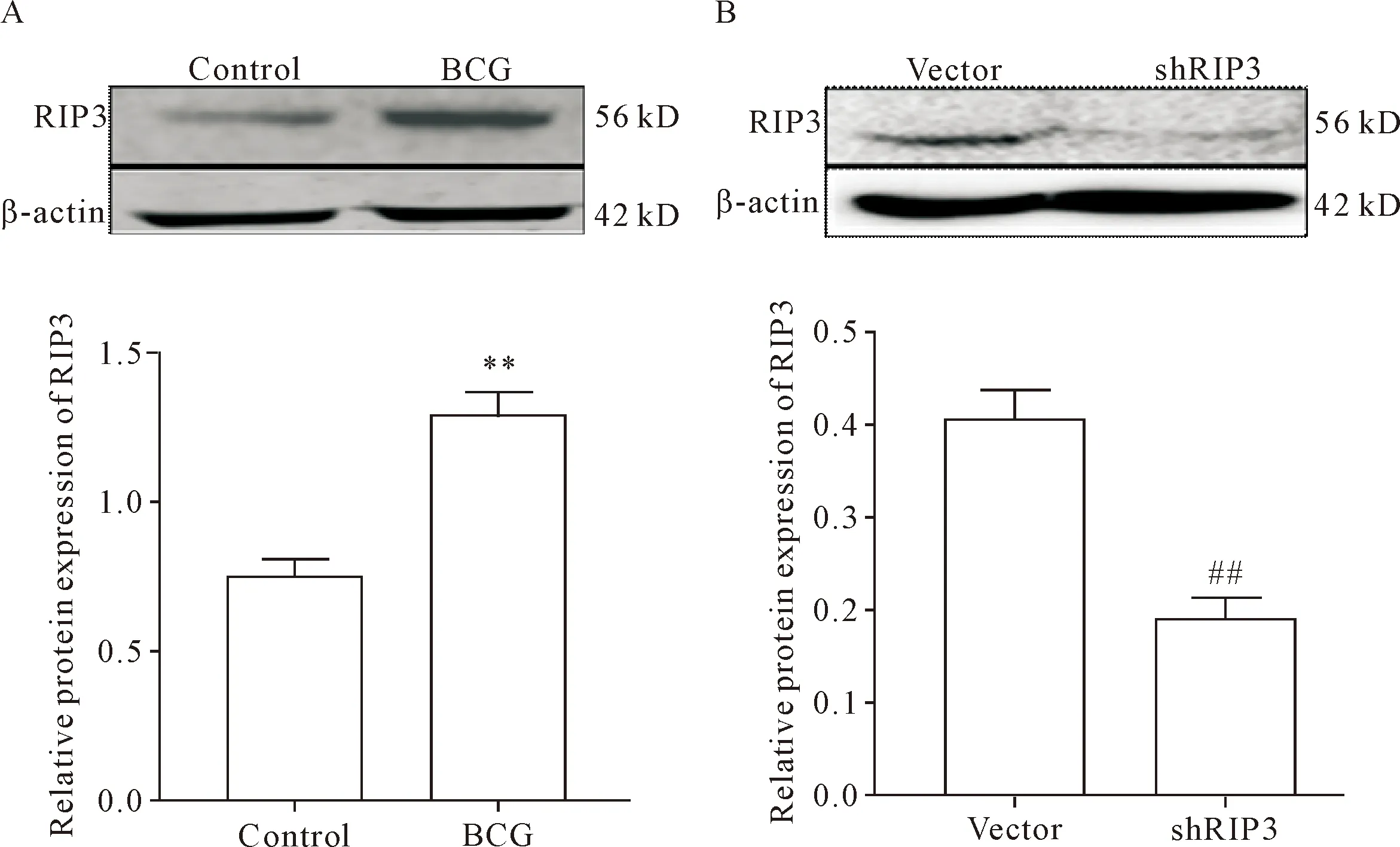
Figure 2.The effect ofRIP3adenovirus interference vector transfection on the protein expression of RIP3 in the RAW264.7 cells with or without BCG infection was detected by Western blot. A: the expression of RIP3 after BCG infection; B: the validation ofRIP3adenovirus interference vector transfection. Mean±SD.n=3.**P<0.01vscontrol;P<0.01vsvector group.
图2 BCG感染RAW264.7细胞后RIP3表达水平变化及shRIP3效率的验证
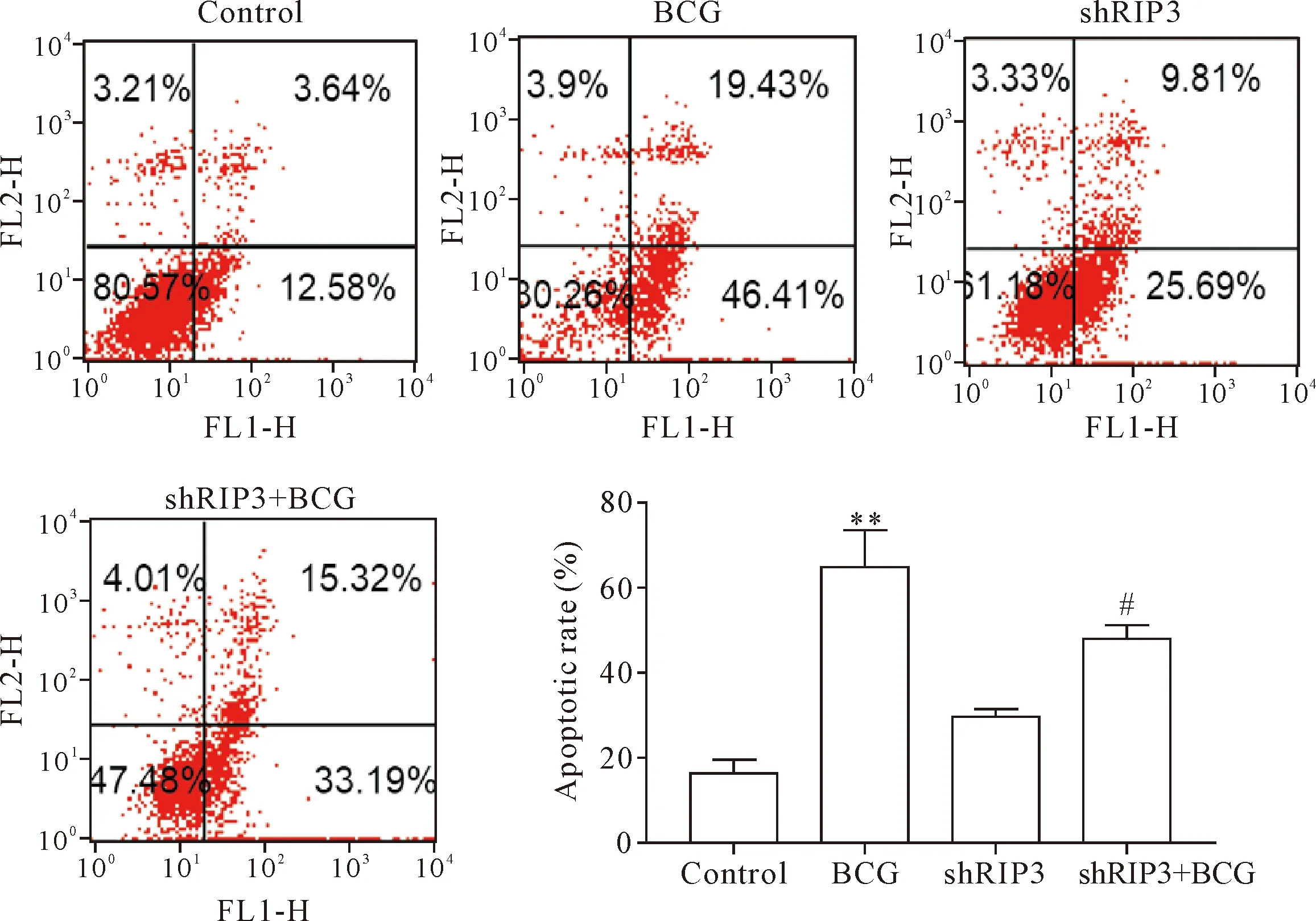
Figure 3.The effects of RIP3 expression on the apoototic rate of RAW264.7 cells infected with BCG. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05vsBCG group.
图3 RIP3表达水平对BCG感染后RAW264.7细胞凋亡率的影响
4 RIP3对BCG感染后RAW264.7细胞活性氧水平的影响
流式细胞术分析结果显示,BCG感染后RAW264.7细胞的活性氧水平与空白对照组相比显著上升(P<0.01),但是BCG感染结合RIP3干扰处理组细胞活性氧水平与BCG组相比显著下降(P<0.01),见图4。由此可知,RIP3可上调BCG感染后RAW264.7细胞的活性氧水平。

Figure 4.The effect of RIP3 expression on the level of ROS in the RAW264.7 cells infected with BCG. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsBCG group.
图4 RIP3表达水平对BCG感染后RAW264.7细胞ROS水平的影响
5 RIP3对BCG感染后RAW264.7细胞线粒体膜电位的影响
流式细胞术分析结果显示,BCG感染后RAW264.7细胞线粒体膜电位与空白对照组相比显著降低,线粒体低电位细胞数显著增加(P<0.01),但是BCG感染RIP3干扰处理组细胞线粒体膜电位与BCG处理组相比显著升高,线粒体低电位细胞数显著下降(P<0.01),见图5。由此可知,RIP3通过下调BCG感染后RAW264.7细胞线粒体膜电位而诱导细胞凋亡。
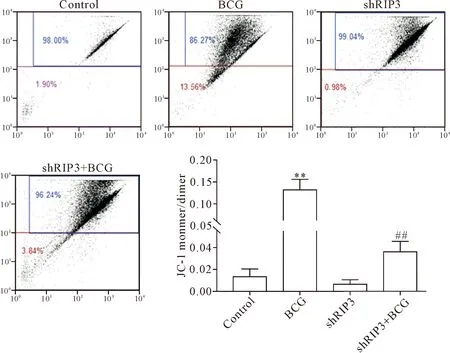
Figure 5.The effect of RIP3 on the mitochondrial membrane potential of RAW264.7 cells infected with BCG. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsBCG group.
图5 RIP3对BCG感染后RAW264.7细胞线粒体膜电位的影响
6 RIP3对BCG感染后RAW264.7细胞凋亡相关分子蛋白水平的影响
与对照组相比,BCG感染后RAW264.7细胞促凋亡蛋白Bax和cleaved caspase-3的蛋白水平上升,抑凋亡蛋白Bcl-2的表达量下调;与BCG组相比,RIP3干扰结合BCG感染组Bax和cleaved caspase-3蛋白水平下调,Bcl-2的表达量上调(P<0.01)。由此可见,在BCG诱导的RAW264.7细胞凋亡过程中,RIP3通过增加促凋亡蛋白Bax的表达量,下调抑凋亡蛋白Bcl-2的表达,最终激活caspase-3,从而促进了细胞凋亡,见图6。
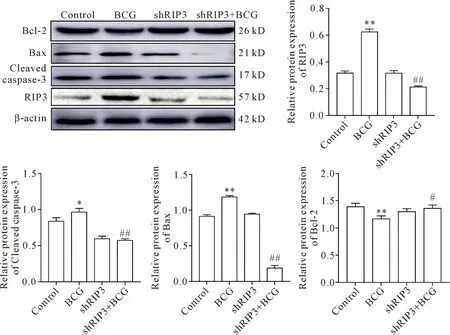
Figure 6.The effect of RIP3 on the protein levels of apoptosis-related molecules in the RAW264.7 cells after BCG infection. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsBCG group.
图6 RIP3对BCG感染后RAW264.7细胞凋亡相关分子蛋白水平的影响
讨 论
结核分枝杆菌感染巨噬细胞后,细胞会出现3种形式的死亡:细胞凋亡、细胞自噬及细胞坏死。细胞凋亡是一种由基因控制自动结束生命的过程,对生物个体的发育及维持机体自稳的平衡都起到极其重要的作用[10]。目前认为,细胞凋亡的途径主要有3种:线粒体途径、死亡受体途径和内质网途径。但结核分枝杆菌感染后诱发巨噬细胞凋亡的分子机制十分复杂。
本研究结果显示,BCG感染巨噬细胞后细胞存活率降低,且具有时间依赖性。该死亡过程可能有多种蛋白参与,近期研究发现RIPs激酶家族在细胞程序性死亡过程中起到举足轻重的作用。迄今为止,RIPs有RIP1~RIP7共7种蛋白。RIPs作为重要的细胞应激传感器,被证明不仅在炎症反应和免疫反应中发挥重要的作用,而且在细胞程序性死亡的过程中也扮演着重要的角色[11]。在TNF诱导NF-κB激活的过程中,RIP是不可缺失的[12]。此外,RIP基因缺失的小鼠在出生1~3 d内就会发生死亡,该状况是由于小鼠脂肪组织和淋巴细胞过度凋亡而导致的[13]。除此之外亦有研究揭示RIP3在多种疾病中对宿主细胞凋亡的调控过程都起着至关重要的作用。本研究发现BCG感染巨噬细胞后细胞内RIP3的表达量发生明显上调,为了探讨BCG诱导的细胞凋亡是否与RIP3的上调相关,通过构建RIP3的干扰载体并验证其干扰功能。研究结果显示,RIP3干扰结合BCG感染组 RAW264.7细胞的凋亡率与BCG单独感染组相比显著下降,这表明RIP3的上调参与了BCG诱导的细胞凋亡。有报道表明,在人类乳腺癌细胞中外源性过表达RIP3会导致细胞内ROS的积累[14],胞内ROS的积累会引发细胞的氧化应激损伤,最终诱导细胞凋亡。本研究发现,在BCG感染小鼠巨噬细胞的过程中RIP3可上调胞内活性氧水平。已有研究表明,ROS的过量积累会导致线粒体膜损伤,从而诱导细胞凋亡[15]。本实验发现,BCG感染巨噬细胞后,细胞线粒体膜电位显著下降,且RIP3干扰结合BCG组与BCG处理组相比线粒体膜电位显著上升。以上实验结果表明RIP3对BCG诱导小鼠巨噬细胞凋亡的调控是通过线粒体途径实现的,有研究证明,在RIP3过表达的HeLa细胞中,RIP3所诱导的细胞凋亡过程中细胞caspase被激活,且RIP3可能位于Bcl-2的上游[7]。Bcl-2家族是线粒体途径的主要调控者。Bax是Bcl-2家族中的促凋亡成员,若Bax表达量升高,则进一步激活caspase-3,促进细胞凋亡;Bcl-2作为Bcl-2家族中的抑凋亡蛋白,若Bcl-2表达量升高,则阻断了caspase的激活,抑制了细胞凋亡[16]。本研究发现,在BCG感染RAW264.7细胞的过程中,RIP3参与了BCG诱导的RAW264.7细胞的凋亡,且该过程可能是通过ROS调控线粒体介导的凋亡实现的。
细胞程序性死亡是一个复杂的生物学过程,除了凋亡外还有自噬和坏死。本实验室前期已证明BCG感染巨噬细胞后细胞会发生凋亡、坏死及自噬。本研究证实RIP3参与了BCG感染引起的细胞凋亡,但RIP3是否参与了BCG感染后巨噬细胞的坏死及自噬有待进一步的研究。该研究的继续推进将为进一步揭示结核病的致病机理提供新的思路。
本研究结果揭示,BCG可导致巨噬细胞RAW264.7活力降低并上调RIP3的表达量;RIP3干扰结合BCG感染组与BCG处理组相比,细胞凋亡率下降,活性氧水平下调,线粒体膜电位上升,且凋亡蛋白Bax与cleaved capase-3的蛋白水平降低,抑凋亡蛋白Bcl-2表达量上升,表明RIP3参与了BCG感染小鼠巨噬细胞RAW264.7后细胞的凋亡,且该过程可能是通过线粒体途径实现的。
