高压氧通过调节BACE1蛋白水平改善APP/PS1模型小鼠Aβ相关病理改变及认知功能
2019-07-30邓青山陶裕川周世军
邓青山, 王 东, 张 超, 吴 蛟, 王 翰, 邱 俊, 陶裕川, 周世军, 易 勇
(四川省宜宾市第二人民医院神经外科, 四川 宜宾 644000)
阿尔茨海默病(Alzheimer disease,AD)是最常见的引起痴呆的中枢神经系统退行性疾病,主要表现为进行性的记忆缺失和认知功能障碍,严重影响患者日常生活水平,已跃居成为导致老年人群晚年精神行为障碍和危及生命的首要因素[1]。本病从明确诊断到患者死亡通常只有3~9年的时间[2]。尽管最近数十年对AD发病机理的认识不断深入,但始终没有十分确切有效的早期防治方法,仍以对症治疗为主。因此,探寻有效的临床预防和治疗方式具有重要意义。
AD的主要病理特征为细胞外β-淀粉样蛋白(amyloid β-protein,Aβ)沉积和细胞内过量的tau蛋白磷酸化形成神经纤维缠结,从而引起氧化应激和慢性炎症性损伤,导致突触功能障碍和异常神经元丢失等[3-4]。淀粉蛋白假说指出,脑内过多的Aβ肽,尤其是Aβ42的存在是引起老年斑形成、神经纤维缠结、突触功能障碍和丢失、神经元死亡的主要原因[5-6];乏氧则加速这一病理过程的进展,在AD发病中起着重要促进作用[7]。因此,根据AD的淀粉蛋白假说,靶向于Aβ的治疗,如减少Aβ产生和聚积,促进Aβ清除,以改善Aβ诱导的继发损伤,是治疗AD的重要手段[8]。在众多的药物治疗策略中,钙调磷酸酶(calcineurin)、胆碱酯酶抑制剂和谷氨酸受体拮抗剂等药物具有良好的耐受性和低毒性,并可显著改善AD模型小鼠的记忆功能和神经病理表现[9-11]。然而,这些药物靶点单一,作用效果只能局限于某些方面,与AD复杂的发病机制和多种神经递质改变的特性相差甚远,只能暂时缓解AD的症状,而不能完全改善和逆转AD的退行性神经病理过程。
高压氧(hyperbaric oxygen,HBO)是指在超过1个大气压的环境中,呼吸的氧分压大于1.0绝对大气压 (atmosphere absolute, ATA)。HBO治疗能明显地改变机体对氧的摄取和利用,提高血氧分压,增强血氧弥散能力。目前HBO作为一种治疗手段广泛应用于临床,其治疗疾病的机理被认为是高压氧使血液中物理溶解的氧含量增加,提高血氧分压,增强血氧弥散能力,明显改善缺血、缺氧组织血供,改善组织炎症反应,增强微循环功能。然而许多疗效并不能用上述机理完全阐释清楚,因此人们一直在为探寻高压氧治疗疾病的更深层次的机理而不懈努力。
高压氧作为目前纠正脑组织缺氧唯一有效的物理因素,可以通过增加血管的氧容量并增强血管通透性,增加进入脑组织的氧含量从而起到改善脑组织缺氧微环境的状况。既往诸多体外、体内研究均已证明高压氧作为辅助治疗对脑损伤、脑缺血等有显著的神经保护与功能恢复作用,然而关于高压氧作为单一因素是否对中枢神经系统退行性疾病如AD等具有显著影响,目前缺少相关研究报道。因此,本研究希望通过探讨HBO对AD病理改变及认知功能的影响,从而为高压氧用于AD的治疗提供一些科学依据。
材 料 和 方 法
1 实验动物
APPswe/PS1dE9双转基因AD模型小鼠和同窝来源的野生型C57BL/6J小鼠均从南京大学动物模式研究所购买;3月龄的雄性AD模型鼠30只,野生型鼠15只,体重平均约20 g,动物合格证号为201702666。所有小鼠分笼饲养,每笼5只,饲养于宜宾市第二人民医院实验中心动物房。动物房常年温度控制在(24±2) ℃,湿度55%~65%,每天光照12 h,时间09:00~21:00。所有小鼠均饲喂全营养颗粒饲料和无菌双蒸水。所有实验动物的管理和使用均遵守中华人民共和国卫生部动物实验管理条例、宜宾市第二人民医院实验动物管理条例,所有实验动物的使用均获得相应实验动物管理委员批准。
2 主要试剂
Aβ40 ELISA试剂盒和Aβ42 ELISA试剂盒购自Invitrogen;抗BACE1 抗体购自CST;抗Aβ抗体购自Covance;抗APP抗体和抗β-actin抗体购自Sigma;抗synaptophysin抗体购自Abcam;山羊抗小鼠HRP-IgG(H+L)抗体和山羊抗兔 HRP-IgG(H+L)抗体购自北京中杉金桥公司。
3 主要方法
3.1动物分组与高压氧治疗 将购买的3个月龄的AD模型小鼠和野生型小鼠分组:野生型(wild-type,WT)组、AD模型(transgenic, TG)组和AD模型HBO治疗(TG+HBO)组。饲养到4个月龄时,治疗组进行高压氧治疗,治疗结束再次麻醉小鼠后断头取鼠脑标本,进行后续行为学和生化实验。高压氧治疗:TG+HBO组小鼠被放置于高压氧仓中,予以2 ATA的100%纯氧治疗,每次持续时间1 h;加压及减压过程各经5 min缓慢进行。治疗过程中实际监测氧浓度均达96%以上。WT和TG组小鼠同时放置于高压氧仓中,但不给予高压氧治疗。小鼠共进行6个疗程治疗,一疗程为5 d,休息2 d后再进入下一疗程。
3.2Morris水迷宫实验 本实验水迷宫采用直径1.2 m、深0.5 m的圆形温控水箱,水箱正东、南、西、北壁上分别粘贴不同形状和颜色的直径20 cm塑料板作为空间标记。水位控制在20 cm,水温设定于22±1 ℃,将一个15 cm直径的圆形透明平台置于目的象限中央,浸没于水下1 cm。白色人工食用色素调节水背景为白色。数据采集软件使用Noldus公司EthoVision XT监测分析软件。
小鼠连续训练5 d,每天训练4次。同天的4次实验中,每次使用不同的起始位点(东、南、西、北4个位点,各位点间距相等),将小鼠头部面向水槽壁轻放入水中。每次训练最长持续时间为90 s,或者直到小鼠找到逃生平台时结束。如果小鼠在90 s内没有找到逃生平台,则人为地将小鼠引导到平台。无论小鼠是否找到平台,都让其在平台上停留10 s。在整个训练过程中,逃生平台位置保持不变,记录小鼠每次训练的逃生时间、逃生距离和游泳速度等数据。于第6天,撤掉逃生平台,从平台所在象限的对立向限放入小鼠,记录在60 s内小鼠穿过逃生平台区域的次数。
3.3老年斑计数和面积分析 每组选6只小鼠,每只小鼠依据冰冻切片由前向后依次选取4张切片做老年斑计数,每只小鼠所选取切片位置大致相同。每张切片经免疫荧光染色后,于荧光显微镜下拍摄大体图像,在ImageJ中打开图像,计数每张切片中老年斑的数量和面积、鼠脑切片的总面积。老年斑的密度以每张切片中老年斑的数量表示;老年斑的面积以每张切片中老年斑的总面积占整张切片中脑组织的面积比表示。
3.4Western blot实验 鼠脑蛋白样本制备:小鼠经3.6%水合氯醛麻醉后,断颈处死小小鼠,立即取鼠脑,予以预冷的RIPA裂解液匀浆处理后充分裂解组织,经12 000×g、 4 ℃离心30 min,提取蛋白上清液,按照BCA法测定蛋白浓度。留存一部分用于ELISA检测;剩余部分加入蛋白上样loading buffer混匀,95 ℃ 加热5 min,-80 ℃储存。 配制10%分离胶进行SDS-PAGE;取电泳完成的凝胶,切取包括目的条带的凝胶块,根据蛋白分子量大小选用0.45 μm PVDF膜进行蛋白转膜;5% BSA进行封;封闭结束后予以相应 I 抗4°C孵育过夜; II 抗室温孵育2 h;成像仪中观察和拍照。
3.5酶联免疫吸附实验 用于定量检测Aβ40/42的ELISA试剂盒购自Invitrogen。鼠脑样本经制备成蛋白上清液后,严格按照ELISA试剂盒说明书步骤完成样本检测。
3.6高尔基染色检测树突棘密度 高尔基染色试剂盒购自FD Neuro Technologies。根据试剂盒操作流程制作高尔基染色切片,并对染色脑片在Leica激光共聚焦显微镜下采用Z轴多层扫描。用ImageJ软件对树突棘的密度进行测量分析。
4 统计学分析
所有数据采用SPSS 22.0统计软件进行统计分析。数据用均数±标准误(mean±SEM)表示,2组样本间比较采用独立样本t检验,3组间比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
结 果
1 高压氧治疗能减少APP/PS1转基因小鼠脑中Aβ的产生和老年斑的形成
我们检测了APP/PS1转基因小鼠脑中Aβ水平,发现高压氧治疗组小鼠脑中Aβ40和Aβ42水平明显低于对照组(P<0.01),见图1A、B。免疫荧光染色结果显示,高压氧治疗组小鼠脑中老年斑数量和老年斑所占脑切片面积均要显著低于对照组(P<0.01),见图1C~E。
2 高压氧治疗能增加APP/PS1转基因小鼠脑中Sirt1的蛋白水平,降低BACE1的蛋白水平
我们通过对APP/PS1转基因小鼠脑标本进行蛋白检测发现,经高压氧治疗后鼠脑中Sirt1蛋白水平明显增加,而BACE1的蛋白水平明显减低(P<0.01);β-CTF作为BACE1蛋白分解APP蛋白的代谢产物,与对照组的APP/PS1转基因小鼠脑标本相比,高压氧治疗减少β-CTF的形成(P<0.01);但是高压氧治疗并未改变鼠脑中APP蛋白的表达水平,见图2。这些结果表明高压氧治疗可通过上调Sirt1蛋白水平,从而减低BACE1蛋白的表达,并最终减少APP的淀粉蛋白途径降解。
3 高压氧治疗能增加APP/PS1转基因小鼠脑神经棘突数量与树突棘蛋白水平
我们通过对3组鼠脑标本进行高尔基染色检测神经元树突棘发现,转基因小鼠神经元树突棘密度明显降低,而高压氧治疗可以增加树突棘的密度(P<0.01),但仍未能达到正常小鼠水平(P<0.05),见图3A。对反映神经突触水平的synaptophysin进行检测发现,转基因小鼠synaptophysin蛋白水平明显降低,而高压氧治疗可以增加synaptophysin的水平(P<0.01),但TG+HBO组与WT组比较差异无统计学显著性,见图3B。
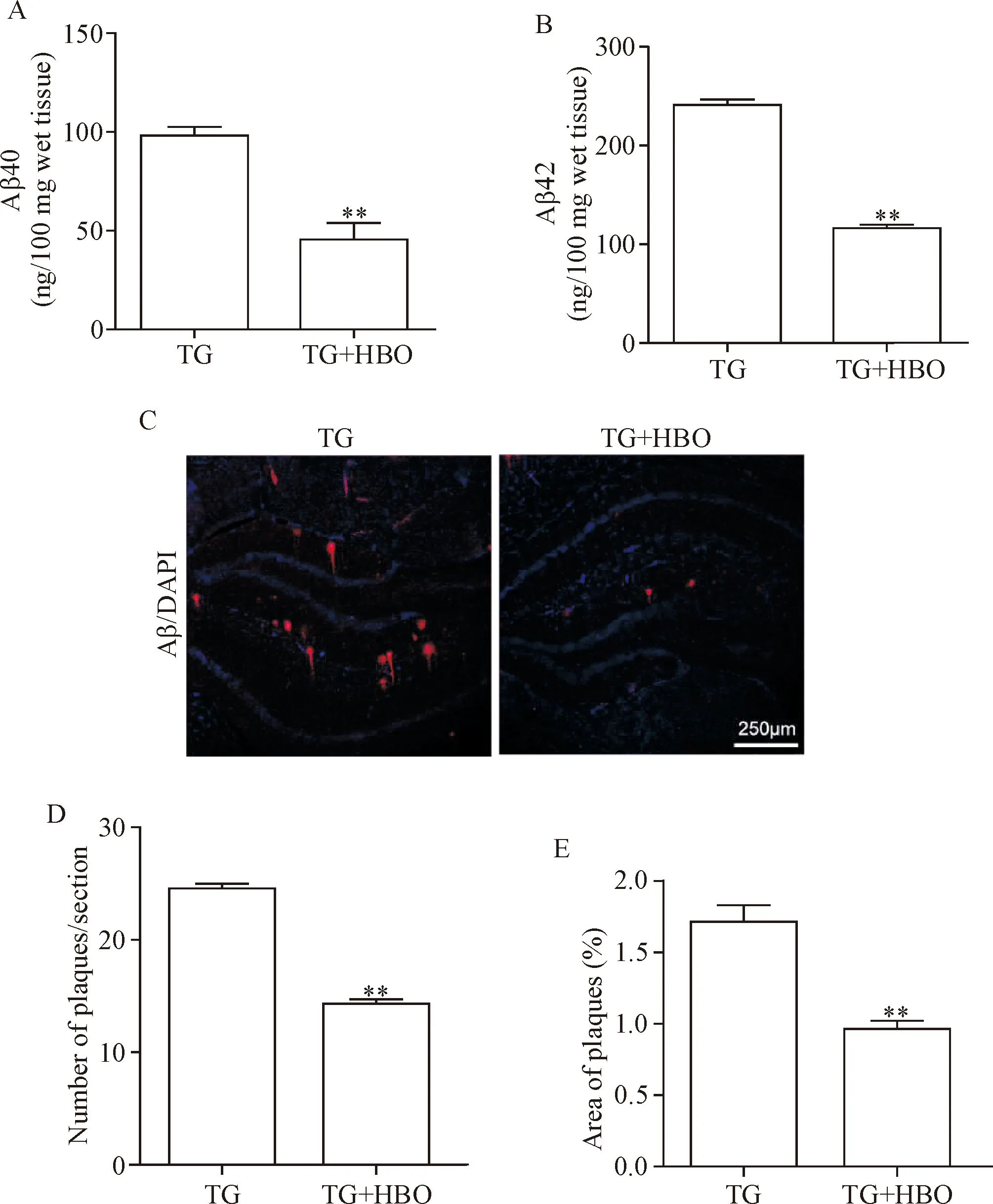
Figure 1.Treatment with HBO reduced Aβ generation and plaque formation in the brains ofAPP/PS1transgenic (TG) mice. A and B: ELISA analysis of the Aβ40 and Aβ42 levels in the brain of transgenic mice treated with or without HBO; C: coronal sections of brain of transgenic mice after MWM test were immunostained for Aβ and counterstained with DAPI (scale bar=250 μm); D and E: the number of and the size of amyloid plaques of the transgenic mice were quantified. Mean±SEM.n=6.**P<0.01vsTG group.
图1 高压氧治疗能减少APP/PS1转基因小鼠脑中Aβ的产生和老年斑的形成
4 高压氧治疗能改善APP/PS1转基因小鼠的学习认知功能障碍
对3组小鼠进行水迷宫试验检测发现,TG组小鼠的逃生时间显著长于WT组(P<0.01);而高压氧治疗逆转了这一情况,TG+HBO组与TG组比较差异有统计学意义(P<0.01),且TG+HBO组的逃生时间与WT组接近,差异无统计学显著性,见图4A。对穿越逃生平台的次数进行检测发现,TG组穿越逃逃生平台的次数明显少于WT组,而TG+HBO组的穿越次数明显多于TG组,差异有统计学意义(P<0.01),TG+HBO组与WT组比较差异无统计学显著性,见图4B。
讨 论
AD是严重威胁人类健康的一种老年神经退行性疾病,其病理机制复杂多样,发病隐匿,病理进程缓慢,而且AD起病伴随着诸多病理生理性蛋白表达和信号通路的改变。BACE1是APP降解产生Aβ的关键酶,AD模型小鼠中BACE1的蛋白表达水平显著高于同龄野生小鼠[12];在AD患者的脑样本中也检测到BACE1的蛋白水平和酶活性都比非AD病人脑中BACE1蛋白水平和酶活性有显著升高[13]。目前许多临床药物研究都靶向于BACE1,希望通过下调BACE1蛋白水平及其酶活性从而减少Aβ的产生忆功能障碍,具有明确的治疗作用。
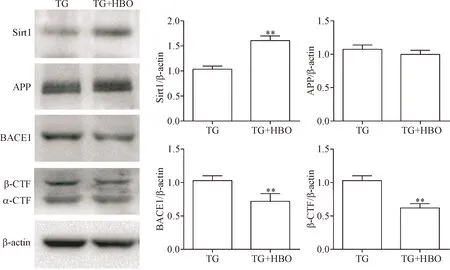
Figure 2.Treatment with HBO increased the protein levels of Sirt1, and reduced the protein level of BACE1 and the cleavage of APP by BACE1 in theAPP/PS1transgenic (TG) mice. Mean±SEM.n=6.**P<0.01vsTG group.
图2 高压氧治疗能增加APP/PS1转基因小鼠脑中Sirt1的蛋白水平,降低BACE1的蛋白水平,从而减少β-CTF的产生,但高压氧治疗并不改变脑中APP的蛋白量
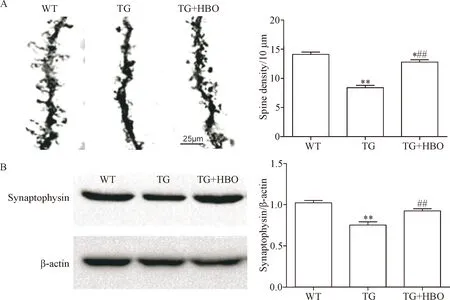
Figure 3.HBO treatment attenuated the loss of spines and synapses inAPP/PS1transgenic (TG) mice. A: representative images of spines of the mice (scale bar=25 μm) and the density of spines in each group; B: Western blot analysis of the levels of synaptophysin in the brain. Mean±SEM.n=6.*P<0.05,**P<0.01vsWT group;##P<0.01vsTG group.
图3 高压氧治疗能增加APP/PS1转基因小鼠脑神经棘突数量与突触素蛋白水平
及继发的神经病理改变。但由于药物作用的特异性及单一性,目前仍很难全面改善AD的病理进展。而高压氧作为一种重要的临床治疗手段,其作用机制复杂多样,能够有效提升血氧水平,改善炎症反应、促进神经发生、调节脑组织中多种关键蛋白的表达,从而具有重要的改善神经功能的作用。本实验通过高压氧治疗APP/PS1双转基因小鼠发现,高压氧治疗可以显著减轻AD相关病理变化,逆转小鼠学习记Sirt1蛋白在脑组织中有较高表达,参与调节细胞糖代谢、炎症反应、抗细胞衰老与调亡等,在细胞存活及功能保存、预防疾病进展、延长寿命方面具有重要作用。而且Sirt1能通过热量限制,改善AD小鼠的Aβ产生,改善神经病理及认知功能障碍,是AD的一个新颖的潜在治疗靶点[14]。对3xTg-AD小鼠脑进行的研究发现AD鼠脑中Sirt1的RNA及蛋白水平均明显低于野生小鼠[15-16]。对APPswe/PS1dE9模型小鼠进行Sirt1过表达后明显减少了Aβ的水平及老年斑的数量,而沉默Sirt1后,Aβ水平明显升高[17]。Xue等[18]对小鼠局灶性脑缺血的研究发现HBO治疗可以增加Sirt1的蛋白水平,并改善脑缺血相关病理改变。本实验在对APP/PS1转基因小鼠进行高压氧治疗后进行Sirt1蛋白水平检测发现高压氧治疗也明显增加了Sirt1的蛋白表达。同时高压氧下调了BACE1的蛋白表达,Aβ40和Aβ42水平均显著降低,病理性老年斑的形成明显减少。APP经BACE1降解产生中间产物β-CTF,β-CTF则进一步被裂解产生Aβ[19],因此β-CTF直接反映APP经淀粉蛋白途径降解的水平。本研究发现HBO治疗后APP/PS1转基因小鼠脑中β-CTF水平明显降低,这些结果都表明在APP/PS1转基因模型鼠中,高压氧治疗可以通过增加Sirt1蛋白水平,减少APP降解产生Aβ,这与高压氧可以上调脑中Sirt1蛋白表达,以及Sirt1可以下调AD中APP淀粉蛋白途径降解的理论相一致。

Figure 4.HBO treatment attenuated the learning and memory deficits in theAPP/PS1transgenic (TG) mice. Escape latencies (A) and the times that each group of mice swam across the target sites after retrieval of the platform (B) were analyzed. Mean±SEM.n=6.**P<0.01vsWT group;##P<0.01vsTG group.
图4 高压氧治疗能改善APP/PS1转基因小鼠的学习认知功能障碍
进行性加重的学习记忆障碍是AD突出的临床表现。主要因为AD病理改变导致大脑突触素蛋白和突触数量减少,突触可塑性的损害相关。而Aβ具有高神经毒性,是导致突触可塑性受损的关键因素。水迷宫能有效评估小鼠海马学习记忆。本实验也采用水迷宫检测APP/PS1转基因小鼠经高压氧治疗后海马学习记忆的改善情况。结果我们发现经高压氧治疗后,APP/PS1双转基因小鼠的学习记忆能力显著改善,且接近于野生小鼠的学习记忆能力。而且,高尔基染色发现高压氧治疗后突触密度及突触素蛋白都显著升高。这一结果表明高压氧治疗可能通过增加Sirt1蛋白表达,降低BACE1蛋白水平,从而减少APP裂解产生Aβ,进而减少Aβ的神经毒性损伤,最终发挥神经保护作用。Gao等[20]的研究表明Sirt1蛋白活化可以通过脑特异性miR-134进行转录后调节CREB的表达,从而促进突触可塑性,而Sirt1功能失活则使突触可塑性受损。这也说明高压氧治疗不仅通过改善AD病理,或许还可以通过Sirt1蛋白通路本身,调控突触可塑性,改善学习记忆功能。
值得注意的是,本研究中观察到APP/PS1转基因小鼠经高压氧治疗减少Aβ产生与改善小鼠的病理及认知障碍相一致。这一结果表明通过高压氧治疗增加Sirt1蛋白水平,减少BCE1蛋白水平,进而减少老年斑,改善突触可塑性是改善AD进展的有效方式。但是,因为高压氧治疗本身具有改善炎症反应,促进海马神经发生,促进轴突形成,调节突触可塑性等多种复杂机制,因此,高压氧对AD的神经保护作用或许不能简单地归结于本研究所涉及的这个单一因素,仍有待我们进一步深入研究。
