诊断原发性肝血管肉瘤1例
2019-07-30张崇胤
张崇胤,张 铎
(北华大学附属医院CTMRI科,吉林 吉林 132011)
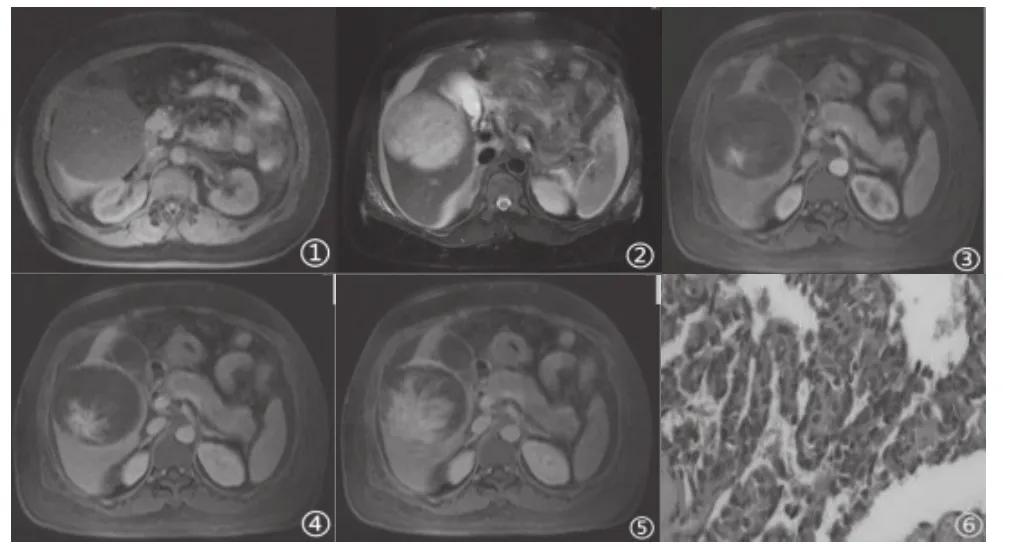
图1 PHA MRI表现
1 病 案
患者女,48岁,患者3天前无明显诱因出现右侧背部持续性疼痛并逐渐加重入院。查体:右侧腹部膨隆,伴压痛,轻度反跳痛及肌紧张,移动性浊音(+)。实验室检查:肿瘤标志物(-)。MRI:肝右前叶占位性病变。T1WI呈稍低信号,T2WI呈高信号,DWI呈不均匀稍高信号,增强动脉期呈片状强化,门脉期及延迟期病灶强化范围扩大。术中腹腔内大量血液从切口处溢出,于肝右叶可见90 mm×85 mm×40 mm,质地软,表面有活动性出血,胆囊部分附着于肝脏肿物表面。病理:表面灰黄色,一侧面光滑,部分破裂,破口长35 mm,另一侧面粗糙附肝样组织,长径8 cm,切面灰红色,质地细腻,部分呈窝状,中央似有囊腔形成。免疫组化:Vimentin(+),CD31(+),CD34(+),FLI-1(+),Ki-67指数约60%,P53(弱+)。病理诊断:肝脏恶性肿瘤,表面破裂,符合血管肉瘤(Primary hepatic angiosarcoma,PHA)[1]。
2 讨 论
PHA来源于血窦内皮细胞,较为罕见,有很强的侵袭性,是一种内皮来源的肉瘤。病因明确的患者较少见,有文献报道可能与长期密切接触氯乙烯、二氧化钍、无机砷以及使用雄激素合成的类固醇等物质有关[2,3]。PKA主要发生在老年人,以60~70岁多见,男女比例约为4:1[4]。临床症状一般无特异性,与其它肝脏恶性肿瘤症状类似;随病变进展,肝功能可出现损害,血小板减少症和DIC是其特征性表现。PHA血运丰富,生长速度快,多数病灶内发生囊变、坏死和出血,因其恶性程度高,预后极差,特别容易复发及远处转移。PHA病理由梭形细胞构成,镜下细胞之间无网状纤维。免疫组化CD31(+),CD34(+),CK(-)Glypican-3(-)Desmin(-)几乎都表达内皮细胞标记物CD31、CD34,其中CD31特异性好,CD34敏感性好,CK和Glypican-3(-)排除了肝细胞癌。Desmin(-)可除外肌源性或伴肌分化的肿瘤,本例的免疫组化与之相符。PHA在MRI上多呈类圆形,其内信号一般欠均匀,T1WI表现为不均匀低信号,中心可见片状或斑片状略高信号(提示出血),T2WI多为不均匀高信号,其内可见索条状低信号影,同时可伴不规则的流空血管影,部分中央可见片状低信号区(可代表含铁血黄素沉积、纤维化、陈旧出血)或更高信号区(提示新鲜出血或坏死),在DWI上表现为轻度受限或明显受限,注入顺磁性对比剂后,病灶出现明显不均匀强化,随时间延长,造影剂充填,但速度相对较慢,当病灶内出现坏死、出血、纤维化时,于延迟期显现为局部不规则或边缘环形强化,因PHA来源于肝血窦的血管内皮细胞,其血供丰富,所以对比剂进入病灶较快。
本病需与以下疾病相鉴别:①肝血管内皮细胞瘤:镜下肿瘤细胞似上皮样,呈多角形或类圆形,瘤细胞仅有轻度非典型性,无明显核分裂像,肿瘤间质炎症反应明显。中央可有纤维结构,外周为实质成分,主要为上皮样细胞和树突状细胞,其异型性相对较低,出血、坏死较PHA少见[1]。于MRI注入GD-DTPA后,动脉期呈环形强化,随时间延长,呈持续强化。②肝转移性血管肉瘤:鉴别较困难,据文献报道,转移性血管肉瘤极易出现坏死、出血,MRI增强后多数呈轻度环形强化[5]。当诊断困难时,也可结合PET/CT的检查结果来帮助诊断[6]。③分化差的肝细胞肝癌:其病灶也可表现为类似肉瘤样的梭形结构,注入核磁的顺磁性对比剂后,病灶迅速广泛强化,随时间延长,病灶强化程度逐渐减低。免疫组织化学染色,CK(+)、AFP(+)、血管标记物(-),予以鉴别。④海绵状血管瘤:在MRI上,可表现为典型的“灯泡征”,注入对比剂后,边缘结节样或环形强化,随时间延长,对比剂向中央充填。相比于海绵状血管瘤,PHA病灶内信号不均匀,多伴有出血、坏死等,注入对比剂早期呈不规则强化,囊变坏死区不强化。在临床上,海绵状血管瘤一般无症状,多为体检时发现,而PHA可表现为肝功能损害、血小板减少症和DIC及肿瘤恶病质的表现[7]。
