MRI对弥漫性轴索损伤的诊断及预后评估
2019-07-29江广斌蔡守国
谢 鹏,董 鑫,汪 军,江广斌,蔡守国
(湖北医药学院附属随州医院医学影像科,湖北 随州 441300)
弥漫性轴索损伤(diffuse axonal injury,DAI)是一种弥漫性脑损伤,由于头部受到加速旋转外力重创,在剪切力下导致脑内神经轴索断裂、毛细血管损伤而引起原发性脑损伤,多见于重度创伤性患者[1-2]。DAI的诊断主要依据 CT和 MRI结果[3-5],病理分级则主要依靠Adams分级方法。本文采用MRI 3种序列量化DAI病灶分布,并尝试建立MRI分级标准评估长期预后。
1 资料与方法
1.1 一般资料 前瞻性研究我院自2016年1月至2018年1月收治的30例DAI患者,均经CT和MRI双重确诊。其中男26例,女4例;年龄16~60岁,平均(31.21±4.62)岁。纳入标准:年龄>15岁;格拉斯哥昏迷评分(Glasgow Coma Score,GCS)<9 分或格拉斯哥运动评分(Glasgow Motor Score,GMS)<6 分;软组织肿块<25 cm、意识清醒;MRI证实脑动脉相关病灶、无凝血或抗凝治疗史。受伤原因:交通损伤18例,运动伤7例,跌倒4例,攻击1例。
1.2 治疗方法 一线治疗,使用间歇性静脉注射吗啡镇痛法和连续静脉注射异丙酚(1~4 mg·kg-1·h-1),进行气管通气。所有患者均行颅内压力及脑灌注压监护,并持续测量。PaCO230~35 mmHg(1 mmHg=0.133kPa);30°抬高床头,中心静脉压力为 0~5mmHg。将颅内压力保持<20mmHg,脑灌注压保持>60mmHg。二线治疗,持续戊巴比妥钠输注治疗和(或)减压开颅手术。
1.3 仪器与方法 入院初步行CT检查,按照Marshall CT进行评分。待病情稳定、创伤1周内立即行MRI检查。MRI使用GE Discovery 750 W 3.0 T MRI扫描仪,扫描序列和参数:T2*GRE序列TR 500 ms,TE 14 ms,翻转角 30°,体素 0.9 mm×0.9 mm×3.0 mm;DWI 序 列 SE-EPI,b 值 1 000 s/mm2,TR 4 700 ms,TE 89 ms,体素 1.2 mm×1.2 mm×5.0 mm;SWI序列 TR 49 ms,TE 40 ms,翻转角 15°,体素 0.9 mm×0.9 mm×1.5 mm。
1.4 病理分级及一致性评估 采用Adams病理分级标准,对每个序列病灶进行分级。Adams组织病理学分级为1~3级,灰白质交界面(Ⅰ级)、胼胝体(Ⅱ级)和背外侧、吻侧脑干(Ⅲ级)。计算每个MRI序列显示的大脑中线两侧的DAI相关病灶,计算与Adams病理分级一致性。
1.5 预后评估指标 根据扩展格拉斯哥结局量表(extended glasgow outcome scale,GOSE)[6]评估预后:死亡、植物状态、重度残疾、严重残疾、中度残疾、中等残疾(恢复以前的工作但需要一些调整)、恢复良好(伴有轻微的身体和智力缺陷)、恢复良好,对应分别记为 1、2、3、4、5、6、7、8 分,并电话随访,评估治疗6个月后的预后情况。
1.6 统计学方法 采用SPSS 21.0统计软件进行数据分析。分类变量采用线性加权Cohen K分析[7],连续变量采用组内相关系数(intraclass correlation coefficient,ICC)表示。正态分布使用 t检验,Fisher精确检验用于组间比较,Mann-Whitney U检验用于偏态分布。以GOSE为因变量,Logistics回归分析预后因素。以P<0.05为差异有统计学意义。
2 结果
2.1 临床基本特征及单因素分析(表1) 单因素分析显示,年龄、入院时和出院时GMS评分与长期不良预后显著相关(均P<0.05)。
2.2 病灶分布及单因素分析(表2) SWI序列比T2*GRE序列在脑半球、胼胝体、脑干中发现更多的出血病灶(均P<0.05)。SWI比DWI发现更多病灶,包括脑半球、胼胝体、脑干、丘脑、基底神经节、内囊(均P<0.05)。T2*GRE和DWI序列在显示病灶分布方面,无明显差异(P>0.05)。
SWI序列显示黑质和中脑盖、中脑顶盖和背侧脑桥出血病灶均与长期不良预后显著相关(均P<0.05)。
DWI显示丘脑病灶与长期不良预后有显著相关性(P<0.05)。T2*GRE序列示病灶与长期不良预后均无显著相关性(均P>0.05)。
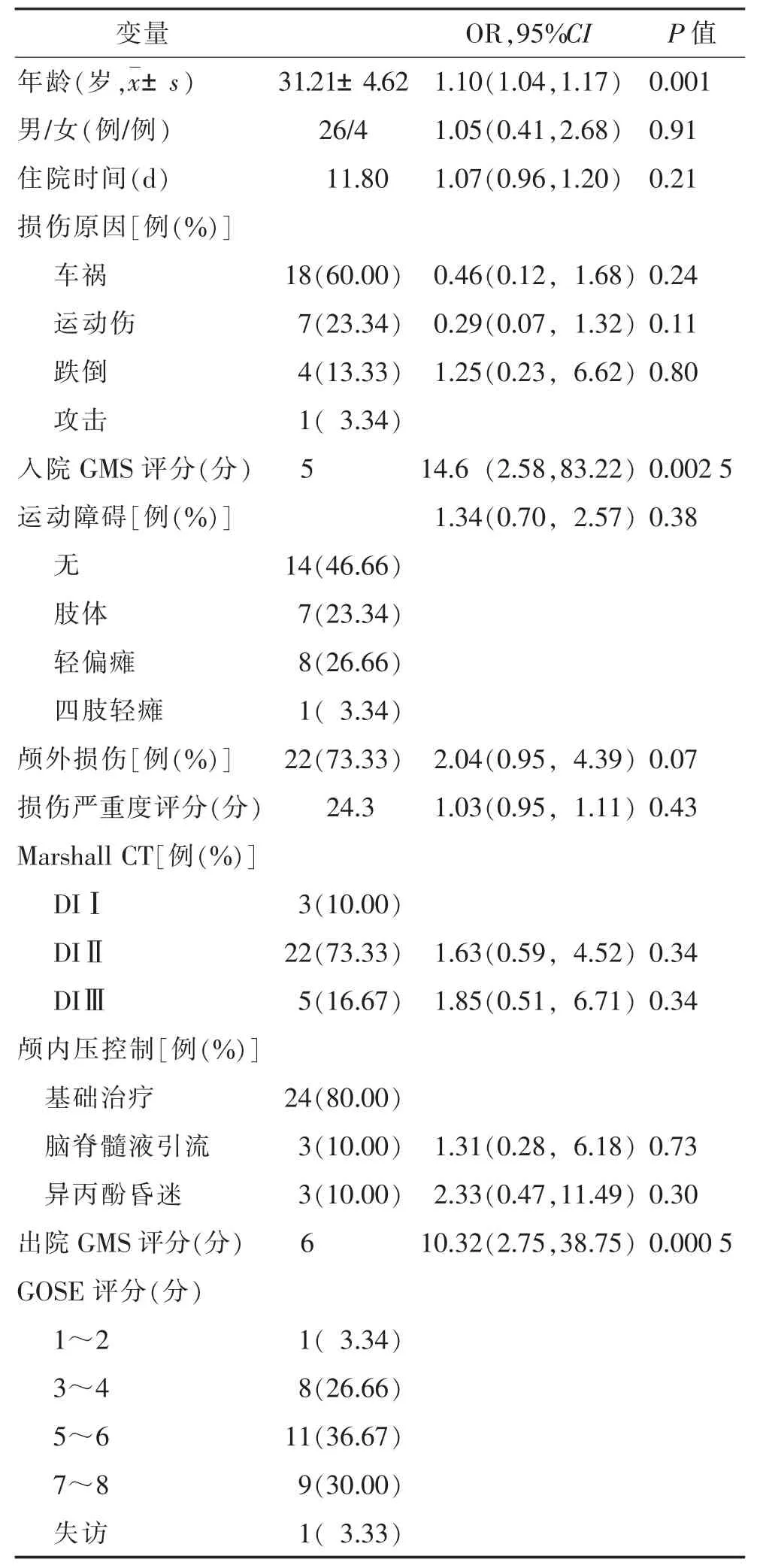
表1 人口统计学数据和临床因素与长期预后(GOSE)的相关性
SWI序列发现10例双侧脑干病灶,DWI序列发现3例,T2*GRE序列发现2例。SWI序列显示双侧脑干出血性病灶与长期不良预后显著相关(P=0.03)。
2.3 DAI的MRI分级(表3) 30例中21例(70.00%)是Adams 3级患者。SWI序列比T2*GRE序列识别更多 DAI 3级患者(P=0.006)。
2.4 评判间一致性 DAI分级,黑质和中脑被盖区病灶分级,与Cohen K>0.8大体一致(均值0.90,0.82~0.91)。组内相关系数表明,3种序列量化DAI相关病灶,具有良好的一致性,平均ICC 0.66(0.62,0.68)。
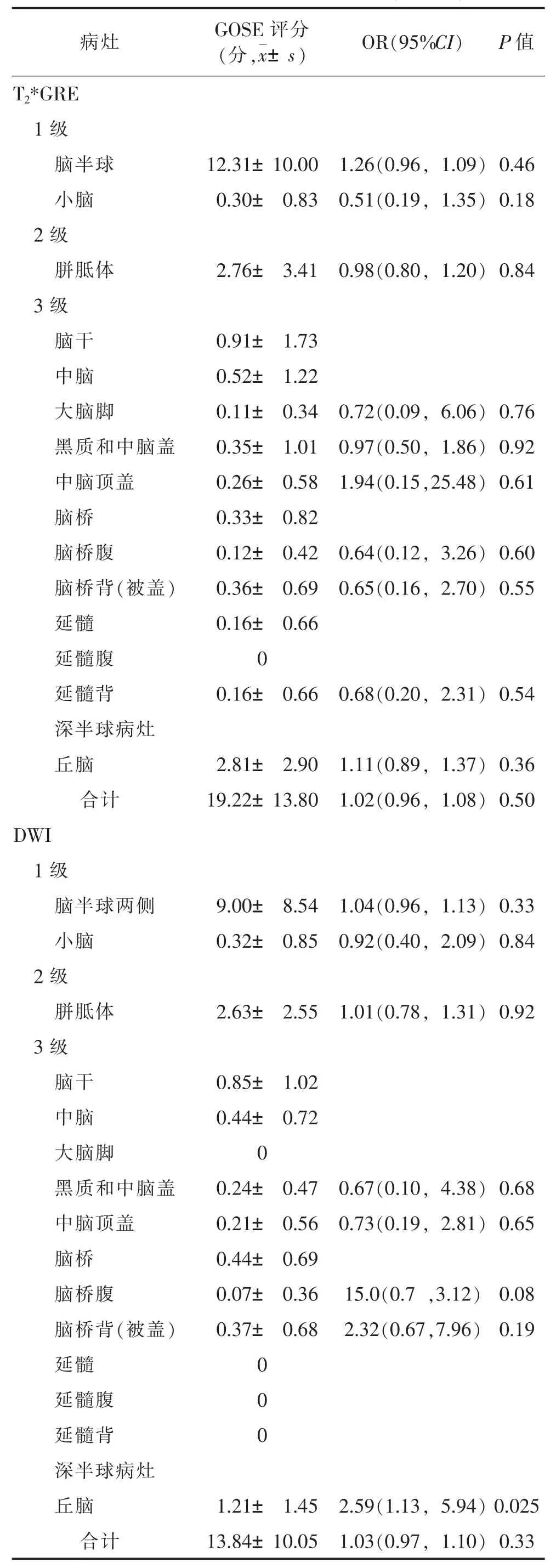
表2 Logistic分析DAI病灶与长期预后(GOSE)的关系
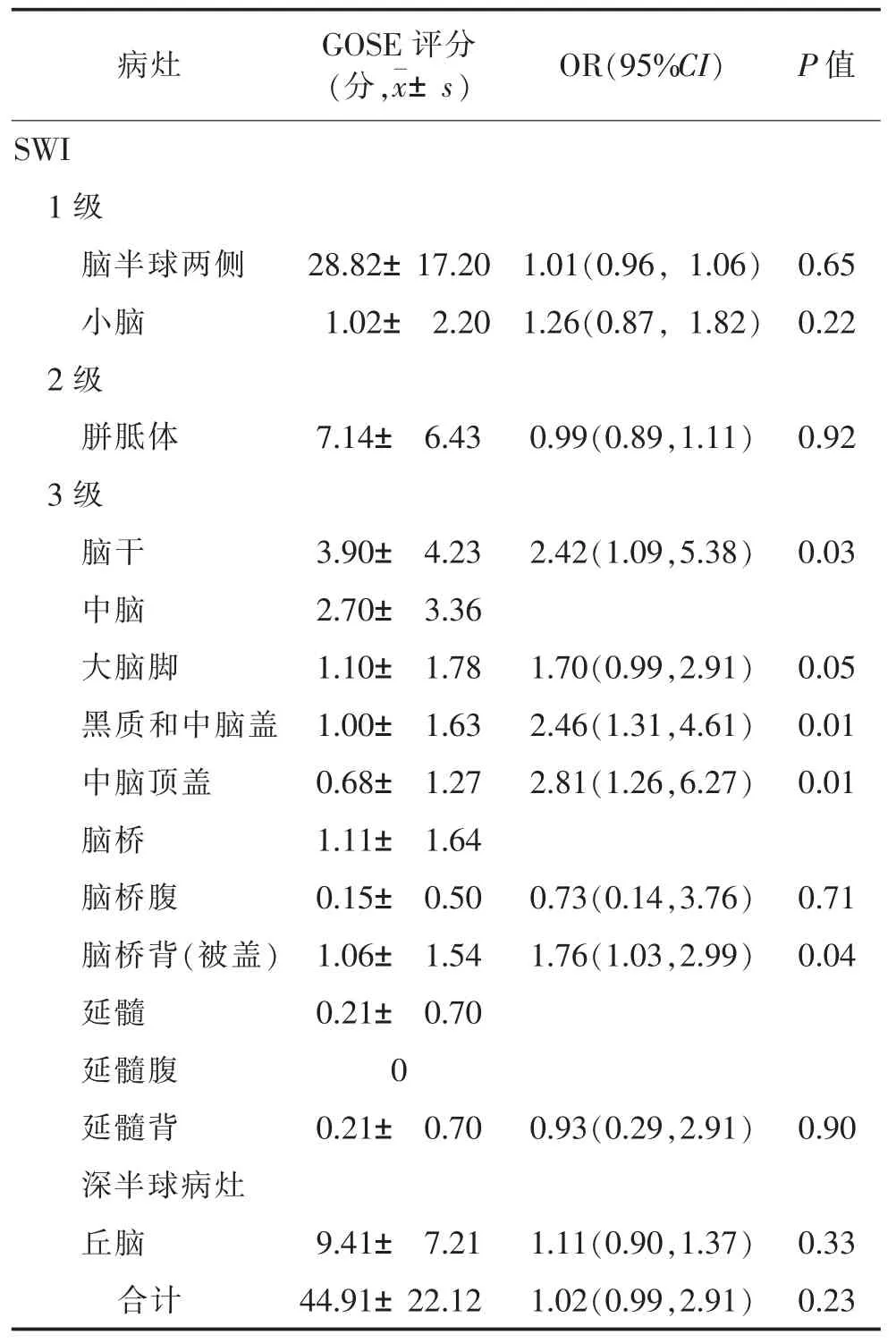
(续)表2 Logistic分析DAI病灶与长期预后(GOSE)的关系
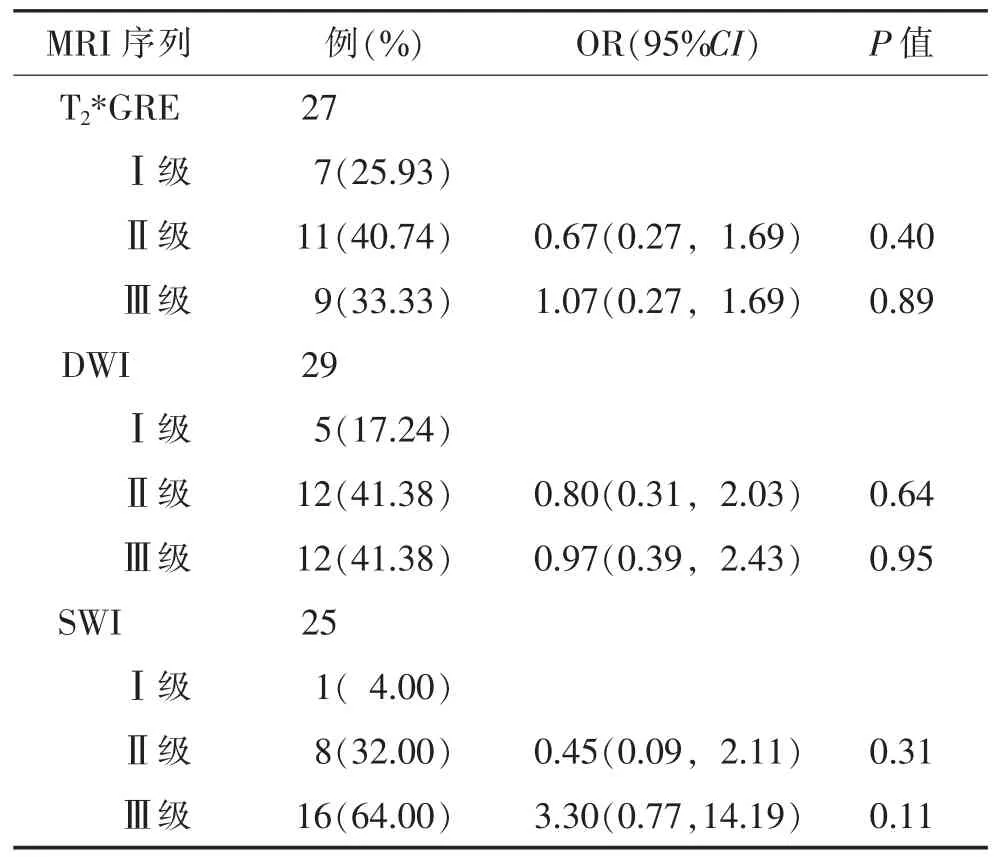
表3 MRI所示病灶分级
2.5 多变量分析预后因子 以GOSE为因变量进行多变量分析,结果显示,DWI序列显示的丘脑病灶及SWI序列显示的黑质和中脑被盖区病灶均与长期不良预后显著相关(均P<0.05)。≥30岁患者的黑质和中脑被盖出血性病灶与长期不良预后独立相关(P=0.012)。
3 讨论
3.1 MRI序列病灶分布 MRI因诊断准确率高,已成为临床检测出血和非出血性DAI病灶的首选方式[8]。DWI可显示非出血病灶,T2*GRE 和 SWI可显示出血病灶,但SWI序列能更好地显示组织间的敏感性差异,因此对出血病灶的敏感性高于T2*GRE。以往研究[9]证明,SWI比T2*GRE显示更多的微出血病灶,与本研究结果一致。但由于脱氧、缺血可能被误读为出血性病灶,使得SWI序列比T2*GRE和DWI序列更难鉴别[10]。SWI发现的病灶数量多于DWI,但DWI序列中,细胞水肿增加了信号强度,T2信号也增强,两者可见不同的损伤改变,各有优势[11-12]。
本研究中,患者在受伤后的1周内接受MRI检查,DWI序列出血性病灶似乎在急性期后仍然存在,因此采用DWI序列时,更要重视检查时机。本研究发现额叶、颞叶及胼胝体均有病灶。脑干病灶比例最高且主要在中脑和上脑桥。Moen等[13]研究了128例DAI患者,在0~28 d内接受MRI检查,发现DWI序列显示胼胝体病灶是预后最重要的预测因子,与本研究结果不同。然而,其研究包含了不同程度的脑外伤患者,其中31%的患者存在转移性肿块病灶。另有研究[14-15]表明,基底神经节和内囊深部病灶,特别是丘脑病灶可预测DAI的不良预后。丘脑病灶也被认为是植物生存状态的主要特征。此种相关性可在DWI序列深度幕上病灶中发现,但调整了其他预后因素后,此种相关性失去了意义。单因素分析显示,SWI序列中脑顶盖和背侧脑桥与长期不良预后相关。然而,多因素分析发现仅黑质和中脑被盖病灶具有独立的预后价值。多项研究[16-18]发现,DAI相关病灶中,脑干病灶最具争议。浅表脑干病灶可能是受脑干幕缘影响,而深部病灶可能是真正的损伤机制,因此深部病灶与长期不良预后存在较强的相关性。
多因素分析显示,脑室和顶盖病灶位于浅表部位,与长期不良预后无显著联系。与T2*GRE相比,SWI对出血灶的检测检出率更高,因此可对脑干病灶进行更精准的定位。仅使用T2*GRE,可能漏掉中脑中部区域的病灶,因此建议行T2*GRE序列扫描后,再补充SWI序列。
3.2 预后因素分析 多项研究[19-20]显示老年DAI患者死亡率更高,长期预后更差。本研究中,患者平均年龄(31.21±4.62)岁,比一般的DAI患者年轻。年龄,无论是作为连续变量还是作为二分类变量,在调整其他预后因素后,仍是长期不良预后的独立预测因素。此外,本研究发现在入院和出院时,GMS检测到长期不良预后与意识水平下降之间存在关联;但调整其他因素之后,未发现GMS的任何独立预后预测价值。
3.3 MRI分级标准分析 本组DAI患者中,70%的患者脑干病灶符合Adams 3级。然而,Adams分级与长期预后无显著关系。本研究基于SWI序列,发现黑质和中脑被盖病灶,可作为长期不良预后指标。这些结果可补充Adams分级标准,从而建立MRI分级标准。最近的一项研究[21]成果为MRI分类标准的建立,增加了一种基于病理机制的方法,包括脑干损伤机制。结合本研究结果,笔者提出了一种基于Adams分级标准的DAI的MRI扩展分级标准:Ⅰ级,脑半球病灶;Ⅱ级,胼胝体病灶;Ⅲ级,脑干病灶;Ⅳ级,黑质和中脑被盖病灶。该扩展系统使用简单,具有显著的预后评估价值,但仍需进一步验证。
综上所述,SWI序列较T2*GRE和DWI序列更能识别与DAI相关的早期病灶。SWI序列显示的黑质和中脑被盖病灶与长期不良预后显著相关。笔者新提出的扩展MRI分级标准,可用于DAI患者的长期预后评估。
