BOLD-fMRl联合DTI在运动区脑肿瘤切除术中的应用
2019-07-29刘晓蕾黄国栋
叶 海 ,刘晓蕾 ,黄国栋 ,夏 军 ,
(1.安徽医科大学深圳二院临床学院医学影像科,广东 深圳518037;2.广东省深圳市第二人民医院 深圳大学第一附属医院a医学影像科,b神经外科,广东 深圳 518037)
对于侵及运动区的脑肿瘤,术前明确其侵犯范围,以及皮层运动功能区与皮层下白质纤维束的解剖学位置,对其进行全面评估,是制订手术方案的关键。手术既要尽可能将肿瘤全切除,又要最大程度地保护脑功能,否则术后并发症将严重影响患者的生活质量。Pillai等[1]应用 BOLD-fMRI、DTI技术及术中超声辅助神经导航结合神经电生理监测帮助术前正确评估肿瘤、锥体束和皮层激活区之间关系,从而制订合理手术计划,并在术中直观指导。传统判断皮层运动区主要根据解剖学标志,个体化差异较大,很难准确定位。而BOLD-fMRI不仅可准确定位皮层运动区,还可显示皮层运动区与肿瘤的位置关系。DTI是通过对脑白质纤维内水分子弥散运动的各向异性进行白质纤维的重建显示。本研究收集38例运动区脑肿瘤,旨在探讨BOLD-fMRl联合DTI对运动区脑肿瘤切除术前定位运动功能区的可行性。
1 资料与方法
1.1 一般资料 收集深圳市第二人民医院2016年8月至2018年10月收治的运动区脑肿瘤38例,其中男 27例,女 11例;年龄35~64岁,平均(56.2±11.3)岁;病程20 d~1年,中位时间2个月。纳入标准:①年龄<80岁;②肿瘤最大径1~5 cm;③肿瘤边缘距离邻近运动功能区距离≤3 cm;④肿瘤为单发;⑤肿瘤邻近的运动功能尚存,患侧肢体肌力≥3级。38例随机分为2组,试验组20例,术前均行DTI及BOLD-fMRI扫描;对照组18例,术前行DTI扫描。术前临床表现:肢体肌力下降29例,头痛、头晕23例,肢体感觉功能障碍9例,语言障碍3例。术后病理诊断为良性脑膜瘤12例,胶质瘤26例。
1.2 仪器与方法 采用Siemens Magnetom Prisma 3.0 T MRI扫描仪和64通道头线圈行头部扫描。结构像扫描采用自旋回波序列MP-RAGE矢状位扫描,层厚 1 mm,层数 192 层,TR/TE 2 530 ms/2.98 ms,空间分辨率为1 mm×1 mm×1mm。
BOLD-fMRI扫描时患者需精神言语正常,可遵嘱进行活动;扫描时需配合进行静息-运动的流程。采用EPI序列横断面扫描,方位平行于前后联合(即AC-PC 线),扫描层数 33 层,TR/TE 2 000 ms/30 ms,翻转角90°,空间分辨率3.5 mm×3.5 mm×4.2 mm。扫描前患者均接受手、脚训练,单手抓握可反映大脑手运动区,屈伸踝关节反映脚运动区。扫描时采用运动激发模式,患侧肢体完成(即静息-运动交替),共6个时相,静息和运动每个时相均为30 s,共180 s。
DTI采用横断面扫描,方位平行于前后联合(即AC-PC线),扫描层数 64层,TR/TE 8 000 ms/64 ms,翻转角90°,空间分辨率2 mm×2 mm×2 mm。
1.3 数据处理 BOLD-fMRI数据采用SPM 12软件进行处理,并将处理后的激活图像导入美敦力神经导航系统中与患者的T1WI结构像及DTI数据进行配准融合和三维重建。
1.4 手术治疗 对照组利用DTI图像显示脑肿瘤位置皮质下纤维束走行,试验组利用BOLD-fMRI显示运动功能区及DTI显示皮质下纤维束走行,术者可根据重建后的3D图像观察肿瘤、邻近皮质下纤维束及邻近运动区(左手运动区)的相对空间位置关系。38例均在显微镜下行肿瘤切除术。
1.5 统计学方法 采用SPSS 22.0软件,使用Fisher确切概率法统计试验组与对照组在手术全切率及致残率上的差异,以P<0.05为差异有统计学意义。
2 结果
2.1 BOLD-fMRI、DTI结果 手运动区位于中央前回中段(图1,2),7例出现同侧辅助运动区的激活;脚运动区位于中央沟近大脑镰处。试验组中16例肿瘤与皮质运动区的距离≤1 cm。DTI扫描后选择患侧纤维束进行重建融合,38例均成功显示患侧皮质下纤维束。
2.2 图像融合 将BOLD-fMRI、DTI及T1WI结构像进行融合重建,重建后可清晰显示脑肿瘤的部位、大小及形状等信息,邻近皮质下纤维束及对应的运动功能区均以不同颜色区别(图3)。
2.3 2组 手术切除情况 试验组20例中肿瘤全切16例,部分全切4例,全切率为80.00%;对照组18例中肿瘤全切者9例,部分全切9例,全切率为50.00%;2组手术全切率差异无统计学意义(P=0.087)。2组术中均成功避开手脚运动皮层激活区进行手术入路的设计及肿瘤的切除。
2.4 2组 术后致残率比较 试验组术后运动障碍6例,运动功能保存14例,致残率为30.00%;对照组术后运动障碍12例,运动功能保存6例,致残率为 66.67%;2组差异有统计学意义(P<0.05)。
3 讨论
本研究中38例对应的运动激活区均显示良好,部分因肿瘤占位效应或瘤周水肿影响出现轻度移位。部分患者BOLD激活区在解剖学运动皮质区内呈弥散分布,这可能是因为肿瘤的占位效应导致大脑皮层功能发生重塑[2]。脑功能区肿瘤可使邻近皮质沟 回 形 态 结 构 变 形 或 者 移 位[3]。Holodny 等[4]将BOLD-fMRI与DTI联合应用指导脑肿瘤手术,以明确肿瘤与功能区、白质传导束的关系,以及观察肿瘤对功能区及皮层下白质纤维束的影响,结果显示两者联合应用能明显减少术后并发症。利用DTI行大脑白质纤维成像,可重建脑白质主要纤维的解剖结构图,反映脑白质纤维的走向[5]。脑BOLD-fMRI是目前较成熟的脑功能成像技术,其依据功能活动区局部大脑血氧依赖水平的变化获得的信号改变,可明确定位皮层功能区,清晰显示皮层功能区与脑肿瘤之间的关系;缺陷是无法观察白质纤维束的走行,而白质纤维束对手术计划的制订同样重要。DTI可提供脑白质的信息,清晰显示白质纤维束的走行,缺点是无法对皮层功能区进行精确定位。BOLD-fMRI与DTI具有互补性,两者单独使用均无法满足临床需要;两者联合应用可提供常规成像无法提供的脑肿瘤解剖结构及功能信息。Berntsen等[6]认为术前联合BOLD-fMRI和DTI检查可帮助术者选择合适的手术方式。本研究中单独使用DTI较联合应用BOLD-fMRI及DTI融合神经导航技术可更清晰显示皮层功能区及皮层下锥体束空间位置关系,在显示肿瘤的背景下,能使术者设计出更加合适的手术入路及手术方案,对提高肿瘤全切率、最大限度地保护运动功能、改善患者预后和生存质量都起着至关重要的作用。
传统的脑功能定位的方法是体感诱发电位(SSEPs)和皮层电刺激(ECS),缺点是需扩大手术视野、延长手术时间,手术风险随之增加。目前已有大量研究[7-9]证明,任务态BOLD-fMRI能够确定各种刺激任务时相应的脑功能区,与术中电刺激所获得的脑功能定位有很好的一致性。
尽管任务态BOLD-fMRI在术前脑功能定位方面有重要价值,但其在日常临床工作中仍存在一定局限性:①某些情况下患者无法配合完成特定的刺激任务,如意识不清、失语或肢体偏瘫等情况,因而无法获得准确的脑功能区定位信息[10];②一个特定的任务只能获得与该任务相关的脑功能激活区[11],某些肿瘤常累及多个脑功能区,提高了对患者配合程度的要求。因此,更全面、更有效地获得脑功能区定位图像已成为研究者们努力探索的方向。
综上所述,BOLD-fMRI和DTI联合成像在人脑的基础研究和临床应用方面具有很大的前景,但也有局限性[12-13],如部分容积效应的影响、图像伪影的处理、激活阈值的选择等均受人为因素的影响。
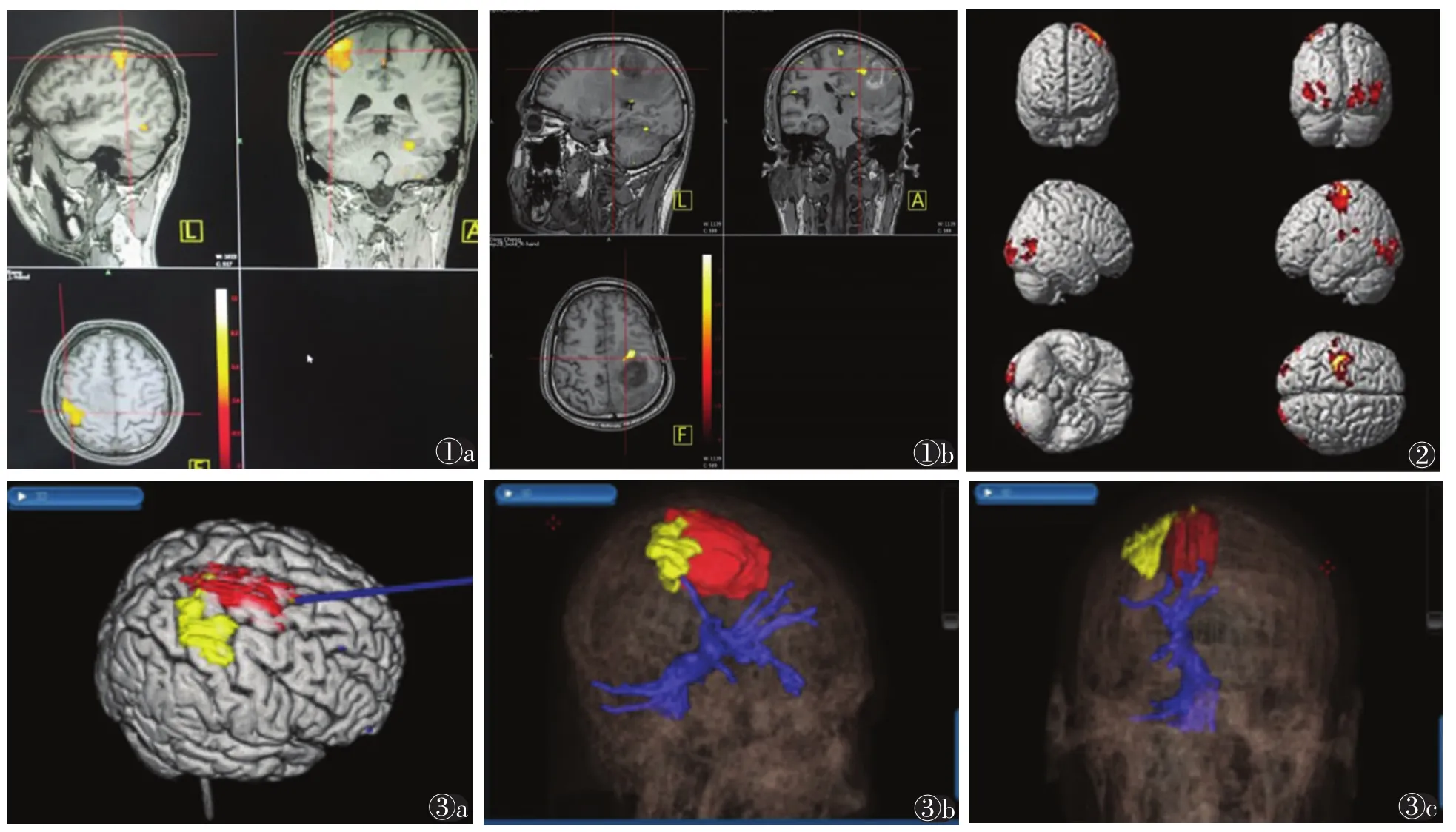
图1 女,31岁,行BOLD-fMRI检查后EPI图像与结构像的融合图像 图1a,1b 分别为左手握拳运动和右手握拳运动,T1WI结构像融合重建后可清晰分辨肿瘤与邻近手运动皮质激活区的位置关系 图2 女,39岁,行右手运动BOLD-fMRI检查后使用SPM12软件行后处理,3D图可清楚分辨激活区于脑沟回的位置关系,有利于术者准确定位运动功能区 图3 男,42岁,术前行BOLD-fMRI及DTI检查后,于导航系统中进行融合重建 图3a 肿瘤(红色区域)与左手运动区(黄色区域)相对位置 图3b,3c 皮质下纤维束(蓝色区域)与肿瘤(红色区域)及左手运动区(黄色区域)相对位置的3D图
