白屈菜碱对活化后大鼠肝星状细胞CFSC-8B的增殖、胶原合成及TGF-β1受体的影响Δ
2019-07-27李晓明林鹏飞董妙先徐天娇于春磊荣华王晓丽齐齐哈尔医学院医药科学研究院黑龙江齐齐哈尔6006齐齐哈尔医学院药学院黑龙江齐齐哈尔6006
李晓明,林鹏飞,董妙先,徐天娇,于春磊,荣华,王晓丽#(.齐齐哈尔医学院医药科学研究院,黑龙江齐齐哈尔 6006;.齐齐哈尔医学院药学院,黑龙江齐齐哈尔 6006)
肝星状细胞(Hepatic stellate cells)是一种位于肝脏的非实质细胞,肝星状细胞的活化、增殖是肝纤维化发生过程中结缔组织异常增生、肝内细胞外基质(Extracellular matrix,ECM)过度沉积的主要原因[1-2]。研究显示,肝纤维化发生后,若能经过积极的方法干预,抑制肝星状细胞的活化、增殖,肝纤维化的病理改变能发生可逆性恢复,从而避免肝纤维化进一步恶化为肝硬化,甚至肝癌[3-4]。因此,寻找一种能有效控制肝星状细胞活化、增殖的药物,对降低肝硬化和肝癌发病率具有重要意义。中药白屈菜为罂粟科白屈菜属多年生草本植物白屈菜(Chelidonium majusL.)的全草,花盛期割取地上部分,晒干或鲜用。其味苦,性凉,有毒,主要活性成分为白屈菜碱(Chelidonine)、原阿片碱、白屈菜红碱等生物碱,具有抗菌、镇痛、兴奋平滑肌作用,白屈菜治疗各种肿瘤在民间也广为流传,对多种肿瘤具有一定的抑制效果[5]。但关于白屈菜碱抑制肝纤维化的研究未见报道。笔者前期研究结果发现,白屈菜中活性成分白屈菜红碱可抑制肝纤维化小鼠的病理学改变[6],而白屈菜碱也是白屈菜中活性成分之一,因此,本文以转化生长因子β1(TGF-β1)活化大鼠肝星状细胞CFSC-8B为肝纤维化模型,观察白屈菜碱对TGF-β1活化后CFSC-8B的增殖和胶原合成的影响。
1 材料
1.1 仪器
UV-2550型紫外分光光度计、CKX41型倒置显微镜(日本Olympus公司);Countess C10227型细胞计数器(美国Invitrogen公司);3111型二氧化碳培养箱(美国Thermo公司);ELX800型全自动酶标仪(美国Bio-Tek公司);5417R型离心机(德国Eppendorf公司);Stratagene Mx3005P型实时定量聚合酶链式反应(PCR)仪(美国Agilent公司);HL-2000型分子杂交箱(美国UVP公司);JY-ZY2型转移电泳槽和JY-CZ1型单垂直电泳槽(北京君意东方电泳设备有限公司);SmartChemiⅡ型一体式微型化学发光成像仪(北京赛智创业科技有限公司);XPE504型分析天平(瑞士Mettler-Toledo公司)。
1.2 药品与试剂
白屈菜碱对照品(上海鼓臣生物技术有限公司,批号:18041303,纯度:≥98%);秋水仙碱片(西双版纳药业有限责任公司,批号:H53021369,规格:0.5 mg);TRIzol试剂(美国Ambion公司);实时荧光定量PCR试剂盒与逆转录试剂盒(宝生物工程大连有限公司);TGF-β1(批号:SF7926,纯度:98%)、细胞核蛋白与细胞浆蛋白抽提试剂盒均由上海碧云天生物技术有限公司提供;兔抗鼠TGF-β1受体(TβR)-Ⅰ多克隆抗体(美国Cell Signaling公司,批号:3);兔抗鼠TβR-Ⅱ多克隆抗体(美国Santa Cruz公司,批号:F1915);兔抗鼠磷酸甘油醛脱氢酶(GAPDH)多克隆抗体(美国Sigma公司,批号:106M4851V);山羊抗兔免疫球蛋白G(IgG)二抗(北京康为世纪生物科技有限公司,批号:00051405);ECL超敏发光检测试剂盒(北京索莱宝科技有限公司);α-平滑肌肌动蛋白(α-SMA)、TβR-Ⅰ、TβR-Ⅱ引物(上海生工生物工程有限公司合成);羟脯氨酸(Hydroxyproline,Hyp)试剂盒、CCK-8细胞活力检测试剂盒、Ⅰ型胶原蛋白(Col-Ⅰ)和Ⅲ型胶原蛋白(Col-Ⅲ)酶联免疫吸附试验(ELISA)试剂盒(南京建成生物工程研究所)。
1.3 细胞
大鼠肝星状细胞CFSC-8B购自赛百慷(上海)生物技术股份有限公司。
2 方法与结果
2.1 CFSC-8B细胞的培养与分组
用完全培养基培养大鼠肝星状细胞CFSC-8B,于37℃含5%CO2饱和湿度培养箱内孵育传代培养,取对数生长期细胞用于试验,以5×105mL-1接种于96孔板中,每孔加入100 μL。试验分为正常对照组、模型组、溶剂组(乙醇)、阳性对照组(1 μg/mL秋水仙碱乙醇溶液)和白屈菜碱低、中、高浓度组(2.1、4.2、8.4 μg/mL白屈菜碱乙醇溶液),每组3个复孔,各组加入药物浓度依据前期试验研究结果设定。模型组细胞中加入20 μg/L的TGF-β1作用 24 h 进行活化,促使肝纤维化[7],白屈菜碱低、中、高浓度组分别加入20 μg/L的TGF-β1和相应质量浓度的白屈菜碱乙醇溶液共同作用24 h,溶剂组加入20 μg/L的TGF-β1和乙醇溶液共同作用24 h,阳性对照组加入20 μg/L的TGF-β1和1 μg/mL秋水仙碱乙醇溶液共同作用24 h,正常对照组不加药物及TGF-β1。
2.2 CCK-8法检测细胞增殖
药物处理24 h后,按照CCK-8细胞活力检测试剂盒说明书中方法,在各孔中加入CCK-8溶液10 μL,37℃孵育2 h,置于酶标仪中,设定检测波长为450 nm,测定吸光度,计算细胞增殖率:细胞增殖率(%)=(正常对照孔的吸光度-加药孔的吸光度)/(正常对照孔的吸光度-空白孔的吸光度)×100%,式中空白孔只含有培养基和CCK-8,不含细胞和药物。
2.3 酶消化法检测细胞上清液中Hyp含量
药物处理24 h后,吸取细胞上清液,按照Hyp试剂盒说明书中方法进行消化操作后,置于酶标仪中,设定检测波长为550 nm,测定吸光度,计算上清液中Hyp含量。
2.4 ELISA法检测细胞上清液中Col-Ⅰ和Col-Ⅲ水平
药物处理24 h,按照Col-Ⅰ和Col-ⅢELISA试剂盒说明书中方法处理上清液,置于酶标仪中,设定检测波长为450 nm,测定吸光度,计算上清液中Col-Ⅰ和Col-Ⅲ水平。
2.5 Western blot法检测细胞中TβR-Ⅰ、TβR-Ⅱ蛋白的表达
药物处理24 h后,参照文献处理方法[8],收集细胞,加入裂解液,按照试剂盒说明书操作提取CFSC-8B细胞总蛋白,采用二喹啉甲酸(BCA)法定量蛋白浓度,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),进行蛋白分离,湿转法转至偏二氟乙烯(PVDF)膜上,5%脱脂奶粉室温下封闭2 h。加入兔抗鼠TβR-Ⅰ、TβR-Ⅱ和GAPGH多克隆抗体(1∶1 000)4℃孵育过夜,次日TBST缓冲液洗膜3次,再加入山羊抗兔IgG二抗(1∶1 000)37℃孵育2 h。利用ECL超敏发光检测试剂盒检测,一体式微型化学发光成像仪扫描,分析各蛋白质印迹条带的光密度,以目标蛋白与内参(GAPDH)光密度的比值计算目标蛋白的表达量,再与正常对照组的比值计算目标蛋白的相对表达量。
2.6 实时荧光定量-PCR法检测细胞中α-SMA、TβR-Ⅰ和TβR-ⅡmRNA的表达
药物处理24 h后,收集细胞,根据RNA提取试剂盒说明书中方法提取细胞总RNA,各取1 μg总RNA进行逆转录,获得cDNA。再以cDNA为模板,依照实时荧光定量-PCR试剂盒说明书操作进行PCR反应,检测细胞中α-SMA、TβR-Ⅰ和TβR-Ⅱ mRNA的表达。反应条件:95℃预变性4 min;95℃变性20 s,60℃退火30 s,72℃延伸30 s,共循环40次。以GAPDH作为内参基因,采用2-ΔΔct法计算细胞中α-SMA、TβR-Ⅰ和TβR-Ⅱ mRNA相对表达量。引物序列及片断长度见表1。

表1 引物序列及片断长度Tab 1 Primer sequence and fragment length
2.7 统计学方法
采用SPSS 13.0软件进行统计分析。计量资料以±s表示。用单因素方差分析进行多组间差异显著性比较,采用SNK检验进行组间两两比较。P<0.05表示差异有统计学意义。
3 结果
3.1 白屈菜碱对CFSC-8B细胞增殖的影响
与正常对照组比较,模型组细胞增殖率显著升高(P<0.05)。与模型组比较,阳性对照组和白屈菜碱中、高浓度组细胞增殖率显著降低(P<0.05),并且白屈菜碱高浓度组细胞增殖率降低程度较中浓度组更显著(P<0.05);白屈菜碱低浓度组细胞增殖率无明显变化(P>0.05)。因白屈菜碱低浓度组细胞增殖率无明显变化,故仅选用白屈菜碱中、高浓度组进行后续试验。各组细胞增殖率测定结果见图1。

图1 各组细胞增殖率测定结果(±s,n=10)Fig 1 Results of cell proliferation rate in each group(±s,n=10)
3.2 白屈菜碱对CFSC-8B细胞上清液中Hyp、Col-Ⅰ和Col-Ⅲ水平的影响
与正常对照组比较,模型组细胞上清液中Hyp、Col-Ⅰ和Col-Ⅲ水平显著升高(P<0.05)。与模型组比较,阳性对照组和白屈菜碱中、高浓度组细胞上清液中Col-Ⅰ水平显著降低(P<0.05),白屈菜碱高浓度组和阳性对照组细胞上清液中Hyp、Col-Ⅲ水平显著降低(P<0.05)。与白屈菜碱中浓度组比较,白屈菜碱高浓度组细胞上清液中Col-Ⅰ水平显著降低(P<0.05),Hyp、Col-Ⅲ水平有所下降,但差异无统计学意义(P>0.05)。各组细胞上清液中Hyp、Col-Ⅰ和Col-Ⅲ水平测定结果见表2。
表2 各组细胞上清液中Hyp、Col-Ⅰ和Col-Ⅲ水平测定结果(x±s,n=6)Tab 2 Results of levels determination of Hyp,Col-Ⅰ and Col-Ⅲ in cell supernatant of each group(±s,n=6)

表2 各组细胞上清液中Hyp、Col-Ⅰ和Col-Ⅲ水平测定结果(x±s,n=6)Tab 2 Results of levels determination of Hyp,Col-Ⅰ and Col-Ⅲ in cell supernatant of each group(±s,n=6)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与白屈菜碱中浓度组比较,ΔP<0.05Note:vs.normal control group,*P<0.05;vs.model group,#P<0.05;vs.chelidonine medium concentration group,ΔP<0.05
Col-Ⅲ,μg/L 23.51±1.62 40.43±2.66*40.27±2.17 37.57±2.57 34.14±1.97#28.71±1.81#组别正常对照组模型组溶剂组白屈菜碱中浓度组白屈菜碱高浓度组阳性对照组Hyp,mg/L 1.85±0.10 2.94±0.20*2.94±0.18 2.67±0.18 2.42±0.14#2.23±0.19#Col-Ⅰ,μg/L 13.83±0.85 24.91±1.45*25.08±1.86 21.43±1.35#18.62±1.39#Δ 16.29±1.20#
3.3 白屈菜碱对CFSC-8B细胞中TβR-Ⅰ、TβR-Ⅱ蛋白表达的影响
与正常对照组比较,模型组细胞中TβR-Ⅰ、TβR-Ⅱ蛋白表达显著升高(P<0.05)。与模型组比较,阳性对照组和白屈菜碱中、高浓度组细胞中TβR-Ⅰ、TβR-Ⅱ蛋白表达显著降低(P<0.05)。与白屈菜碱中浓度组比较,白屈菜碱高浓度组细胞中TβR-Ⅰ、TβR-Ⅱ蛋白表达显著降低(P<0.05)。各组细胞中TβR-Ⅰ、TβR-Ⅱ蛋白表达的电泳图见图2,测定结果见图3。
图2 各组细胞中TβR-Ⅰ、TβR-Ⅱ蛋白表达的电泳图Fig 2 Electropherogram of protein expression of TβR-Ⅰand TβR-Ⅱ in cells of each group
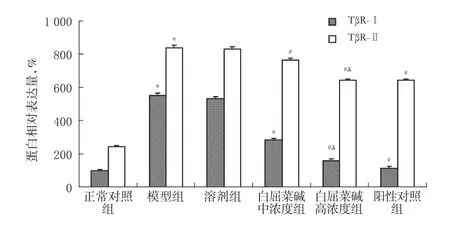
图3 各组细胞中TβR-Ⅰ、TβR-Ⅱ蛋白表达测定结果(n=3)Fig 3 Results of protein expression of TβR-Ⅰ andTβR-Ⅱ in cells of each group(n=3)
3.4 白屈菜碱对CFSC-8B细胞中α-SMA、TβR-Ⅰ、TβR-Ⅱ mRNA表达的影响
与正常对照组比较,模型组细胞中α-SMA、TβR-Ⅰ、TβR-ⅡmRNA表达显著升高(P<0.05)。与模型组比较,阳性对照组和白屈菜碱中、高浓度组细胞中α-SMA、TβR-Ⅰ、TβR-ⅡmRNA表达显著降低(P<0.05)。与白屈菜碱中浓度组比较,白屈菜碱高浓度组细胞中TβR-Ⅰ、TβR-ⅡmRNA表达显著降低(P<0.05);α-SMA mRNA表达有所下降,但差异无统计学意义(P>0.05)。各组细胞中α-SMA、TβR-Ⅰ、TβR-ⅡmRNA相对表达量测定结果见表3。

表3 各组细胞中α-SMA、TβR-Ⅰ、TβR-Ⅱ mRNA相对表达量测定结果(x±s,n=3)Tab 3 Results of mRNA expressions of α-SMA,TβR-Ⅰand TβR-Ⅱ in cells of each group(x±s,n=3)
4 讨论
活化的肝星状细胞是引发肝纤维化的细胞学基础,在肝纤维化病变过程中扮演重要角色[9]。当肝脏受到损伤、炎症等各种致病因素的作用时,处于静止期的肝星状细胞被激活,转化成为肌成纤维样细胞。肌成纤维样细胞分泌多种促炎因子和促纤维化因子,细胞中α-SMA合成增加并产生大量以Col-Ⅰ、Col-Ⅲ为主的ECM成分,并在肝脏内过度沉积,形成肝纤维化[10]。可见,观察Col-Ⅰ、Col-Ⅲ含量变化,是评价肝星状细胞活化、增殖以及胶原蛋白合成的重要依据。Hyp是胶原组织代谢的重要产物,且为胶原中特有的氨基酸,观察Hyp含量变化,对于判断肝星状细胞的增殖、ECM的沉积、肝纤维化的程度具有重要意义[11]。因此本研究检测了外源性TGF-β1活化的肝星状细胞的增殖、Hyp含量和Col-Ⅰ、Col-Ⅲ水平,结果显示,TGF-β1诱导活化的肝星状细胞,通过白屈菜碱干预后,当白屈菜碱质量浓度为4.2、8.4 μg/mL时,与模型组比较,细胞增殖率显著降低(P<0.05),而白屈菜碱质量浓度为2.1 μg/mL时细胞增殖率差异无统计学意义(P>0.05),因此在后续试验中只保留白屈菜碱的4.2、8.4 μg/mL(中、高)浓度组。模型组细胞中Hyp含量、Col-Ⅰ和Col-Ⅲ水平较正常对照组显著升高,说明本研究中肝星状细胞活化成功。而与模型组比较,白屈菜碱中浓度组细胞中Col-Ⅰ含量显著降低(P<0.05),Col-Ⅲ及Hyp含量差异无统计学意义(P>0.05);白屈菜碱高浓度组细胞中Hyp含量、Col-Ⅰ和Col-Ⅲ水平均显著降低,说明白屈菜碱能够抑制大鼠肝星状细胞的增殖和胶原合成。
TGF-β1是公认的重要的致纤维化因子,在肝纤维化的形成、发展中起着重要的作用[12]。其通过促进肝星状细胞活化、增殖,产生前胶原mRNA,使肝星状细胞失去脂质液滴,逐渐向肌成纤维样细胞和成纤维细胞的转化,促进胶原蛋白的合成与沉积,并最终导致肝纤维化[13]。De Bleser PJ等[14]研究发现,TGF-β1在激活的肝星状细胞中的表达量是静止时的12倍,而外源性TGF-β1又可以促进肝星状细胞的活化,刺激肝星状细胞持续合成ECM。TβR-Ⅰ、TβR-Ⅱ是具有丝苏氨酸激酶活性的转膜蛋白,由胞外区、胞内区和跨膜区组成,在细胞膜表面具有高亲和力,同属TβR的亚型,在组织中分布最为广泛[15]。TβR-Ⅰ的胞内侧富含高度保守的丝氨酸-甘氨酸序列(GS)区域,是 TβR-Ⅰ特有的,而TβR-Ⅱ的胞内侧含有丝氨酸-苏氨酸激酶功能区,具有磷酸化功能[16]。活化的TGF-β1首先结合TβR-Ⅱ,形成异聚体复合物,然后寡集并磷酸化TβR-Ⅰ,使丝氨酸-苏氨酸残基立体构像改变,从而具有激酶活性,激活胞内信号分子Smads蛋白,继续TGF-β1的信号转导[17]。因此本研究用TGF-β1活化肝星状细胞,观察白屈菜碱对大鼠肝星状细胞TβR-Ⅰ、TβR-Ⅱ表达的干预作用。本研究显示,与正常对照组比较,模型组细胞中TβR-Ⅰ、TβR-ⅡmRNA表达和TβR-Ⅰ、TβR-Ⅱ的蛋白表达显著升高;与模型组比较,白屈菜碱中、高浓度组细胞中TβR-Ⅰ、TβR-ⅡmRNA表达和TβR-Ⅰ、TβR-Ⅱ的蛋白表达显著降低。
以上结果表明,白屈菜碱对TGF-β1活化的肝星状细胞具有一定的增殖抑制作用,进而说明其具有逆转肝纤维化的作用。白屈菜碱为白屈菜的主要活性成分之一,因此,白屈菜可能成为临床治疗肝纤维化的潜在中药。通过本研究,旨在为白屈菜在临床应用提供理论依据,同时为中药的现代化奠定基础。对于白屈菜碱抗纤维化作用机制还需进一步的研究。
