超滤法结合UPLC-MS/MS法研究树豆酮酸A在不同种属血浆中的血浆蛋白结合率Δ
2019-07-27班玉娟张丽陈瑞朱高峰王建塔陈文章汤磊黄静贵州医科大学药学院贵阳550004贵州省化学合成药物研发利用工程技术研究中心贵阳550004
班玉娟,张丽,陈瑞,朱高峰,,王建塔,,陈文章,汤磊,,黄静#(.贵州医科大学药学院,贵阳550004;.贵州省化学合成药物研发利用工程技术研究中心,贵阳 550004)
树豆酮酸A(Cajanonic acidA)是从树豆叶中分离出来的一种新的菧类化合物。已有体内和体外研究表明,树豆酮酸A具有降血糖活性[1],可促进人肝癌细胞HepG2对葡萄糖的消耗[2],可通过调节蛋白酪氨酸磷酸酯酶1B(Protein tyrosine phosphatase 1B,PTP1B)和相关胰岛素信号因子的表达来恢复胰岛素信号的转导,能有效降低2型糖尿病大鼠的空腹血糖、血清总胆固醇、三酰甘油及低密度脂蛋白胆固醇水平,能保护器官免受损伤[3];此外,树豆酮酸A还可以抑制脂肪细胞分化并降低各种脂肪形成相关mRNA的基因水平[4]。由此可见,树豆酮酸A是一个潜在的可开发用于治疗2型糖尿病或肥胖症的药物。
药物血浆蛋白结合率是指药物吸收后与血浆中所有蛋白结合的量占药物总量的百分比,是药动学的重要参数之一,药物与血浆蛋白的结合作用影响药物在体内的吸收、分布、代谢与排泄,从而影响其药理效应[5]。药物被吸收后,只有没有与血浆蛋白结合的游离药物才能通过生物膜并作用于靶器官发挥药理作用,因此测定药物与血浆蛋白的结合率在新药研发及临床研究中非常重要[6]。研究药物血浆蛋白结合率的方法有微透析法、平衡透析法、超滤法、超速离心法等[7],本研究采用超滤法联合超高效液相色谱-串联质谱(UPLC-MS/MS)法分别测定低、中、高3个质量浓度(2.5、5、20 μg/mL)的树豆酮酸A在大鼠、家兔及健康人血浆中的蛋白结合率,以期为树豆酮酸A的后期药效学、药理学和临床研究提供依据。树豆酮酸A的化学结构见图1。

图1 树豆酮酸A的化学结构Fig1 Chemical structure of cajanonic acidA
1 材料
1.1 仪器
Xevo G2-XS型UPLC-四级杆串联飞行时间质谱仪,配有MassLynx V4.1质谱工作站、UNIFI 7.0数据库(美国Waters公司);Amicon Ultra-0.5型超滤离心管(美国Millipore公司,截留相对分子量:10 000);pHS-3C型酸度计(上海雷磁仪器厂);ThermoShaker R制冷型恒温混匀仪(北京昊诺斯科技有限公司);JN300-2型氮气吹扫仪(苏州吉米诺仪器有限公司);X1型高速离心机(香港基因有限公司);FA805N型十万分之一电子天平(上海菁海仪器有限公司);HH-2型数显恒温水浴锅[邦西仪器科技(上海)有限公司]。
1.2 药品与试剂
树豆酮酸A对照品[由贵州医科大学药物化学重点实验室制备,批号:20181226,经高效液相色谱(HPLC)和核磁结构鉴定,纯度:>98%];健康人血浆(由贵州省血液中心提供,批号:20180608,许可证号:07001);磷酸盐缓冲液(PBS)干粉(北京索莱宝科技有限公司);甲醇、乙腈、乙酸乙酯和甲酸均为色谱纯,水为实验室自制超纯水,其他试剂均为分析纯。
1.3 动物
SPF级SD大鼠,♀♂各半,体质量200~230 g,实验动物生产合格证号:SCXK(湘)2014-0011;SPF级新西兰白兔,♀♂各半,体质量2.0~2.5 kg,实验动物生产合格证号:SCXK(湘)2014-0010。所有动物均购自长沙市天勤生物技术有限公司。
2 方法
2.1 血浆的采集
2.1.1 大鼠血浆 取SD大鼠,♀♂各半,股动脉取血,置于装有肝素钠溶液的EP管中,立刻于4℃、3 500 r/min离心10 min,分离上层血浆,-20℃冷冻贮存。
2.1.2 家兔血浆 取家兔,♀♂各半,心脏取血,置于装有肝素钠溶液的EP管中,立刻于4℃、3 500 r/min离心10 min,分离上层血浆,-20℃冷冻贮存。
2.2 溶液的制备
2.2.1 PBS 精密称取PBS干粉2.24 g,置于200 mL量瓶中,用超纯水溶解并稀释至刻度,摇匀,即得0.01 mol/L、pH 7.4的PBS,于4℃贮存,备用。
2.2.2 树豆酮酸A贮备液 精密称取树豆酮酸A对照品25.00 mg,置于25 mL量瓶中,加少量甲醇,超声(功率:600 W,频率:40 kHz)10 min使其溶解,再以pH 7.4的PBS定容,摇匀,即得1 mg/mL的树豆酮酸A贮备液。
2.3 样品预处理
取“2.6”项下超滤液与孵育液各100 μL分别置于EP管中,加入600 μL甲醇,涡旋混匀5 min后,以12 000 r/min离心10 min(均在4℃下进行)。取上清液于37℃下氮气吹干,加入400 μL蒸馏水与600 μL乙酸乙酯复溶,涡旋混匀5 min后,萃取,静置分层后取上层液于37℃下氮气吹干,再以100 μL甲醇复溶,12 000 r/min离心10 min,取上清液适量进样分析。
2.4 色谱条件与质谱条件
2.4.1 色谱条件 色谱柱为Waters BEH C18(50 mm×2.1 mm,1.7 μm);保护柱为 WatersVanGuard BEH C18(2.1 mm×5 mm,1.7 μm);流动相为0.01%甲酸溶液(溶剂A)和含0.01%甲酸的乙腈溶液(溶剂B),梯度洗脱(0~0.5 min,30%B;0.5~2 min,30%→98%B;2~3 min,98%B;3~5 min,98%→30%B;流速为0.15 mL/min);柱温为30 ℃;进样量为2 μL。
2.4.2 质谱条件 电喷雾电离源(ESI);负离子模式采集(Negative);毛细管电压为1.5 kV;锥孔电压为30 V;离子源温度为100℃;脱溶剂气温度为400℃;锥孔气流量为50 L/h;脱溶剂气流量为800 L/h;扫描范围为质荷比(m/z)50→1 200;数据采集分析软件为Masslynx V 4.1;数据采集模式为全扫描。
2.5 方法学考察
2.5.1 专属性 分别取大鼠、家兔及人血浆,按照“2.3”项下方法进行处理,制成3个种属的空白血浆样品;取树豆酮酸A贮备液分别以大鼠、家兔及人血浆稀释后,按照“2.3”项下方法进行处理,制成3个种属的树豆酮酸A血浆样品;取树豆酮酸A对照品以甲醇溶解,制成树豆酮酸A对照品溶液;取大鼠、家兔及人血浆孵育液及超滤液各100 μL,按照“2.3”项下方法进行处理,制成不同种属的孵育液及超滤液样品。处理后的样品及对照品按照“2.4”项下条件进行UPLC-MS/MS测定,考察该方法专属性。
2.5.2 线性关系、定量下限与检测限 精密量取一定量的1 mg/mL树豆酮酸A贮备液,用PBS逐一稀释制成0.05、0.1、0.2、0.5、1、2、5、10、26 μg/mL系列质量浓度的溶液,每个质量浓度取50 μL,平行3份,分别加入大鼠、家兔及人血浆950 μL,涡旋混匀1 min,置于37℃水浴中60 min后,各取100 μL按照“2.3”项下方法进行处理,再按照“2.4”项下条件进行UPLC-MS/MS测定,记录峰面积。以树豆酮酸A的峰面积为纵坐标(y)、树豆酮酸A质量浓度为横坐标(x,μg/mL)进行线性回归。以线性范围下限为定量下限,以信噪比3∶1对应的质量浓度为检测限。
2.5.3 精密度与回收率 参考文献[8]中方法,精密量取一定量的1 mg/mL树豆酮酸A贮备液,以PBS稀释后,各取50 μL,分别加入大鼠、家兔及人血浆950 μL,制成质量浓度分别为2.5、5、20 μg/mL的树豆酮酸A质控(QC)血浆样品,取100 μL按照“2.3”项下方法进行处理,再按照“2.4”项下条件进行UPLC-MS/MS测定,记录峰面积,平行5份,每日测5次,考察日内精密度,并将峰面积代入回归方程计算树豆酮酸A浓度,以测得浓度/理论浓度×100%计算回收率;连续进样5 d,考察日间精密度。
2.5.4 基质效应 按“2.5.3”项下方法制备低、中、高质量浓度(2.5、5、20 μg/mL)3个种属的树豆酮酸A QC血浆样品(平行6份),按照“2.3”项下方法进行处理,再按照“2.4”项下条件进行UPLC-MS/MS测定,测得峰面积(A1)。另以甲醇配制相同低、中、高质量浓度的树豆酮酸A的QC样品(不含基质,平行6份),按照“2.4”项下条件进行UPLC-MS/MS测定,测得峰面积(A2),以A1/A2计算基质效应。
2.5.5 稳定性 按“2.5.3”项下方法制备低、中、高质量浓度(2.5、5、20 μg/mL)3个种属的树豆酮酸A QC血浆样品,将样品分别放置于冰箱冷藏(4℃)、室温(约20℃)、孵育温度(37℃)条件下12 h和反复冻融(4℃冷冻,37 ℃融化)3次后,按照“2.3”项下方法处理,再按照“2.4”项下方法进行UPLC-MS/MS测定,平行5份,考察其稳定性。
2.6 血浆蛋白结合率测定
参考文献[9]中方法,精密量取一定量的1 mg/mL树豆酮酸A贮备液,以PBS分别稀释制成50、100、400 μg/mL 3个质量浓度的树豆酮酸A溶液,备用。取相应树豆酮酸A溶液50 μL(每个质量浓度平行3份),分别加入950 μL大鼠、家兔及人血浆,涡旋混匀,制成2.5、5、20 μg/mL的树豆酮酸A血浆样品。将其置于37℃恒温水浴中孵育60 min,得孵育液。将孵育液取出置于冰上(保持低温4℃左右),移500 μL至超滤管中,于低温冷冻离心机中,在4℃、12 000 r/min下离心20 min,得超滤液。取孵育液及超滤液各100 μL按照“2.3”项下方法进行处理,分别取上清液按照“2.4”项下条件进行UPLCMS/MS测定,代入回归方程算得孵育液和超滤液中树豆酮酸A的质量浓度,根据公式(1)计算血浆蛋白结合率:
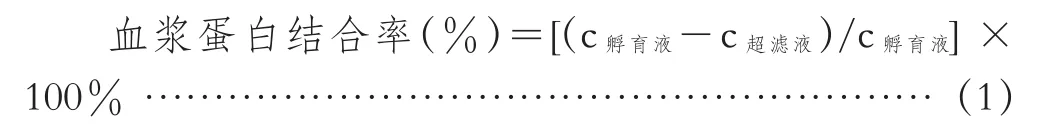
式中,c孵育液表示超滤前孵育液中树豆酮酸A的质量浓度(μg/mL);c超滤液表示超滤液中树豆酮酸A的质量浓度(μg/mL)。将实验数据用SPSS 20.0软件进行统计分析,分别对同种种属中不同质量浓度之间树豆酮酸A的血浆蛋白结合率进行单因素方差分析,不同种属之间树豆酮酸A的血浆蛋白结合率进行独立样本t检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 方法学考察结果
3.1.1 专属性 大鼠、家兔和人3个种属间的空白血浆样品、树豆酮酸A血浆样品及其孵育液、超滤液样品经处理后进样得到的色谱图基本一致,因此以人血浆为基质制备的样品所得色谱图作为代表图,省略以大鼠血浆与家兔血浆为基质制备的样品色谱图。空白人血浆样品、树豆酮酸A对照品、加入树豆酮酸A的人血浆样品、树豆酮酸A人血浆孵育液及超滤液样品的色谱图见图2。

图2 总离子流图Fig 2 TIC chromatogram
由图2所示,该检测方法下,树豆酮酸A的保留时间为1.25 min,在进样0.75~2.00 min之间只有树豆酮酸A的色谱峰较明显,无其余相邻干扰峰,且空白血浆样品的1.25 min位置上没有出现色谱峰,该方法专属性良好。3.1.2 线性关系、定量下限与检测限 结果表明,该检测方法下,树豆酮酸A在0.05~26 μg/mL质量浓度范围内线性关系良好(r均>0.999 5),定量下限为0.05 μg/mL,检测限为0.01 μg/mL。树豆酮酸A在不同种属血浆中的回归方程及线性范围见表1。

表1 树豆酮酸A在不同种属血浆中的线性关系Tab 1 Results of linear relationship of cajanonic acid A
3.1.3 精密度与回收率 结果表明,树豆酮酸A在大鼠、家兔和人血浆中的回收率为(86.03±2.36)%~(103.80±1.32)%,日内和日间RSD均<10%(n=5),符合生物样品分析方法要求。精密度与回收率结果见表2。3.1.4 基质效应 结果表明,树豆酮酸A在大鼠、家兔和人血浆中的基质效应为(91.16±5.89)%~(104.70±4.73)%,可见该方法基质效应小,具有特异、专属地测定分析该待测物的能力。基质效应结果见表3。

表2 精密度与回收率结果(n=5)Tab 2 Results of precision and recovery(n=5)
表3 基质效应结果(±s,n=6)Tab 3 Results of matrix effects(±s,n=6)

表3 基质效应结果(±s,n=6)Tab 3 Results of matrix effects(±s,n=6)
血浆样品大鼠家兔人基质效应,%2.5 μg/mL 92.42±5.42 101.30±6.11 91.26±5.89 5 μg/mL 104.70±4.73 96.54±4.29 99.62±4.26 20 μg/mL 98.39±5.24 103.50±4.86 102.10±3.63
3.1.5 稳定性 结果表明,稳定性试验中含量的RSD均<10%(n=5),可见该方法稳定性较好,符合生物样品分析方法要求。稳定性试验结果见表4。

表4 稳定性试验结果(n=5)Tab 4 Results of stability tests(n=5)
3.2 血浆蛋白结合率
结果表明,不同质量浓度的树豆酮酸A在同一种属血浆中的血浆蛋白结合率差异存在统计学意义(P<0.05),中、高质量浓度的树豆酮酸A与同一种属血浆的血浆蛋白结合率高于低质量浓度。在低质量浓度时,树豆酮酸A在大鼠血浆与人血浆中的血浆蛋白结合率差异无统计学意义(P>0.05),均低于在家兔血浆中的血浆蛋白结合率(P<0.05);在中、高质量浓度时,树豆酮酸A在3个种属血浆中血浆蛋白结合率差异无统计学意义(P>0.05)。树豆酮酸A在不同种属血浆中的蛋白结合率见表5。
表5 树豆酮酸A在不同种属血浆中的蛋白结合率(±s,n=3)Tab 5 Protein binding rate of cajanonic acid A with different species of plasma(±s,n=3)

表5 树豆酮酸A在不同种属血浆中的蛋白结合率(±s,n=3)Tab 5 Protein binding rate of cajanonic acid A with different species of plasma(±s,n=3)
注:与家兔比较,*P<0.05Note:vs.rabbits,*P<0.05
血浆样品大鼠家兔人血浆蛋白结合率,%20 μg/mL 99.42±0.01 99.42±0.03 99.37±0.01 2.5 μg/mL 75.63±0.90*79.61±1.08 76.74±1.22*5 μg/mL 98.30±0.03 98.48±0.10 97.99±0.11
4 讨论
研究药物血浆蛋白结合率的方法有多种,其中超滤法和平衡透析法是较为经典、常用的方法[10]。平衡透析法是研究药物血浆蛋白结合率的经典方法,该法较简单、经济、受实验因素干扰小,但平衡透析法有透析平衡时间较长(通常37℃静置透析需要12~48 h达扩散平衡)、极易受血浆和缓冲液的pH影响以及透析设备表面可能会非特异性药物吸附效应等缺点[11]。而超滤法操作简便、测定快速、生物样品量少,能减少设备表面非特异性的吸附,考虑到以上原因,本研究选择超滤法测定树豆酮酸A的血浆蛋白结合率。此外,孵育液中混有磷酸盐及蛋白、超滤液中可能残余有磷酸盐及少量蛋白,会堵塞离子阱质谱的传输毛细管,因此采用甲醇沉淀蛋白法,再用乙酸乙酯萃取对其进行前处理。树豆酮酸A在4℃、室温及37℃下12 h内皆稳定,RSD均<10%,因此在37℃下孵育及用氮气将其吹干对实验结果无影响。预实验考察过树豆酮酸A血浆样品在37℃下孵育60 min,树豆酮酸A与血浆蛋白的结合已达到平衡状态。还应注意,用pH 7.4的PBS制备的树豆酮酸A应该即配即用,以防止因久置而使树豆酮酸A在PBS中发生转化。
本研究采用超滤法结合UPLC-MS/MS法测定2.5、5、20 μg/mL 3个质量浓度的树豆酮酸A在大鼠、家兔和人血浆中的血浆蛋白结合率,质量浓度为2.5 μg/mL时,在大鼠、家兔和人血浆的蛋白结合率分别为(75.63±0.90)%、(79.61±1.08)%、(76.74±1.22)%;质量浓度为5 μg/mL时的血浆蛋白结合率均在98%左右;质量浓度为20 μg/mL时的血浆蛋白结合率均在99%左右。结果表明,各质量浓度树豆酮酸A与人血浆和大鼠血浆的蛋白结合率皆无明显差异,但在低质量浓度时在家兔血浆中的蛋白结合率明显高于大鼠和人。在新药研发早期阶段,可通过表征其在体外血浆蛋白结合率的情况,对实验动物与人进行不同种属间的结合率差异比较研究,为动物实验结果外推至人体提供有益参考。本研究为进一步的临床前药效、药动和毒理研究中模型动物的选择提供了参考依据。
树豆酮酸A与血浆蛋白的结合具有浓度依赖性,药物浓度升高其血浆蛋白结合率随之升高,药物高浓度时结合率达到99%以上,这可能与药物的理化性质及血浆蛋白的结合性质有关。具有浓度依赖性或高血浆蛋白结合的药物临床使用需注意控制剂量,防止因药物与血浆蛋白结合而达不到有效血药浓度,更需注意的是,高血浆蛋白结合的药物临床使用易产生安全性问题,一旦有影响血浆蛋白结合的因素产生,例如与其他高血浆蛋白结合率药物联合用药时,游离药物浓度则可能成倍增加,造成药物副作用或毒性[12]。本研究结果显示,树豆酮酸A有很强的血浆蛋白结合率,所以在接下来的研究中需选择在临床有可能联合用药的高血浆蛋白结合率药物进行体外药物竞争结合试验[13],以考察其对树豆酮酸A蛋白结合率的影响,保证人体用药安全。
