USP18促进溶瘤病毒诱导的肝癌细胞凋亡机制
2019-07-26朱海珍陈瑾文许艳薛斌斌王鑫涛邓日林田仁云陈生稳王静静黄湘
朱海珍 陈瑾文 许艳 薛斌斌 王鑫涛 邓日林 田仁云 陈生稳 王静静 黄湘
摘 要:NDV感染肝癌細胞后,能够诱导细胞的凋亡,在NDV感染肝癌细胞Huh7之后,能够诱导一种去泛素化酶USP18的表达显著上调. 为了探究USP18在NDV诱导的肝癌细胞的凋亡过程中起什么作用,以肝癌细胞系Huh7为实验体系,以western blot蛋白免疫印迹和定量PCR为主要方法. 在细胞中过表达USP18,发现其能够明显促进肝癌细胞的凋亡,这表明USP18具有抗癌的功能.反之,敲低细胞中USP18的表达水平,能够有效地抑制NDV诱导的肝癌细胞凋亡.进一步揭示了USP18促进NDV诱导的细胞凋亡的机制,USP18上调了定位于线粒体上的Bax的蛋白水平,Bax能与Bak在线粒体外膜上形成孔道,增加线粒体外膜的通透性,从而促进凋亡蛋白细胞色素C的释放.同时,USP18还能诱导NOXA切割效应凋亡蛋白Caspase-7,进一步促进细胞凋亡.此外,USP18上调干扰素刺激基因ISG12a(IFN-stimulated gene 12a)的蛋白水平,抑制ISG12a的泛素化降解,这也是从另一个角度解释了其促进凋亡作用.
关键词:线粒体;肝癌细胞;USP18;NDV;细胞凋亡;Bax;NOXA;ISG12a
中图分类号:Q71 文献标志码:A
USP18 Promotes Apoptosis of Liver Cancer Cells Induced by NDV
ZHU Haizhen1,2,3,CHEN Jinwen1,2,3,XU Yan1,2,3,XUE Binbin1,2,3,WANG Xintao1,2,3,
DENG Rilin1,2,3,TIAN Renyun1,2,3,CHEN Shengwen1,2,3,WANG Jingjing1,2,3,HUANG Xiang1,2,3
(1. College of Biology,Hunan University,Changsha 410082,China;
2. Institute of Pathogen Biology and Immunology,Hunan University,Changsha 410082,China;
3. State Key Laboratory of Chemo/Biosensing and Chemometrics,Hunan University,Changsha 410082,China)
Abstract: After NDV infects the liver tumour cell,USP18 (Ubiquitin Specific Protease 18) acts as a deubiquitin enzyme and cleaves ubiquitin from ubiquitinated protein substrates. NDV infection of liver tumour cell can induce the apoptosis of cancer cells. Infection with NDV up-regulates the expression of USP18,and the role of USP18 in the apoptosis induced by NDV was investigated. In this study, the liver tumour cell line Huh7 is taken as the system, and western blot and qualitative PCR are considered. It is found that USP18 promotes the apoptosis of cancer cells induced by NDV,which demonstrates that USP18 has the anticancer function. In contrast, knock-down of USP18 inhibits the apoptosis of the cancer cells, which reveals that USP18 can positively regulate the protein level of Bax and NOXA. Consistently,overexpression of USP18 enhances the permeability of mitochondrial membrane and promotes the release of CYTOCHROME C. Similarly, overexpression of USP18 increases the cleaved caspase-7 and strengthens the apoptosis as well. It is also found that USP18 can upregulate the protein level of ISG12a(IFN-stimulated gene 12a). It attenuates the ubiquitination degradation of ISG12a. The findings in this research provide a profound influence and a new insight towards treatment for liver cancer.
Key words: mitochondria;liver cancer cell;USP18;NDV;cell apoptosis;mitochondria;Bax;NOXA;ISG12a
细胞一旦生长增殖不受调控,就会不受约束的扩增,我们称之为“脱缰之马”. 无限增殖之后,将会形成肿瘤,肿瘤一旦恶化转移,变为恶性肿瘤,我们称之为“癌”. 肝癌是世界上最常见的恶性肿瘤之一,也是我国死亡率位居第二的恶性肿瘤.
目前,国内外许多学者都在孜孜不倦地研究抗癌治疗手段,到现在为止,普遍的治疗手段有手术切除、放射性治疗、化学治疗以及免疫治疗等. 免疫治疗是一个概念性的突破,开创了一个新的时代,着力于促进机体免疫功能正常化. 只要机体的免疫功能趋于正常化,能够被调动,机体最终就能够依靠自身的免疫功能清除肿瘤,杀死肿瘤,达到一个抗癌的效果.
肝癌是病死率最高的几大恶性肿瘤之一[1]. 中国每年大约有38万多人死于肝癌以及其连带疾病,这给我们国家的人民和社会带来了残酷的挑战和沉重的负担. 而慢性肝脏炎症的持續发展和恶性转化便可导致肝细胞癌的发生. 肝炎可导致肝硬化、肝纤维化、肝癌等对国人的健康和社会经济发展均带来了强烈的冲击和严峻的挑战[2].
HBV慢性感染是我国HCC重要的成因. 我国临床上90%以上的肝癌患者都携带HBV病毒. HBV一旦形成慢性感染,便很难从机体内彻底清除[3-5]. 因为HBV的核酸会在体内修复形成共价闭合环状DNA,整合到宿主的细胞核内,定位于基因组中,跟随宿主的遗传物质一起复制,结构类似于质粒[6-7].
另外,除了HBV慢性感染以外,还有一类导致肝癌发生的疾病,那就是代谢性的肝病,代谢性肝病是一大类,包括肝-豆状核变性、遗传性血色病、抗胰蛋白酶缺乏、非酒精性脂肪肝、遗传性酪氨酸血症、糖原累积病和脂类累积病等[8-11].
然而调控肝癌细胞恶性程度,凋亡趋势的分子主要有两大类,一类是抑制肝癌细胞凋亡的基因,一般来说会促进肿瘤细胞的生长增殖;而另一类则是促进肝癌细胞凋亡的诱导基因,比如p53,细胞色素C等.细胞凋亡的一类核心成分是半胱氨酸蛋白酶Caspase家族,细胞凋亡就是由蛋白酶的级联放大切割过程所引发[12-15].
据文献记载,一般比较公认的观点是细胞凋亡途径主要分为外源性途径和内源性途径.细胞外源性途径当中,死亡受体和死亡配体相互结合,然后死亡受体被激活,它的死亡结构域再跟细胞内的一些信号转导分子结合,传递死亡信号. 接下来转导分子如FADD再与Caspase-8酶原的DED连接,这时能够形成诱导死亡的一种复合物,这时Caspase-8被激活,活化的Caspase-8裂解BID,上调Bax和Bak,促进在线粒体上形成孔道,使线粒体膜的通透性增加,进而释放凋亡蛋白细胞色素C,或者作用于下游的其他Caspase,活化的这些Caspase可以切割胞核内底物DNA修复酶PARP,导致cleaved PARP失去对DNA脱氧核糖核酸的修复功能,从而导致细胞走向凋亡[16]. 另外,细胞内源性途径中,一些内源性的死亡信号,包括DNA损伤、有毒化学物质、Bax、原癌基因抑制剂、物理射线、能量通货ATP耗竭等,这些细胞损伤死亡信号诱导线粒体释放大量细胞色素C进入细胞质,之后激活APAF-1[17-20].接下来Cyt-C,APAF-1以及procaspase-9会形成一个所谓的凋亡小体.随后经过Caspase家族的一个级联放大反应,最终导致了细胞凋亡[17,21-23].
在本课题研究中,我们用NDV感染肝癌细胞Huh7,发现去泛素化酶USP18的表达显著升高. 过表达USP18能够促进NDV诱导的肝癌细胞凋亡. 反之,敲低USP18的表达可以抑制肝癌细胞的凋亡.所以接下来进一步探究其诱导凋亡的机制.我们发现,USP18的表达上调了Bax和NOXA,增加了线粒体膜的通透性,促进细胞色素C的释放以及促进NOXA切割凋亡蛋白Caspase-7,进而促进细胞凋亡.此外,USP18还能上调ISG12a的蛋白水平,而ISG12a经过实验研究发现,是能够促进细胞凋亡的,这也就从另一个角度解释了USP18能够促进肝癌细胞凋亡的机制.
1 材料与方法
1.1 细胞系
Huh7 细胞是实验室从American Type Culture Collection购买.
1.2 试 剂
IFN-α(Roche),DMEM培养基和DMEM/F-12 培养基(Gibco),1×PBS(Hyclone),胰蛋白酶(Gibco),Trizol 试剂(Invitrogen,Carlsbad,CA),逆转录试剂盒(Takara),SYBR Green master 定量PCR试剂盒 (Roche),RIPA 裂解液(Thermo),蛋白酶抑制剂(Merck),USP18,PARP,Bax,细胞色素C,NOXA,Caspase-7,ISG12a等抗体(Cell Signaling Technology),β-actin抗体(Sigma).
载玻片和盖玻片(SPI Supplies),PVD膜(Bio-Rad),10 cm 细胞培养盘(Corning),60 mm 细胞培养板(Corning),6孔细胞培养板(Corning),1.5 mL离心管(Corning),200 μL RT-PCR八联管(Axygen).
1.3 仪器设备
-80 ℃超低温冰箱(Thermo),-20 ℃冰箱(Haier),4 ℃冰箱(中科美菱),CO2恒温细胞培养箱(Thermo),流式细胞仪(Beckman),超净生物安全柜(AIRTECH),细胞计数仪(Beckman),液氮罐(Thermo),光学显微镜(OLYMPUS),紫外分光光度计(Bio-Rad),分析天平(上海天平仪器厂),超纯水仪(Millipore),实时荧光定量PCR仪(Eppendorf),PCR仪(Eppendorf),低温高速离心机(Eppendorf),凝胶成像系统(上海天能公司),化学发光成像系统(Bio-Rad).
1.4 质粒构建
从Huh7细胞中提取总RNA,测得其RNA浓度后,将其逆转录为cDNA,然后以之为模板,PCR扩增USP18,琼脂糖凝胶电泳,回收纯化PCR产物.PCR产物与载体p3×FLAG-CMV-vector 分别双酶切,再次琼脂糖凝胶电泳,回收纯化,之后T4连接酶16 ℃连接过夜,第二天用感受态大肠杆菌转化.挑单克隆菌落扩大培养,提取质粒. 质粒经过酶切鉴定,片段正确. 随后质粒经过生工公司测序,返回序列. 经过DNAMAN比对,目的基因的序列与USP18吻合. 经过表达鉴定,质粒在Huh7细胞中表达.
构建USP18沉默质粒,首先在USP18开放阅读框(ORF)中选取以AA开头长度为21 nt的靶序列.然后依据靶序列设计长度为 63~64 nt 的 Top 链和 Bottom 链,这两条引物链退火结合后连入 pRNAT-U6载体,得到 pRNAT-U6-USP18沉默质粒,测序鉴定插入序列正确.过表达质粒引物和沉默質粒靶序列分别如表1和表2所示.
1.5 蛋白免疫印记
利用含有蛋白酶抑制剂的RIPA Buffer裂解液裂解细胞并收集细胞总蛋白.根据试剂盒说明书方法用 BCA 碱性硫酸铜法测定蛋白质浓度. 蛋白样品用2×Laemmli Sample Buffer进行稀释,100 ℃加热 5 min. SDS-PAGE凝胶电泳,采用PVDF膜转膜,蛋白转膜至PVDF膜上之后,以牛奶封闭1 h,再加入适当的一抗室温孵育3 h或4 ℃过夜.二抗选用goat-anti-mouse或goat-anti-rabbit抗体室温孵育3 h. 随后将膜置于化学放光信号检测仪(曝光机)上加入预先配制好的显影液(Thermo)曝光适当的时间,得到显影图像.
1.6 实时荧光光定量PCR
用TRIzol reagent(Invitrogen,Carlsbad CA)提取细胞中的总RNA.随后用逆转录试剂盒(Takara)将RNA逆转录为cDNA.接着用SYBR Green master(Roche)进行实时荧光光定量PCR.检测USP18,ISG12a等基因的mRNA水平.
1.7 统计学分析
实验数据导入Excel进行处理分析,对照和处理组之间的显著性差异分析我们采用双样本等方差假设双尾的 Student t-test .*P <0.05,**P <0.01,***P <0.001指示显著性差异程度,其中P小于0.05被认为存在统计学意义.
1.8 线粒体内细胞色素C的提取
6孔板收样. 200 μL胰蛋白酶消化3 min ,之后加入1 mL 的PBS吹散.把样品转移至离心管内,离心,950 rcf(相对离心力),3 min. 加入150 μL的MIB(事先配置好),重悬.静置于冰上,15 min. 用1 mL的注射器吹打30~50次,1 000 g,4 ℃离心10 min. 吸取上清于新的离心管中,进行二次离心. 最大转速离心,10 min,4 ℃.再次吸取上清于新的离心管中,这就是胞浆中的蛋白. 沉淀为线粒体,这时可以加入RIPA buffer裂解,静置几分钟,提取线粒体中的细胞色素C.
2 结 果
2.1 NDV感染肝癌细胞诱导USP18的表达
Huh7细胞系是一种恶性肝脏肿瘤细胞,是由Kaneko等人[24]建立起来的,该细胞系源自一个日本男性高分化肝细胞肝癌.
NDV除了可以直接杀伤肿瘤细胞之外,还可通过改变肿瘤细胞的免疫原性,诱导机体的免疫系统产生多种细胞因子,来杀伤肿瘤细胞. 因此,它是一种有着很大发展前景的抗癌生物制剂. 我们发现,用NDV感染Huh7细胞后,在36 h的时候,USP18的mRNA水平有一个显著地上调(图1). 然后同样提取细胞总蛋白,经过蛋白免疫印迹方法检测,我们发现在NDV感染36 h的时候,USP18的蛋白水平也有一个显著地提高(图2).这些结果显示,USP18在NDV感染肝癌细胞的过程中很可能有着某种作用,在感染36 h的时候,细胞进入一个凋亡阶段,而恰恰在这个时候,USP18的表达水平显著提高,这也就意味着USP18在细胞凋亡的过程中可能起着某种暂时未知的作用.接下来我们将继续探讨USP18究竟在细胞凋亡过程中起着什么样的作用.
2.2 USP18促进NDV诱导的肝癌细胞凋亡以及其
机制研究
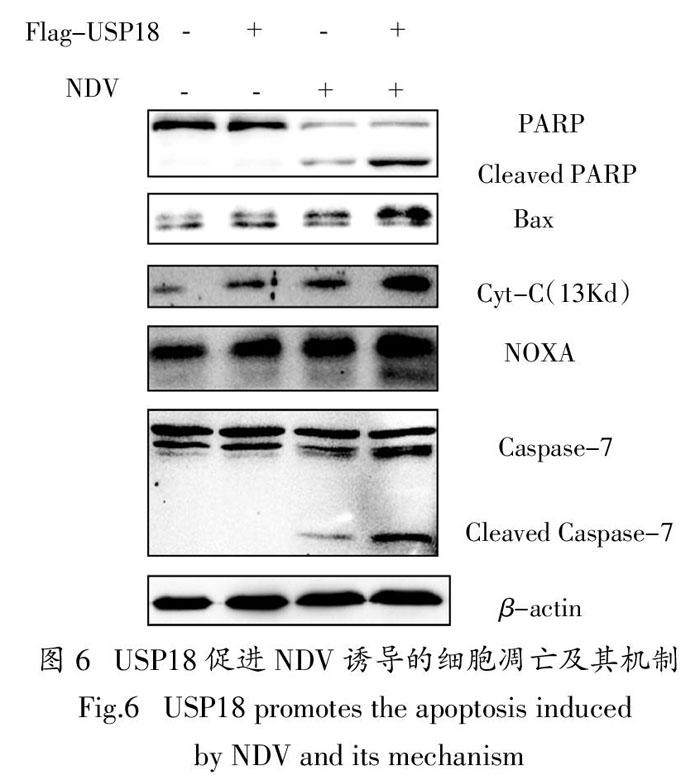
由前面研究可知,在NDV感染肝癌细胞Huh7之后,36 h的时候检测到USP18在信使RNA水平和蛋白水平都有一个显著地上调.所以,接下来我们就要一起来探讨一下USP18在肝癌细胞凋亡过程中的功能.先构建了USP18的过表达质粒以及沉默质粒,并在Huh7细胞系当中,转染构建好的过表达质粒以及沉默质粒,过表达质粒和沉默质粒均达到预期效果(图3和图4). 然后,我们用该质粒进行后续实验. 同样,在Huh7细胞中,过表达USP18可以促进NDV所诱导的肝癌细胞凋亡(图5,图6).
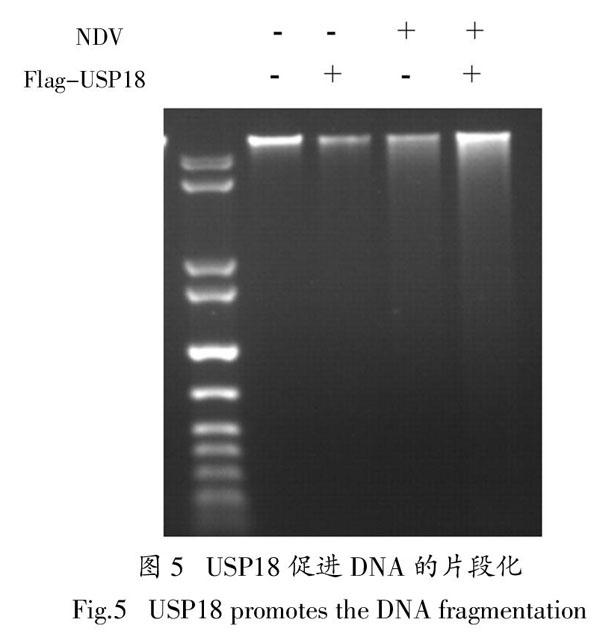
细胞内的DNA包括细胞核内染色质上的DNA以及胞浆内线粒体中的DNA,在细胞进入凋亡程序之后,染色质会发生浓缩,形成染色体,染色质DNA在核小体单位之间的连接处断裂,形成50~300 kb的DNA大片段,或是180~200 bp的寡核苷酸片段,在琼脂糖凝胶电泳上表现为梯形的电泳图(称之为DNA ladder). 细胞经过处理后,采用SV buffer试剂盒分离提纯细胞的总DNA,进行琼脂糖凝胶电泳,并用核酸染料溴化乙啶(EB)染色,在凋亡的细胞亚群中可观察到典型的DNA ladder.
因此,我们在Huh7细胞中,过表达USP18之后用NDV感染細胞36 h,然后提取细胞中的总DNA,进行琼脂糖凝胶电泳. 电泳结果显示,USP18促进细胞凋亡,增强了DNA ladder,增强了DNA的片段化(图5),在Huh7细胞中过表达p3×flag-USP18-CMV,随后感染NDV,在感染36 h的时候,提取细胞的总蛋白,对其进行蛋白免疫印迹分析,检测到胞核内底物DNA修复酶PARP被切割的程度明显增强,这意味着USP18显著地促进了细胞的凋亡.
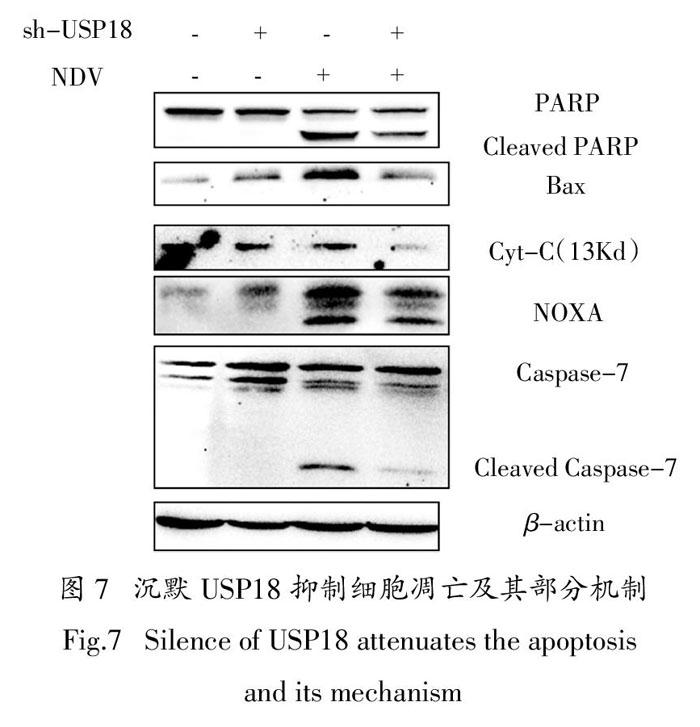
而与之相反,在Huh7细胞系中沉默USP18,在一定程度上反过来抑制了细胞的凋亡,跟之前的结果在逻辑上是一致的(图7).
细胞内的DNA,这包括细胞核内的染色质上的DNA以及胞浆内的线粒体中的DNA,在细胞进入凋亡程序之后,染色质会发生浓缩,形成染色体,染色质DNA在核小体单位之间的连接处断裂,形成50~300 kb的DNA大片段,或是180~200 bp的寡核苷酸片段,在琼脂糖凝胶电泳上表现为梯形的电泳图(称之为DNA ladder). 细胞经过处理后,采用SV buffer试剂盒分离提纯细胞的总DNA,进行琼脂糖凝胶电泳,并用核酸染料溴化乙啶(EB)染色,在凋亡的细胞亚群中可观察到典型的DNA ladder.
因此,在Huh7细胞中过表达USP18之后用NDV感染细胞36 h,然后提取细胞中的总DNA,进行琼脂糖凝胶电泳. 电泳结果显示,USP18促进细胞凋亡,增强了DNA ladder,增强了DNA的片段化(图5).
经过之前的研究,已经得出结论,USP18能够促进NDV诱导的肝癌细胞凋亡. 那么,它是通过什么样的方式促进这一过程的呢?我们知道凋亡蛋白Caspase-8被激活之后裂解Bid,从而使得线粒体膜的孔道增加,通透性增加,释放细胞色素C,诱导细胞凋亡.随后我们发现,过表达USP18能够上调Bax的蛋白水平,同时也增强了细胞色素C的释放. 此外,过表达USP18还能够增强凋亡蛋白NOXA的表达,导致进一步地切割效应性的半胱氨酸天冬氨酸蛋白酶Caspase-7,增强细胞凋亡(图6).
与之相反,在Huh7细胞中沉默USP18,得到与之前相反的结果.沉默USP18后,下调了Bax的蛋白水平,也就减弱了线粒体外膜的通透性,抑制了细胞色素C的释放.与此同时,沉默USP18能够抑制凋亡蛋白NOXA的表达,也减弱了其对于Caspase-7的切割,抑制了下游凋亡信号的激活,抑制了细胞凋亡(图7).
实验数据表明,USP18是通过影响了Bax以及NOXA,从而引起线粒体膜的通透性增加,释放细胞色素C,并且通过NOXA切割Caspase-7,诱导下游的一系列级联放大反应,最终促进肝癌细胞的凋亡.
2.3 USP18上调ISG12a的蛋白水平
ISG12a属于一种干扰素刺激基因,具有激活机体免疫的功能. 本实验室前期研究表明,ISG12a具有抗病毒功能,它能够泛素化降解HCV的非结构蛋白NS5A,发挥它的抗病毒作用[25-31]. ISG12a同时还具有另外的功能,那就是可以杀伤肿瘤细胞.USP18在ISG12a的质谱图中存在,所以猜测USP18是不是与ISG12a存在某种联系. 研究发现,在肝癌细胞系Huh7中,过表达USP18能够上调ISG12a的蛋白水平(图8),反之,沉默USP18,则相应地下调ISG12a的蛋白水平(图9).
因此,USP18能够上调ISG12a的蛋白水平,从而促进细胞的凋亡. 那么,USP18作为一个去泛素化酶,它极有可能是通过去泛素化ISG12a,而抑制了ISG12a的泛素化-蛋白酶体途径降解,最终达到其促进细胞凋亡的目的.我们做了相关的实验,发现USP18能够去泛素化ISG12a,这与我们的预期猜测是相吻合的(图10).
3 讨 论
在NDV诱导的肝癌细胞凋亡中,有很多分子参与到了这个过程,这是一个十分复杂的调控过程.研究发现,ISG12a可以促进肝癌细胞的凋亡,而沉默了ISG12a之后的细胞却生长得异常迅速. 于是,我们用ISG12a打质谱分析,从中找到了一种去泛素化酶USP18.经过检测,在NDV感染肝癌细胞之后,USP18的表达量上调显著,于是推测USP18在细胞凋亡过程中可能会起到某种作用.研究发现,USP18可以促进NDV诱导的细胞凋亡.换句话说,当NDV感染细胞后,可诱导产生促凋亡蛋白USP18,后者发挥着它的促凋亡功能. 进一步研究表明了USP18促进细胞凋亡的部分机制.一方面,它可以上调Bax,增加凋亡蛋白细胞色素C的释放;另一方面,它还能够上调NOXA,从而促进切割Caspase-7,共同促进细胞凋亡.另外,我们研究发现,USP18还能够上调ISG12a的蛋白水平,抑制它的泛素化降解.这又从另一个方面解释了USP18的促凋亡功能,它是通过上调了ISG12a,来进一步发挥它的抗癌功能[32-34]. 那么,USP18是如何上调ISG12a的蛋白水平的,又是如何上调Bax和NOXA的,这还有待接下来更加深入地研究,相信这将会是一个十分有意义的过程.我们的发现对于肝癌的防治有着积极的影响,并为临床上的治疗提供了新的理论依据和潜在的作用
靶点.
参考文献
[1] KIM J,SINN D H,CHOI M S,et al. Hepatocellular carcinoma with extrahepatic metastasis: are there still candidates for transarterial chemoembolization as an initial treatment [J]. PLOS One,2019,14(3):e0213547.
[2] TAKAKI A,KAWANO S,UCHIDA D,et al. Paradoxical roles of oxidative stress response in the digestive system before and after Carcinogenesis [J]. Cancers,2019,11(2):213—219.
[3] MU D,YUAN F C,CHEN Y,et al. Baseline value of intrahepatic HBV DNA over cccDNA predicts patient′s response to interferon therapy [J]. Scientific Reports,2017,7(1):5937—5943.
[4] ALLWEISS L,DANDRI M. The role of cccDNA in HBV maintenance [J]. Viruses,2017,156(9):1—12.
[5] CHONG C K,CHENG C Y S,TSOI S Y J,et al. Role of hepatitis B core protein in HBV transcription and recruitment of histone acetyltransferases to cccDNA minichromosome [J]. Antiviral Research,2017,144:1—7.
[6] VANWOLLEGHEM T,BOONSTRA A. Focus on the liver:host-virus interactions in HBV [J]. Journal of Hepatology,2017,66(5):884—885.
[7] KINOSHITA W,OGURA N,WATASHI K,et al. Host factor PRPF31 is involved in cccDNA production in HBV-replicating cells [J]. Biochemical and Biophysical Research Communications,2017,482(4):638—644.
[8] ASSUNCAO S N F,SORTE N C B,ALVES C D,et al. Nonalcoholic fatty liver disease (NAFLD) pathophysiology in obese children and adolescents:update [J]. Nutricion Hospitalaria,2017,34(3):727—730.
[9] BALLESTRI S,NASCIMBENI F,BALDELLI E,et al. NAFLD as a sexual dimorphic disease:role of gender and reproductive status in the development and progression of nonalcoholic fatty liver disease and inherent cardiovascular risk [J]. Advances in Therapy,2017,34(6):1291—1326.
[10] AN X,YANG Z,AN Z. MiR-149 compromises the reactions of liver cells to fatty acid via its polymorphism and increases non-alcoholic fatty liver disease (NAFLD) risk by targeting methylene tetrahydrofolate reductase (MTHFR) [J]. Medical Science Monitor :International Medical Journal of Experimental and Clinical Research,2017,23:2299—2307.
[11] WANG X L,LIU Z P,WANG K,et al. Additive effects of the risk alleles of PNPLA3 and TM6SF2 on non-alcoholic fatty liver disease (NAFLD) in a chinese population [J]. Frontiers in Genetics,2016(2):1—7.
[12] DOLKA I,KROL M,SAPIERZYNSKI R. Evaluation of apoptosis-associated protein (Bcl-2,Bax,cleaved caspase-3 and p53) expression in canine mammary tumors:an immunohistochemical and prognostic study [J]. Research in Veterinary Science,2016,105:124—133.
[13] MITUPATUM T,AREE K,KITTISENACHAI S,et al. mRNA expression of Bax,Bcl-2,p53,Cathepsin B,Caspase-3 and Caspase-9 in the HepG2 cell line following induction by a novel monoclonal Ab Hep88 mAb:cross-talk for paraptosis and apoptosis [J]. Asian Pacific Journal of Cancer Prevention :APJCP,2016,17(2):703—712.
[14] HAMACHER-BRADY A,BRADY N R. Bax/Bak-dependent,Drp1-independent targeting of X-linked inhibitor of apoptosis protein (XIAP) into Inner mitochondrial compartments counteracts Smac/DIABLO-dependent effector caspase activation [J]. The Journal of Biological Chemistry,2015,290(36):22005—22018.
[15] ELMAADIDI S,FALETTI L,BERG B,et al. A novel mitochondrial MAVS/Caspase-8 platform links RNA virus-induced innate antiviral signaling to Bax/Bak-independent apoptosis [J]. Journal Immunol,2014,192(3):1171—1183.
[16] GERECOVA G,KOPANICOVA J,JAKA P,et al. BH3-only proteins Noxa,Bik,Bmf,and Bid activate Bax and Bak indirectly when studied in yeast model [J]. FEMS Yeast Research,2013,13(8):747—754.
[17] KARABAY A Z,AKTAN F,SUNGUROGLU A,et al. Methylsulfonylmethane modulates apoptosis of LPS/IFN-gamma-activated RAW 264.7 macrophage-like cells by targeting p53,Bax,Bcl-2,cytochrome c and PARP proteins [J]. Immunopharmacology and Immunotoxicology,2014,36(6):379—389.
[18] RENAULT T T,FLOROS K V,CHIPUK J E. BAK/BAX activation and cytochrome c release assays using isolated mitochondria [J]. Methods,2013,61(2):146—155.
[19] GOMEZ-CRISOSTOMO N P,LOPEZ-MARURE R,ZAPATA E,et al. Bax induces cytochrome C release by multiple mechanisms in mitochondria from MCF7 cells [J]. Journal of Bioenergetics and Biomembranes,2013,45(5):441—448.
[20] MONDAL S,BHATTACHARYA K,MALLICK A,et al. Bak compensated for Bax in p53-null cells to release cytochrome c for the initiation of mitochondrial signaling during Withanolide D-induced apoptosis [J]. PLOS One,2012,7(3):e34277.
[21] KIRKLAND R A,FRANKLIN J L. Bax and caspases regulate increased production of mitochondria-derived reactive species in neuronal apoptosis:LACK of a role for depletion of cytochrome c from the mitochondrial electron transport chain[J]. Biochemistry and Biophysics Reports,2015,4:158—168.
[22] BHATTACHARJEE M,ACHARYA S,GHOSH A,et al. Bax and Bid act in synergy to bring about T11TS-mediated glioma apoptosis via the release of mitochondrial cytochrome c and subsequent caspase activation [J]. International Immunology,2008,20(12):1489 —1505.
[23] LARTIGUE L,MEDINA C,SCHEMBRI L,et al. An intracellular wave of cytochrome c propagates and precedes Bax redistribution during apoptosis[J]. Journal of Cell Science ,2008,121(S21):3515—3523.
[24] KANEKO S,HALLENBECK P,KOTANI T,et al. Adenovirus-mediated gene therapy of hepatocellular carcinoma using cancer-specific gene expression [J]. Cancer Research,1995,55(22):5283—5287.
[25] CHEN Y,JIAO B,YAO M,et al. ISG12a inhibits HCV replication and potentiates the anti-HCV activity of IFN-alpha through activation of the Jak/STAT signaling pathway independent of autophagy and apoptosis [J]. Virus Research,2017,227:231—239.
[26] XUE B,YANG D,WANG J,et al. ISG12a restricts hepatitis C Virus infection through the ubiquitination-dependent degradation pathway [J]. Journal of Virology,2016,90(15):6832—6845.
[27] LIU N L,LONG Y,LIU B,et al. ISG12a mediates cell response to newcastle disease viral infection[J]. Virology,2014,462/463:283—294.
[28] LIU N L,ZUO C H,WANG X H,et al. MIR-942 decreases TRAIL-induced apoptosis through ISG12a downregulation and is regulated by AKT [J]. Oncotarget,2014,5(13):4959—4971.
[29] YANG D R,MENG X H,XUE B B,et al. MiR-942 mediates hepatitis C virus-induced apoptosis via regulation of ISG12a [J]. PLOS One,2014,9(4):e94501.
[30] ROSEBECK S,LEAMAN D W. Mitochondrial localization and pro-apoptotic effects of the interferon-inducible protein ISG12a [J]. Apoptosis,2008,13(4):562—572.
[31] KRONBORG C S,KNUDSEN U B,MARTENSEN P M. Differential regulation of the interferon induced gene ISG12A by serum from healthy and preeclamptic pregnancies [J]. Cytokine,2008,42(1):105—112.
[32] MUSTACHIO L M,LU Y,TAFE L J,et al. Deubiquitinase USP18 Loss mislocalizes and destabilizes KRAS in lung cancer [J]. Molecular Cancer Research,2017,15(7):905—914.
[33] ZHANG M,ZHANG M X,ZHANG Q,et al. USP18 recruits USP20 to promote innate antiviral response through deubiquitinating STING/MITA [J]. Cell Research,2016,26(12):1302—1319.
[34] MEUWISSEN M E,SCHOT R,BUTA S,et al. Human USP18 deficiency underlies type 1 interferonopathy leading to severe pseudo-TORCH syndrome[J]. The Journal of Experimental Medicine,2016,213(7):1163—1174.
