Bmi-1调控非小细胞肺癌细胞对顺铂的敏感性研究
2019-07-26陈明军周月鹏
陈明军,陈 奇,周月鹏
0 引 言
原癌基因Bmi-1属于多梳家族抑制复合体(Polycomb repressor complex 1,PRC1)中重要一员,可以通过调控染色体结构改变来沉默众多基因的表达,因此其在多种肿瘤的高表达常与不良预后密切相关[1-2]。同时,已有研究发现在卵巢癌、鼻咽癌、胶质瘤等多种肿瘤中,下调Bmi-1表达可以增强肿瘤细胞对化疗药物的敏感性[3-6]。为了探讨Bmi-1参与非小细胞肺癌化疗敏感性的分子机制,本研究通过顺铂处理后结合靶向干扰Bmi-1表达,观察对非小细胞肺癌细胞中多药耐药相关蛋白1(multidrug resistance protein 1,MDR1)及凋亡蛋白表达的影响。
1 材料与方法
1.1 主要试剂脂质体Lipofectamine 2000购自美国 Invitrogen 公司;Bmi-1(#5856)、MDR1(#13342)、Cleaved-Caspase-3(#9661)以及β-Actin(#3700)单克隆抗体购自美国Cell Signaling Technology公司;顺铂(Cisplatin,DPP)购自Selleck公司(上海);HRP标记的抗鼠或抗兔二抗为Proteintech公司产品(武汉);CCK8以及Annexin-V/PI凋亡试剂盒均购自杭州联科生物技术有限公司;引物,siRNA-Bmi-1和siRNA阴性对照购于上海吉玛制药技术有限公司。
1.2 细胞培养A549及顺铂耐药株A549/DDP细胞(均购自于北京北纳创联生物科技有限公司)用含10%胎牛血清的RPMI-1640培养基在37°C、5%CO2的细胞培养箱中培养。取对数生长期细胞,以3×104~4×104个/mL密度接种于6孔板中,随机分为3组:Bmi-1干扰组(siRNA-Bmi-1转染)、阴性对照组(siRNA阴性对照)及空白对照组(不做任何处理)。依照Lipofectamine 2000试剂说明转染上述不同组细胞,无血清培养基内转染6 h后更换为普通培养基继续培养24或48 h,再行收集细胞进行后续的实验。序列如下,siRNA-Bmi-1:5'-GGAUCGGAAAGUAAACAAATT-3'; NC: 5'-UUCUCCGAACGUGUCACGUTT-3'。
1.3 RT-PCR法细胞经不同处理后采用TRIzol试剂盒(美国Invitrogen公司)提取RNA并检测浓度,逆转录成cDNA后进行RT-PCR检测(试剂盒均购于南京诺唯赞生物科技有限公司);扩增条件为:95 °C,5 min;95 °C,10 s,60 °C,30 s,40个循环;95°C,15 s 60 °C,60 s 95 °C,15 s。引物序列如下,Bmi-1:上 游 5'-GCCTTCTCTGCTATGTCTGAA-3';下 游5'-CTGATGAACACACACCAACTT-3';β-Actin:上游5'-CCACTGGCATCGTGATGGACTCC-3';下 游 5'-GCCGTGGTGGTGAAGCTGTAGC-3'。以 β-Actin为内参计算Bmi-1的mRNA相对表达量。
1.4 蛋白印迹法检测收集6孔板中不同处理细胞,PBS洗涤2次,加入100~200 μL含蛋白酶抑制剂的RIPA细胞裂解液,收集后经12 000×g离心10 min去沉淀,BCA法测定蛋白含量后加入上样缓冲液,95~100℃下变性10 min。10%~15%的聚丙烯酰胺SDS凝胶电泳后,将蛋白电转移至PVDF膜上,用含5%BSA的TBST于37℃水浴摇床上封闭60 min,加入稀释好的一抗Bmi-1、MDR1、Cleaved-Caspase-3(均按1∶1000配置),4℃冰箱孵育过夜。TBST洗3次,每次10 min;抗鼠或抗兔二抗室温孵育60 min后,同样TBST洗3次,每次10 min,最后加入曝光液显影、拍摄、计算灰度值。
1.5 CCK8检测根据A549细胞处理方式分为4组:对照组(未处理A549细胞)、Bmi-1组(siRNABmi-1处理A549细胞)、DDP组(顺铂处理A549细胞)、Bmi-1+DDP组(siRNA-Bmi-1干扰结合顺铂处理A549细胞)。以每孔5×103个细胞种于96孔板中,待细胞贴壁后分别进行siRNA处理24 h或者只换液,每组处理设6个平行孔。顺铂按浓度梯度(1、2、4、8、16、32、64、128、256 μg/mL)加入处理 24 h,实验终止前每个孔加10 μL的CCK8,震荡、孵育2 h后在酶联检测仪上检测450 nm波长下每孔的A值,求出生长抑制率以及IC50。
1.6 流式细胞检测A549、A549/DDP细胞以4×105个/孔密度种于6孔板中,待过夜贴壁后siRNABmi-1或DDP单独处理或者siRNA-Bmi-1处理48 h后联合DDP处理,随后细胞经不含EDTA胰酶消化离心后用预冷的PBS洗2次,每管用500 μL标记缓冲液重悬,避光先加入5 μL的Annexin V-FITC以及上机前15 min加入5 μL PI。
1.7 统计学分析采用SPSS13.0统计软件进行统计学分析。计量资料采用均数±标准差(xˉ±s)表示,2组间均值比较采用t检验,多组间均值比较采用单因素方差分析。以P≤0.05为差异有统计学意义。
2 结 果
2.1 miRNA及蛋白表达量的比较RT-PCR法检测显示,Bmi-1干扰组miRNA表达水平较空白对照组降低(P<0.01)。蛋白印迹检测显示,Bmi-1干扰组可以有效降低肺癌细胞中Bmi-1蛋白的表达;同时,顺铂耐药株A549/DDP细胞中Bmi-1的水平明显高于A549细胞。见图1。
2.2 Bmi-1干扰对顺铂的IC50值影响A549细胞和A549/DDP细胞中随着顺铂浓度的升高,细胞相对存活率逐渐降低(P<0.05)。Bmi-1+DDP组细胞存活率较DDP组低(P<0.05)。说明siRNA-Bmi-1能有效增加肺癌细胞株对顺铂的敏感性,并呈浓度依赖性。其中,A549细胞中DDP组、Bmi-1+DDP组IC50分别为0.49、0.29 μg/L;A549/DDP细胞中DDP组、Bmi-1+DDP组IC50分别为 10.65、1.26 μg/L。组间比较差异均有统计学意义(P<0.05)。见图2。
2.3 Bmi-1表达对顺铂杀伤能力的影响A549细胞和A549/DDP细胞中,Bmi-1+DDP组细胞凋亡率较其他组明显升高(P<0.05),DDP组细胞凋亡率较Bmi-1组、对照组明显升高(P<0.05),Bmi-1组细胞凋亡率较对照组升高(P<0.05)。见表1。

图1 siRNA-Bmi-1转染对非小细胞肺癌中Bmi-1表达的影响Figure 1 Expression of Bmi-1 in different groups of the A549 and A549/DDP cells of non-small lung cancer

图2 CCK8检测Bmi-1干扰对顺铂IC50值的影响Figure 2 The 50%inhibitory concentration(IC50)of cisplatin in the A549 and A549/DDP cells after Bmi-1 interference
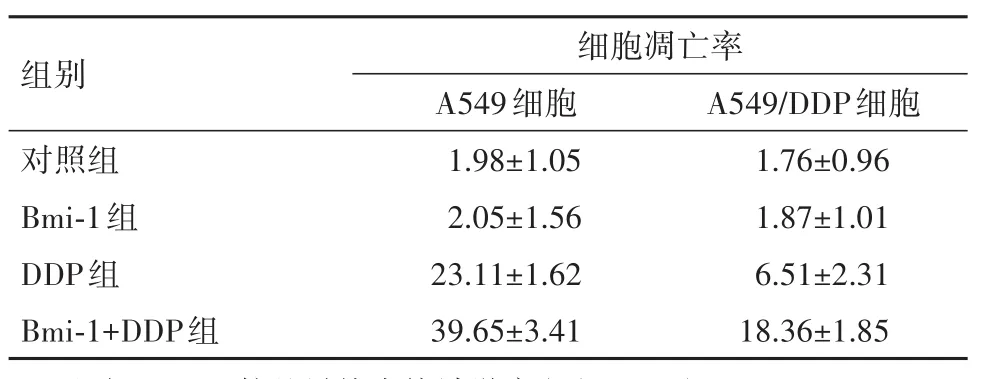
表1 流式细胞检测早期细胞凋亡率的比较(xˉ±s,%)Table 1 Apoptosis of the A549 and A549/DDP cells of nonsmall lung cancer in different groups(xˉ±s,%)
2.4 Bmi-1参与顺铂敏感调控相关机制DDP处理24 h后,可见Bmi-1、MDR1的高表达;靶向下调Bmi-1后可见A549和A549/DDP细胞中MDR1显著降低,凋亡相关Cleaved-Caspase-3蛋白表达量明显升高。见图3。
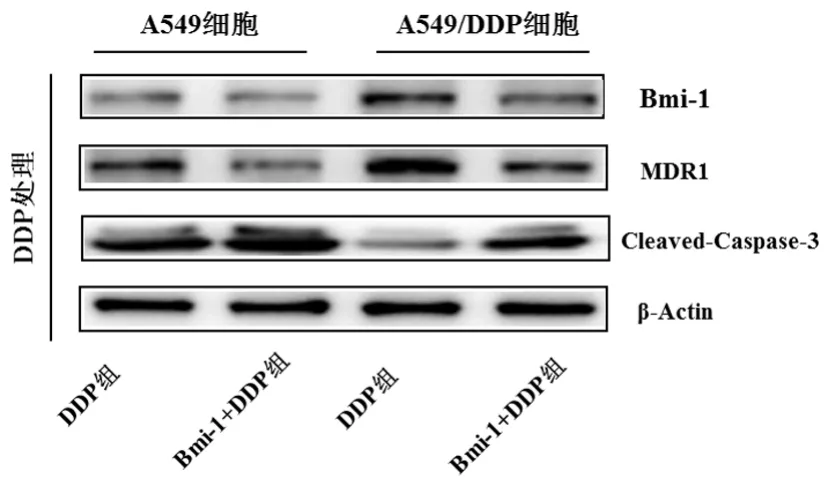
图3 DDP处理后siRNA-Bmi-1对MDR1及Cleaved-Caspase-3的影响Figure 3 Expressions of Bmi-1,MDR1 and cleaved caspase-3 in the A549 and A549/DDP cells after treated with DDP
3 讨 论
目前在非小细胞肺癌的综合治疗方案中化疗的地位依然不容质疑,但是治疗药物对正常细胞存在的毒性和肿瘤细胞产生的耐药性却一直困扰着实际疗效的提升,也是众多肿瘤类型化疗失败的主要原因[7-9]。因此,探讨如何增加肿瘤细胞对化疗药物的敏感性是现在科学研究的重要方向之一。
Bmi-1是PRC1成员之一,其异常表达主要通过下调多种抑癌基因的表达来促使正常机体组织发生恶性转变[2]。研究证实,顺铂可以通过Bmi-1参与到肿瘤干细胞的自我更新,Bmi-1上调可以通过诸如INK4/ARF基因座诱发细胞增殖、慢性粒细胞白血病发生,以及抑制PTEN、E-cadherin和p16INK4a表达来促进上皮间充质转化发生等影响着肿瘤的恶性进展[10-12]。文献报道,在卵巢癌、鼻咽癌、胶质瘤、头颈部肿瘤、结直肠癌、乳腺癌以及非小细胞肺癌中均可以观察到Bmi-1的表达上调并与不良预后密切相关,然而在肺癌中不同研究组对Bmi-1表达强度与预后判断之间联系尚存较大争议[1-2,5-6,10,12-14]。为了探讨靶向干扰 Bmi-1 在肺癌化疗增敏的作用,本研究以A549及顺铂耐药株A549/DDP作为主要的研究对象进行了对比分析。本研究结果显示,Bmi-1在A549/DDP细胞中mRNA及蛋白水平均较高于A549细胞,提示Bmi-1对耐药形成有着重要影响,将Bmi-1干扰联合化疗药物有望提高化疗敏感性;顺铂处理后,在A549细胞和A549/DDP细胞中均可见Bmi-1的表达上调,说明Bmi-1的确参与到化疗药物敏感改变;CCK8结果显示,与对照组细胞株相比,Bmi-1的有效干扰能增加非小细胞肺癌细胞对化疗药物顺铂的敏感性,下调IC50值并且呈浓度依赖性。上述结果为联合干扰Bmi-1表达和化疗药物治疗肿瘤提供了新的方向和策略。
目前认为肿瘤细胞耐药形成机制包括:DNA修复能力增强,药物靶点改变,以及解毒或者药泵蛋白表达上调等,其中MDR1又名ATP结合盒亚科B运载体蛋白1是极为重要一员[15-16]。已有研究表明,肿瘤细胞可以通过上调MDR1的表达来直接泵出胞内的化疗药物,例如结构、靶标、作用途径等存在截然不同的紫杉醇、阿霉素、顺铂等,来形成多药耐药效应[17]。对于肿瘤患者而言,化疗进程中MDR1的增高与化疗失败或者不良预后密切联系。最新研究证实,肿瘤细胞在经顺铂处理后是通过Bmi-1蛋白直接结合到MDR1的启动子中促进其表达以及组蛋白H2A和H3的乙酰化,最终形成多药耐药[3]。本研究中我们通过流式细胞术检测了凋亡细胞数,进一步验证了siRNA-Bmi-1处理会促进A549和A549/DDP细胞株的药物敏感性。化疗药物的有效杀伤必然带来凋亡发生,而细胞凋亡过程涉及到一系列的凋亡相关蛋白改变,特别是含半胱氨酸的Caspase蛋白家族,其中Cleaved-Caspase-3是凋亡活化标记蛋白。有研究发现,下调Bmi-1基因可通过上调Cleaved-Caspase-3蛋白的表达促使细胞凋亡发生[14,18]。目前关于Bmi-1在非小细胞肺癌化疗敏感性调控中的作用机制尚不清晰,本研究采用Western blotting检测发现,siRNA靶向下调Bmi-1的表达,在A549与A549/DDP细胞中均可见MDR1蛋白的协同抑制,以及进一步上调了Cleaved-Caspase-3蛋白表达量。
综上所述,本研究显示干扰Bmi-1的表达可逆转非小细胞肺癌细胞耐药性,其作用机制可能与MDR1表达抑制以及凋亡相关蛋白活化有关,此结果为Bmi-1成为肿瘤治疗的潜在靶点提供了理论依据。
