Maspin在肿瘤发生发展中的作用
2019-07-26焕综述陈龙邦审校
孙 茜,李 焕综述,陈龙邦审校
0 引 言
乳腺丝氨酸蛋白酶抑制剂(mammary serine protease inhibitor,Maspin)是丝氨酸蛋白酶抑制剂(serine protease inhibitor,Serpin)超家族中的一员。Maspin在多种肿瘤中表达,越来越多的证据表明,Maspin基因在肿瘤的发生、进展中起到重要的作用。研究发现Maspin作为Ⅱ类抑癌基因可诱导肿瘤细胞凋亡,减少肿瘤细胞的运动及增加黏附能力来抑制肿瘤的侵袭和转移,还可直接诱导内皮细胞凋亡及抑制内皮细胞生成信号通路来抑制肿瘤内新生血管的形成。Maspin具有广泛的抗肿瘤作用,近年来的研究还发现Maspin与宿主免疫相关。本文将对Maspin的结构部分,肿瘤抑制作用的发挥机制等作一综述。
1 Maspin的结构与分布
Maspin是Zou等[1]1994年通过消减杂交法和差异显示分析技术,在比较正常乳腺组织与乳腺癌组织基因差异表达时发现的候选肿瘤抑制基因。Maspin属于Serpin超家族一员,也被称为SerpinB5,位于染色体18q21.3-q23区,由7个外显子和6个内含子组成,具有375个氨基酸,其cDNA包含2548个核苷酸,其中75个5’端氨基酸和1381个3’端未翻译氨基酸,其内有8个半胱氨酸组成2个及以上二硫键以稳定三级结构。Maspin的-COOH端附近有一个活性点环(reactivesiteloop,RSL),活性中心的NH 2有一铰链区,该区域在Serpin家族中高度保守,决定与之结合的特定靶点。RSL的完整性与Maspin的功能发挥密切相关[1]。敲除Maspin后的小鼠是胚胎致死的,体现了其不能被家族其他成员补偿或替代的重要生物学功能[2-3]。多种实验条件下测定了Maspin的几个靶点,包括组蛋白脱乙酰酶1(HDAC1),前尿激酶型纤溶酶原激活物(pro-uPA),单链组织型纤溶酶原激活剂(SC-TPA)。此外,干扰素调节因子6、β1整合素、胶原蛋白I和谷胱甘肽S-转移酶被鉴定为Maspin相关蛋白[4]。Maspin是一种上皮特异性基因,在许多类型包括前列腺、乳腺和肺等实体肿瘤的发展过程中受到不同的调节[5]。Maspin基因表达在胰,胆囊、结肠癌、甲状腺癌中上调[6-7],但在乳腺癌,前列腺癌、肺癌、胃癌和黑素瘤、口腔癌、食管癌中下调[6-9]。Maspin无特定的亚细胞定位序列的模体,目前发现有4种Maspin,分别是核型,细胞质性,细胞膜相关型的和分泌型[5]。因此,Maspin的肿瘤抑制功能及其分子相互作用可能取决于其亚细胞定位。最近的研究表明,细胞核Maspin与分化良好的表型和存活率提高有关,而细胞质Maspin与乳腺癌、卵巢癌和头颈癌、肺癌的不良预后有关[10-13];也有研究发现在黑色瘤中,核maspin与疾病进展、复发及不良预后有关[14]。Maspin的亚细胞定位从细胞核易位到细胞质中与肿瘤进展有关。
2 Maspin的肿瘤抑制作用
目前研究发现Maspin是肿瘤抑制基因,可通过诱导凋亡、抑制肿瘤细胞迁移和运动、抑制新生血管的形成来发挥肿瘤抑制作用。见图1。
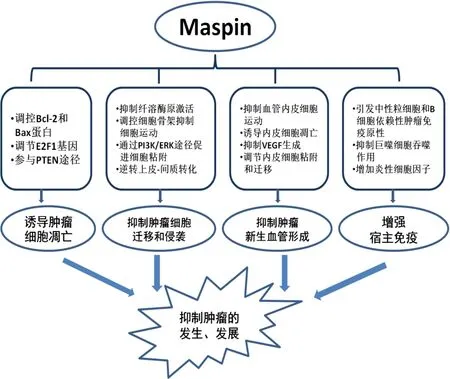
图1 Maspin在肿瘤发生发展中的机制Figure 1 The mechanism of maspin in tumor formation and progression
2.1 Maspin诱导凋亡作用Maspin是迄今为止在凋亡调控中涉及的所有Serpin超家族成员中唯一的促凋亡Serpin。Maspin可通过增强细胞对凋亡刺激的敏感性来抑制肿瘤进展,且Bax在Maspin的促凋亡作用中发挥重要作用。Liu等[15]发现Bax在Maspin转染的前列腺和乳腺肿瘤细胞中上调,而其他Bcl-2家族成员包括Bcl-2,Bcl-xl和Bak的水平则保持不变。但Zhang等[16]发现Maspin过表达的小鼠模型中促凋亡蛋白Bax水平上升的同时,抗凋亡蛋白Bcl-2的水平降低,且该现象不受转录水平的控制,而是通过选择性的控制Bcl-2和Bax蛋白稳定性实现。细胞凋亡诱导后,Maspin转染的前列腺癌细胞中有更多量的Bax从细胞质转移到线粒体,且在用Bax沉默的小干扰RNA处理后,Maspin转染的前列腺癌细胞对药物诱导的细胞凋亡更敏感。另外转染Maspin的前列腺癌细胞经凋亡诱导剂处理后,细胞中的Caspase-8和9的活化增加[15]。E2F1转录因子是肿瘤抑制因子RB的关键下游靶标。E2F1被激活时后可诱导细胞增殖和/或凋亡。研究发现Maspin可作为E2F1调节基因而诱导凋亡[17]。研究者利用DNA微阵列的方法分别分析了经过E2F1激动剂和细胞毒性药物处理的人骨肉瘤细胞株中的基因谱,发现了Maspin的表达增加,并且联合用药时Maspin的表达增加更显著。在小干扰RNA处理E2F1后,Maspin的水平下降。然而,当在用小干扰RNA处理Maspin之后,发现E2F1激动剂联合细胞毒性化疗药处理的细胞株的凋亡水平下降,在独立试验中也发现了相同的结果,表明Maspin是E2F1促进凋亡的必要因子。Gan等[18]发现Maspin可通过PTEN/Maspin途径调节前列癌的紫杉醇耐药,PTEN的过表达可引起细胞凋亡,PTEN对紫杉醇诱导细胞凋亡的促凋亡效应可通过敲除Maspin来消除。基于Maspin可增强细胞对凋亡刺激更敏感的特点,对Maspin在增加肿瘤对化疗药物敏感进行了相关研究。Jiang等[19]发现导入Maspin后,乳腺癌细胞对星形环孢素诱导细胞凋亡的敏感度增加;Ben等[17]发现Maspin可通过增强E2F诱导的凋亡来增加骨肉瘤细胞对多西他赛和顺铂的敏感性;Chen等[20]发现Maspin可增加膀胱癌细胞对顺铂的敏感性,同时发现转染Maspin后,癌细胞的凋亡增加。
2.2 抑制肿瘤细胞侵袭和转移Maspin可抑制肿瘤的侵袭和转移,其作用部位在细胞膜上,当用重组Maspin处理乳腺癌细胞时,通过免疫染色显示Maspin蛋白质特异性结合于细胞表面,表明Maspin活性是膜相关的[21]。G-螺旋是Maspin抑制细胞迁移和改变细胞粘附的关键部位,其通过影响细胞表面的β1整合素的活化状态来发挥作用[22]。Maspin能抑制前列腺癌细胞中的细胞表面结合尿激酶型纤溶酶原激活物(urokinase plasminogen aetivator,uPA)[23]。uPA是一种丝氨酸蛋白酶同时也是纤溶系统的重要组成部分,通过与细胞表面的uPA受体结合,降解细胞外基质、纤维连接蛋白、层黏连蛋白、板层素、蛋白多糖等基膜成分,促进细胞浸润及转移。在转染Maspin的前列腺癌细胞中,uPA及其受体蛋白显著降低,但mRNA的水平不受影响。酶和分子分析显示Maspin通过与细胞表面的uPA形成SDS抗性复合物来抑制细胞表面的纤溶酶原激活。Maspin对细胞周围uPA活性的影响可能是其在细胞黏附步骤中的刺激作用及其对细胞侵袭和运动的抑制作用的基础[23-24]。Rho GTPases通过对肌动-肌球蛋白细胞骨架进行调控而影响细胞移动,有研究发现Maspin可通过调节Rho GTPase尤其是Rac1和其效应物PAK1活性来抑制细胞运动,并通过PI3K/ERK途径促进细胞粘附[25]。转染Maspin的乳腺癌细胞的细胞运动力下降,并在转染Maspin的12-24h后发现Rac1和PAK1的活性也是下降的,说明Maspin可通过抑制Rac1抑制细胞运动。PI3K/ERK通路参与了黏附因子所介导的细胞黏附、运动和侵袭作用,在乳腺癌细胞经重组Maspin处理后的1h内观察到了PI3K和ERK1/2活性增加,在12h后恢复基线水平,同时观察到了细胞黏附性下降30%。作者还发现了PI3K信号不影响Rac的活性,经PI3K抑制剂处理过的重组Maspin的乳腺癌细胞后,发现Rac的活性下降程度与未加抑制剂一样。除改变肿瘤细胞的运动及黏附能力,Maspin还可通过逆转上皮-间质转化抑制肿瘤的侵袭和转移。Cai等[26]发现Maspin可抑制上皮生长因子诱导的上皮-间质转化,将Maspin导入经表皮生长因子(epithelial growth factor,EGF)诱导的上皮-间质转化的食管癌细胞模型中,发现相比亲代和空载细胞系接受EGF刺激后细胞形态从上皮样转化为纺锤样,Maspin转染的癌细胞仍呈聚集状态,并且Mapsin转染细胞的侵袭和转移能力更低。Bernardo等[4]发现Maspin可通过一系列的时间和空间上的过程驱动前列腺癌细胞的再分化,这可逆转上皮-间质转化。
2.3 抑制新生血管形成血管生成,指从先前存在的毛细血管中形成新的血管,对肿瘤的生长和转移是至关重要的。Maspin可通过抑制新生血管的形成发挥肿瘤抑制作用。体外试验中,Maspin基因能够直接抑制培养基中血管内皮细胞向碱性纤维生长因子和血管内皮生长因子的运动,抑制有丝分裂和血管生成。在将转染Maspin基因的人前列腺肿瘤细胞接种小鼠后,发现肿瘤生长速度明显减慢,且肿瘤微血管的密度明显减少。Maspin的RSL的突变使其失去了抑制纤维母细胞,角化细胞和乳腺癌细胞迁移的能力,但仍然能够阻止体外和体内的血管生成[27]。另外有研究发现,Maspin可直接诱导血管内皮细胞凋亡,在含乳腺癌细胞的异种移植小鼠模型中发现Maspin可诱导新生内皮细胞凋亡,干扰肿瘤新生血管的形成,而不影响正常成熟的血管内皮细胞[28]。突变p53和血管内皮生长因子(vascular endothelial growth factor,VEGF)与血管生成有关,而Maspin是一种强有力的血管生成抑制剂,有研究发现Maspin的P53调控,抑制VEGF引起的内皮刺激[29]。野生型P53参与多种生物过程,其中包括抑制血管生成,突变型则与血管生成相关;Zou等[30]在乳腺癌及前列腺癌细胞中发现,P53可直接结合到Maspin启动子中的P53共识结合位点来激活Maspin启动子。研究发现在早期口腔癌中,Maspin与突变型P53及VEGF呈负相关,但突变型P53与VEGF呈正相关,于是假设P53调控Maspin表达,Maspin抑制VEGF生成(P53-Maspin-VEGF),从而抑制血管生成[26]。Bolat等[31]发现卵巢癌患者中的Maspin的表达与 VEGF-A(P=0.01)、VEGF-C(P<0.001)、VEGF-D(P<0.001)的表达相关,且Maspin、VEGF-A、VEGF-C、VEGF-D的表达与肿瘤的不良预后有关。有88.3%(53/60)的卵巢癌样本的Maspin仅在细胞质中表达,11.7%(7/60)的样本的Maspin在细胞质和细胞核中均有表达[31],这些结果说明Maspin的亚细胞定位与其功能发挥肿瘤血管抑制作用有关。另外Qin等[32]发现体外试验中,Maspin通过整合信号β1通路调节内皮细胞黏附和迁移,Maspin在血管和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)中表达。HUVECs中的Maspin能激活整合素连接激酶,增强HUVEC细胞粘附在各种基质蛋白上的能力,抑制血管形成。
3 Maspin与免疫
既往关于Maspin的研究主要集中于其肿瘤抑制作用,关于免疫方面的研究相对较少。Dzinic等[33]发现Maspin与肿瘤宿主免疫有关,携带Maspin表达含前列腺癌细胞的无胸腺小鼠模型中,全身及肿瘤内中性粒细胞成熟、活化和抗体依赖性细胞毒性增加,而肿瘤周围淋巴管生成减少。这些结果揭示了Maspin在增强宿主免疫、抗肿瘤方面的新生物学功能,即肿瘤细胞中的Maspin表达能引发中性粒细胞和B细胞依赖性宿主肿瘤免疫原性。巨噬细胞是肿瘤微环境中最常见的免疫细胞并影响肿瘤发生的每一步。最近的研究发现Maspin可抑制巨噬细胞的吞噬作用,并增加炎性细胞因子的产生[34];Maspin的这个作用是通过激活NF-κB信号通路发挥的。Maspin刺激后,巨噬细胞中的IL-1β,TNF-α,IFN-γ,IL-6,IL-12,IL-10,and M1样标记物(M1样巨噬细胞发挥抗肿瘤作用)增多,而TGF-β、M2样标记物(促肿瘤作用)减少。Western试验发现Maspin刺激的巨噬细胞中NF-κB的表达上升,阻断NF-κB后,巨噬细胞的吞噬作用得到恢复。Yang等[35]通过2D凝胶电泳分离了结肠癌患者的癌组织及正常组织的蛋白质,并用患者的自身血清抗体进行检测,发现了170种仅在癌组织中表达的血清抗体反应蛋白,其中有包括Maspin在内的4种蛋白重复表达;在跨越结肠癌的各种临床阶段的8名患者的验证组中通过蛋白质印迹和免疫组织化学独立地证实这4种蛋白质在癌组织中相对于正常组织呈过度表达。这些结果揭示了Maspin作为肿瘤抑制基因发挥着依赖于微环境的新的生物功能,可能为基于Maspin的肿瘤免疫治疗开辟一条新的途径。
4 结 语
Maspin是一种表皮特异性的肿瘤抑制基因,其细胞亚定位与其功能发挥相关,Maspin可诱导凋亡、抑制肿瘤细胞侵袭、转移和新生血管形成,进而影响肿瘤细胞的发生、发展,最近的研究发现Maspin还与宿主免疫相关。由于Maspin的广泛抗肿瘤作用,对Maspin的监测、评价及应用有望成为恶性肿瘤的预后预测因子或治疗手段。
