内蒙古科尔沁地区食疗用酸马奶发酵引子化学成分及细菌多样性分析
2019-07-26乌日汗包连胜包秀萍王歆远贾士儒
乌日汗,包连胜,包秀萍,李 爽,王歆远,贾士儒*
(1.天津科技大学生物工程学院,天津 300457;2.内蒙古民族大学生命科学学院,内蒙古 通辽 028043;3.内蒙古民族大学附属医院康复保健医院,内蒙古 通辽 028000)
自古以来,饮食疗法在蒙医学中占据重要地位,而酸马奶是最早应用于食疗的饮料[1]。蒙古人酿制酸马奶的技术和用其治疗疾病之事,早在元代即已驰名国内外,亦有元代以前给受伤大出血昏厥的人喝酸马奶以救治的记载[2]。据文献报道,酸马奶对结核病为主的传染性疾病、消化系统疾病、心血管系统疾病等均有明显的辅助治疗作用[3-6]。因此,目前俄罗斯、蒙古国和我国内蒙古地区还专门设立了“酸马奶医疗中心”,用其治疗或辅助治疗消化系统病、心血管系统病等慢性疾病[7]。酸马奶的这些治疗作用与其化学成分、菌群结构等密切相关。酸马奶是以新鲜马奶为原料,经乳酸菌和酵母菌等微生物共同发酵而成的。酸马奶的化学组成不仅取决于原料马奶,也与其微生物组成及含量有密切关系。群落结构除受到发酵温度、发酵时间等因素的影响以外,发酵引子也是非常重要的影响因素,发酵引子的组成、品质和活力与酸马奶质量的好坏、风味特点等有密切关系。酸马奶的发酵引子蒙语称为“horongo”,是延续酸马奶质量的关键,因此了解酸马奶发酵引子的化学组成及微生物多样性至关重要。以往对于某种体系微生物多样性的测定多采用传统分类鉴定方法,但此种方法有选择性和局限性,因自然界中绝大部分微生物仍处于无法培养状态。随着分子生物学手段应用于微生物群落结构分析,弥补了传统分类学方法的不足,大大促进了对环境中不可培养微生物的研究[8],尤其是Illumina MiSeq为代表的第2代测序技术,采用边合成边测序原理,不仅可以对不同样品的多个可变区同时进行测序,而且拥有较高的测序速度和通量,结果可信度也较高[9]。目前该测序技术在微生物多样性和群落结构分析方面已经获得广泛的应用,但利用该技术在酸马奶群落结构方面的研究尚鲜见报道。
1 材料与方法
1.1 材料与试剂
酸马奶引子:取自内蒙古通辽市科尔沁区食疗用酸马奶生产地的3 个平行样品(命名为酸马奶引子-1、酸马奶引子-2、酸马奶引子-3),测定pH值后分别装入采样管中封口,立即在液氮中冷冻后带回实验室保存于-80 ℃,进行后续实验。
FastDNA®Spin Kit for Soil试剂盒 美国MP Biomedicals公司;Agencourt AMPure XP核酸纯化磁珠美国Beckman Coulter公司;TopTaq DNA Polymerase kit北京全式金生物公司。
1.2 仪器与设备
PHS-3C pH计 上海仪电科学仪器公司;1260液相色谱系统、7890A气相色谱仪、2100生物分析仪美国Agilent公司;NanoDrop 2000分光光度计、Invitrogen Qubit 3.0分光光度计、ABI 2720 Thermal Cycler扩增仪 美国Thermo Fisher Scientific公司;MiSeq台式测序仪 美国Illumina公司;5810R高速冷冻离心机德国Eppendorf公司。
1.3 方法
1.3.1 化学成分分析
1.3.1.1 乳糖、半乳糖和葡萄糖含量的测定[8]
将冻存的酸马奶引子样品在室温下融化后摇匀,称取0.4 g该样品,与1.2 mL超纯水混合均匀,超声波处理3 min,以105 ℃高压处理15 min,再经4 ℃、4 500 r/min离心10 min。取上清液经0.22 µm膜过滤后进入Agilent 1260液相色谱系统(Bio-Rad HPX-87H离子交换柱(300 mm×7.8 mm)),使用示差检测器检测。流动相为5 mmol/L硫酸溶液,流速0.6 mL/min,柱温60 ℃,进样量20 μL,18 min停止。
1.3.1.2 有机酸含量的测定
将冻存的酸马奶引子样品在室温下融化摇匀,称取1.0 g样品,与3 mL 1 mol/L的盐酸振荡混匀,12 000 r/min离心15 min,吸取上清液经0.22 μm滤膜过滤后进入1260液相色谱系统分析。流动相为5 mmol/L的硫酸,流速0.6 mL/min,示差检测器检测,柱温60 ℃,进样量20 μL,25 min停止。
1.3.1.3 游离脂肪酸含量的测定[10]
脂肪的提取:将冻存样品室温融化摇匀,取1 mL样品加入1.5 mL氯仿-甲醇溶液(2∶1,V/V),25 ℃浸提3 h,加入0.9%氯化钠溶液静置分层,收集下层氯仿层氮吹浓缩。
脂肪酸甲酯化:在脂肪提取物中加入2 mL正己烷摇匀,加入2 mL 14%三氟化硼-甲醇,50 ℃水浴5 min,再加入饱和氯化钠溶液至10 mL,离心取上清液,经0.45 μm滤膜过滤后进行分析。
气相色谱检测:采用配有氢火焰检测器的7890A气相色谱仪(HP-innowax(30 m×0.32 mm,0.5 µm))进行检测。载气为氮气,恒压:线速率38.4 cm/s;进样口温度270 ℃,进样体积1 µL,分流比20∶1;柱温箱温度:初始50 ℃保持2 min,以25 ℃/min的升温速率升温到175 ℃,以3.5 ℃/min的升温速率升温到230 ℃,保持5 min;检测器温度280 ℃,气体设置为氢气40 mL/min、空气450 mL/min、尾吹气30 mL/min。
1.3.2 细菌多样性分析
1.3.2.1 宏基因组DNA的提取
将各酸马奶引子样品在室温充分融化,按照FastDNA®Spin Kit for Soil试剂盒说明书抽提基因组DNA,并使用Nanodrop 2000检测其质量(质量浓度≥20 ng/μL,总量≥500 ng,OD260nm/OD280nm=1.8~2.0),同时利用1%琼脂糖凝胶电泳检测其完整性。
1.3.2.2 目的区域扩增
以提取的基因组DNA为模板,使用16S rDNA V3-V4区特异引物341F(5’-CCTACGGGNGGCWGCAG-3’)和805R(5’-GACTACHVGGGTATCTAATCC-3’),并采用高效和高保真酶(TopTaq DNA Polymerase kit)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,设置3 个重复实验,扩增条件为:94 ℃预变性2 min;94 ℃变性20 s,55 ℃退火30 s,72 ℃延伸1 min,共进行25 个循环;最后72 ℃延伸10 min。
1.3.2.3 PCR产物的混样和纯化
PCR产物使用1%琼脂糖凝胶进行电泳检测;将同一样本的3 个平行扩增产物混合,每个样本加入等体积的Agencourt AMpure XP核酸纯化磁珠对产物进行纯化。
1.3.2.4 各样本添加特异性标签序列
利用带有Index序列的引物,通过高保真PCR向文库末端引入特异性标签序列。此处采用8 个循环数的PCR程序。扩增后的产物利用1%琼脂糖凝胶电泳检测,使用核酸纯化磁珠对扩增产物进行纯化,即可得到各样本的原始文库。
1.3.2.5 文库进行定量及混合
将上一步得到的纯化产物利用1%琼脂糖凝胶进行初步定量,根据其结果对已经带有各自Index标签的样本文库浓度进行适当稀释,后利用Qubit对文库进行精确定量,根据不同样品的测序通量要求,按相应比例混合样品,后采用MiSeq平台,2×250 bp的双端测序策略对文库进行测序,后续进行生物信息学分析。测序及生物信息服务由上海天昊生物科技有限公司完成。
1.3.2.6 生物信息学分析
测序得到的原始数据(Raw Data),存在一定比例的干扰数据(Dirty Data)。为得到高质量的测序数据,以提高后续生物信息分析准确性、可靠性,首先对原始数据进行拼接、过滤,得到质量和可信度较高的优化序列(Clean reads),然后对优化序列在97%水平上进行可操作分类单元(operational taxonomic units,OTU)聚类,并使用mothur软件将每条OTU代表序列与数据库进行比对从而完成OTU的物种注释。通过对OTU进行丰度、Alpha多样性以及物种在各个分类水平上的群落结果统计分析,得到细菌群落结构组成。
2 结果与分析
2.1 化学组成分析结果
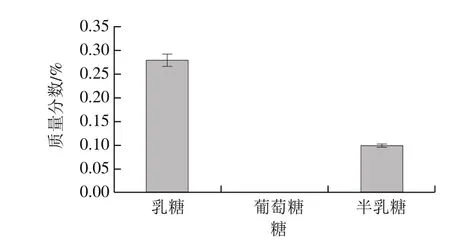
图1 酸马奶引子样品中糖含量Fig. 1 Sugar content of koumiss starter culture
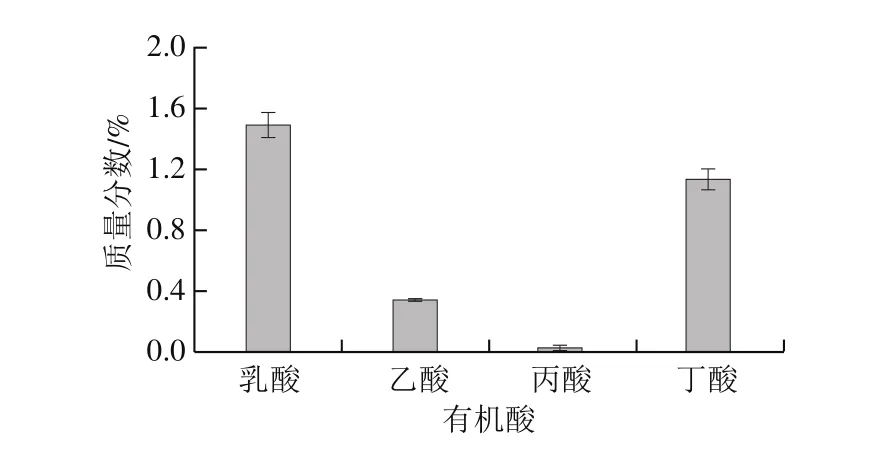
图2 酸马奶引子样品中4 种有机酸含量Fig. 2 Contents of organic acids in koumiss starter culture
该酸马奶引子样品pH值为3.54;糖含量检测结果显示(图1),该酸马奶发酵引子中乳糖和半乳糖质量分数分别为(0.281±0.011)%和(0.100±0.003)%,未检测到葡萄糖。此外,检测的4 种有机酸(图2)中,乳酸质量分数最高,为(1.506±0.069)%;其次为丁酸(1.143±0.061)%,乙酸和丙酸质量分数分别为(0.345±0.014)%、(0.053±0.002)%。
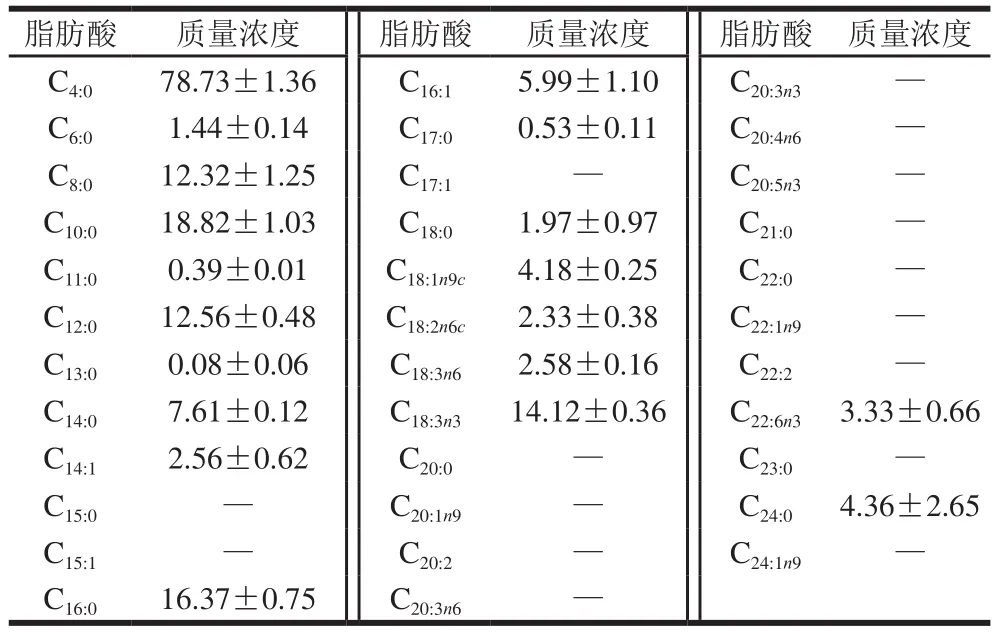
表1 酸马奶引子样品中脂肪酸组成及含量Table 1 Fatty acid composition of koumiss starter culture mg/L
表1显示,共检测到19 种脂肪酸,包括12 种饱和脂肪酸和7 种不饱和脂肪酸。饱和脂肪酸中丁酸(C4:0)质量浓度最高,为(78.73±1.36)mg/L;其次为癸酸(C10:0),质量浓度为(18.82±1.03)mg/L。检测到的7 种不饱和脂肪酸中,包括十四碳烯酸(C14:1)、棕榈油酸(C16:1)、油酸(C18:1n9c)3 种单不饱和脂肪酸和亚油酸(C18:2n6c)、γ-亚麻酸(C18:3n6)、α-亚麻酸(C18:3n3)、二十二碳六烯酸(docosahexaenoic acid,DHA)(C22:6n3)4 种多不饱和脂肪酸。多不饱和脂肪酸中α-亚麻酸(C18:3n3)质量浓度高达(14.12±0.36)mg/L。
2.2 细菌多样性分析
2.2.1 序列丰度和多样性
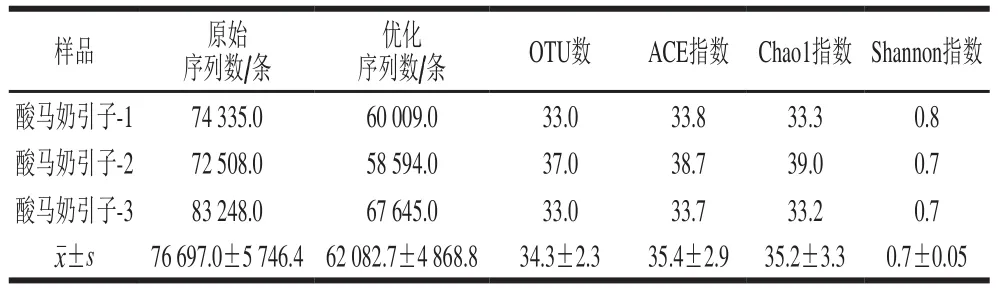
表2 样品信息、序列丰度和多样性指数统计Table 2 Sample information, sequence abundance and microbial diversity of koumiss starter culture
通过Illumina MiSeq第2代测序技术,纳入本研究的3 个样品共产生230 091 条原始序列,经过质控和过滤后共得到186 248 条高质量优化序列,各样本所产生序列数见表2,该酸马奶引子样品平均获得62 082.7 条优化序列。将所得优化序列以97%的相似性进行聚类,相似度大于97%的序列将聚为同一个OTU,同时使用de novo模式去除嵌合体序列,最终产生34.3 个OTU,每个样品OTU聚类后使用mothur软件找出与OTU序列相似度最高且可信度达80%以上的物种信息用于OTU注释。该酸马奶引子样品可以注释到1 个界、4 个门、8 个纲、13 个目、22 个科、25 个属和28 个种,各分类水平上的OTU数目见表3。
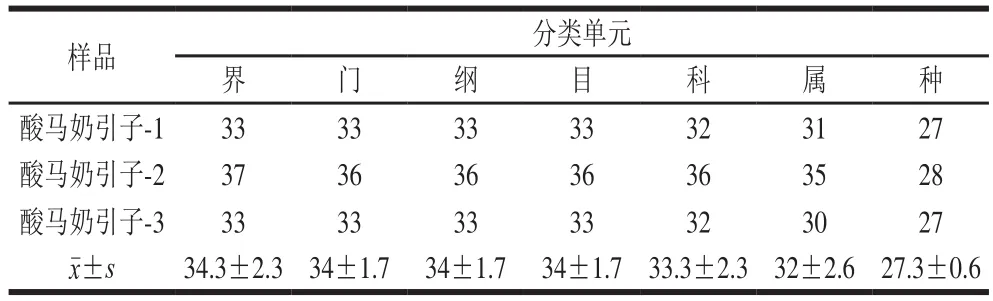
表3 各分类水平上的OTU数目统计Table 3 Statistics of the numbers of OTUs at each taxonomic level
2.2.2 Alpha多样性分析
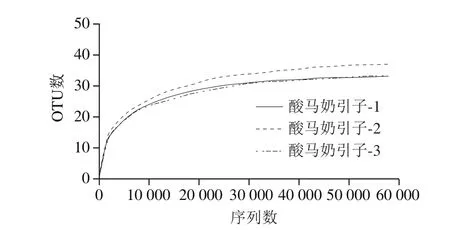
图3 样品的细菌稀疏曲线图Fig. 3 Rarefaction analysis of the pyrosequencing reads in samples of koumiss starter culture
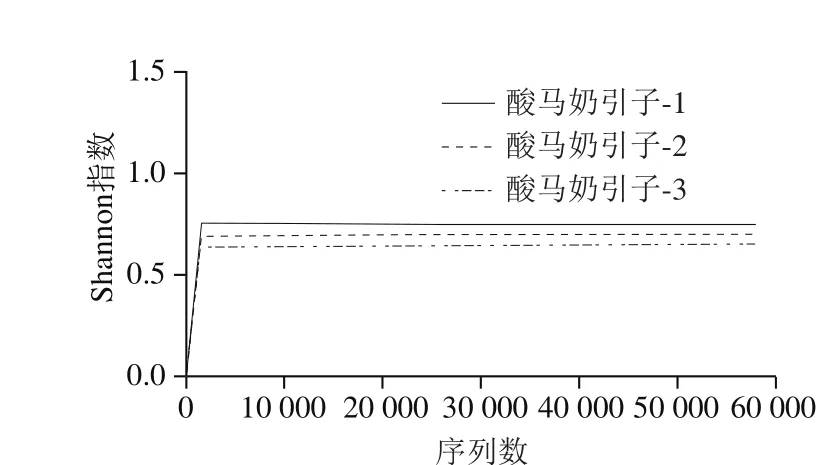
图4 样品的Shannon-Wiener曲线Fig. 4 Shannon-Wiener index curve of samples of koumiss starter culture
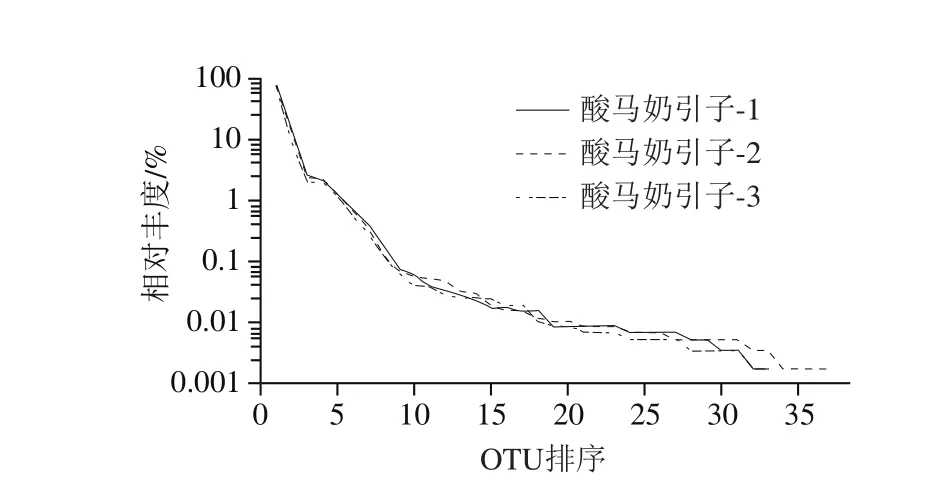
图5 样品的Rank Abundance曲线Fig. 5 Rank Abundance distribution curve of samples of koumiss starter culture
该样本菌群丰富度指数Chao1指数和ACE指数分别为35.2±3.3和35.4±2.9(表2);样本的稀释性曲线如图3所示,该曲线随着抽取序列数的增加而趋于平缓,说明样本的测序数据量合理,更多的数据量只会产生少量新的OTU。但Shannon多样性曲线已经饱和,如图4所示,说明即使再增加测序量,样本微生物的多样性已经不再随之发生变化,该测序数据量可以反映样本绝大多数的微生物信息。从图5可知,Rank Abundance曲线在横坐标上的范围较大且整体较平滑,表明其物种的丰度较高且物种的分布较均匀。
2.2.3 群落结构分析
该酸马奶引子样品鉴定为4 个门,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),其中厚壁菌门在样品中的含量最高(88.75%),其次为变形菌门(11.12%)(图5A);从纲的分类水平来看(图5B),酸马奶发酵引子细菌在芽孢杆菌纲(Bacilli,88.74%)、α-变形杆菌纲(Alphaproteobacteria,9.87%)、γ-变形杆菌纲(Gammaproteobacteria,1.25%)中均有分布;从目的分类水平来看(图5C),酸马奶发酵引子细菌主要在乳酸杆菌目(Lactobacillales,88.74%)和红螺菌目(Rhodospirillales,9.84%)有分布;在科的分类水平上,该样品细菌主要在乳杆菌科(Lactobacillaceae,84.08%)、醋杆菌科(Acetobacteraceae,9.84%)和链球菌科(Streptococcaceae,4.59%)有分布;在属的分类水平上,如图5E所示,相对丰度由大到小依次为乳杆菌属(Lactobacillus,84.08%)、醋杆菌属(Acetobacter,9.83%)、乳球菌属(Lactococcus,2.41%)、链球菌属(Streptococcus,2.18%)、其他(others,1.5%)。由此可见,乳酸杆菌属为该酸马奶引子样品的绝对优势种群。
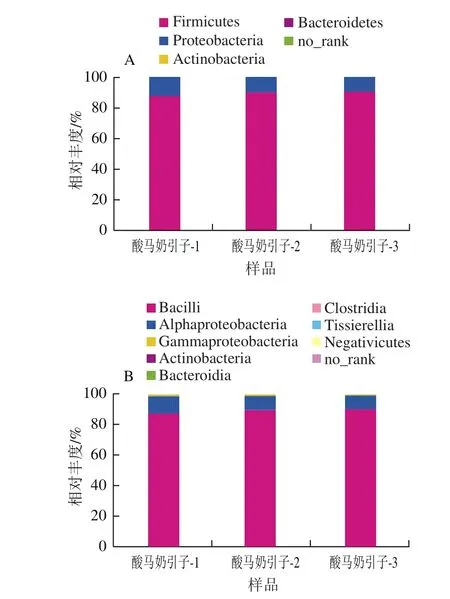
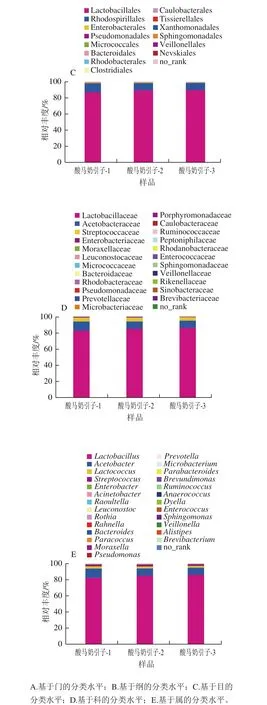
图6 样品中菌群相对丰度Fig. 6 Relative abundances of bacteria in samples of koumiss starter culture at various taxonomic levels
3 讨 论
酸马奶口味存在地区差异,这种差异可由发酵引子延续。因为酸马奶的发酵引子即为发酵结束后留存的酸马奶,可采用不同的方法保存至下一次发酵,本研究酸马奶引子样品为该地区食疗用酸马奶酿制方将发酵结束后的酸马奶在罐中冷藏保存。酸马奶引子是专属的,不仅是酸马奶发酵的基础,也可代表该地区酸马奶的基本特点。
大多数成年人由于缺乏乳糖酶或乳糖酶活力低而不能消化利用乳糖,导致乳糖不耐症,表现为肠胃气胀、腹痛和腹泻[11-12]。鲜马乳中所含的糖类物质几乎全为乳糖,且比牛乳的含量高出20%之多[13]。孙天松等[7]检测新疆地区28 个酸马奶样品化学组成,结果显示其乳糖质量浓度为1.34~3.4 g/100 mL。蒙古国酸马奶的乳糖质量分数平均为2.3%(发酵时间18 h),前苏联酸马奶的乳糖质量分数为2.6%(发酵时间24 h)[14]。鲜马乳中乳糖含量降低是由于鲜马乳中的乳糖在乳酸菌的作用下,通过半乳糖苷透过酶和磷酸转移酶的作用进入细胞,然后由β-半乳糖苷酶水解成一分子的葡萄糖和一分子的半乳糖。本研究酸马奶引子样品中乳糖含量仅为(0.281±0.011)%,低于上述研究结果,该结果证明,酸马奶发酵结束,保存引子的过程中此反应虽然缓慢,但仍在继续。因此酸马奶非常适合于乳糖不耐症患者饮用。
马乳中的乳糖在乳酸菌和酵母菌的作用下降解,产生大量以乳酸为主的有机酸,使得其pH值下降。布仁其其格等[15]对内蒙古锡林郭勒盟正镶黄旗农户家酸马奶发酵过程进行检测,pH值最低达到3.54。孙天松等[7]对新疆维吾尔自治区不同地区28 份酸马奶样品测定的pH值为3.47~4.56。Ishii[16]对蒙古国游牧民族3 个地区的酸马奶进行了测定,pH值为3.7~3.9。本研究中酸马奶引子样品pH值为3.54,处于较低水平。酸马奶pH值受到微生物组成、环境、气候、发酵温度和发酵时间等因素的影响而产生一定差异。
有机酸不仅是酸乳中乳糖代谢的中间产物,又是形成某些风味物质的前体物。本研究检测的4 种有机酸中,乳酸质量分数最高,为(1.506±0.069)%。在发酵乳的生产中乳酸起着非常重要的作用,它不仅是导致pH值降低的主要原因,也是酸乳浓厚的风味和香味的来源之一[17]。本样品中丁酸含量仅次于乳酸。据临床数据显示,胃排空延迟为常见疾病,尤其多发于功能性消化不良、糖尿病性或者特发性胃轻瘫等患者,主要表现为胃饱胀感、腹痛、腹胀、恶心、呕吐等[18-23]。丁酸可以特异性的通过GPR43受体促进任何小鼠gastroid中产ghrelin内分泌细胞的分化,从而增加胃的三相收缩促进胃排空[24]。
酸乳制备过程中,乳脂类的酶促水解反应最终产生游离脂肪酸和甘油。此外,乳糖代谢、氨基酸脱氨基和脂类氧化等都可能形成游离脂肪酸。本研究共检测出19 种脂肪酸,包括12 种饱和脂肪酸和7 种不饱和脂肪酸。不饱和脂肪酸中的多不饱和脂肪酸是人体必需的脂肪酸,具有诸多生理功能,例如调节血脂、改善血液循环、防止动脉粥样硬化和血栓形成等[25-26]。但多不饱和脂肪酸机体自身不能合成,必需由食物供给。本样品检测出4 种多不饱和脂肪酸,分别为亚油酸(C18:2)、α-亚麻酸(C18:3n3)、γ-亚麻酸(C18:3n6)和DHA(C22:6n3)。
酸马奶发酵的特有风味和营养价值是由微生物之间的共同作用促成的。酸马奶中微生物的多样性极其丰富。多年来,在酸马奶微生物多样性的研究中,多采用传统分类鉴定方法。孙天松等[27]采用此方法从新疆地区30 份酸马奶中共分离到152 株乳酸菌,其中Lactobacillus helveticus占51.3%,Lactobacillus acidophilus占18.4%,Lactobacillus casei subsp. pseudoplantarum占8.6%。Ring等[28]也采用传统培养方式鉴定蒙古国酸马奶中乳酸菌的多样性,结果发现乳杆菌属是酸马奶中的优势菌群,同时也检测到了嗜热链球菌、拉乌尔菌属、嗜冷杆菌属等。由于该种方法的局限性,同时随着分子生物学的不断发展,高通量测序技术自2006年开始广泛应用于微生物群落结构分析领域。布仁其其格[8]采用454焦磷酸高通量测序技术,对内蒙古锡林郭勒盟酸马奶发酵过程中细菌群落结构动态变化进行了测定,其结果显示酸马奶发酵过程中存在丰富的细菌多样性,而且乳杆菌属为优势细菌属,占51.06%,乳球菌属为其次的优势菌属,占30.29%。本研究利用Illumina MiSeq第2代测序技术鉴定内蒙古科尔沁地区酸马奶引子样品细菌多样性,其结果显示,乳杆菌属为该样品绝对优势种群,占84.08%之多。此值明显高于以上研究结果,分析其可能的原因:1)Illumina MiSeq高通量测序技术覆盖深度非常大,对物种多样性的分析十分有利,因此该技术不仅可作为全面、客观地揭示特定环境中群落结构的有效途径,同时也可作为更深层次挖掘有益微生物资源的有效手段;2)酸马奶引子在保存过程中,随着pH值的持续下降,其他菌属无法承受如此酸性环境而降解,但乳杆菌属因其更强的耐酸性,持续繁殖,继而占据绝对优势。目前,益生菌受到人们越来越多的关注。根据联合国粮食及农业组织和世界卫生组织益生菌的定义,益生菌是一种食用者摄取适当量后,能对食用者健康发挥有益作用的活菌[29]。益生菌通常由食物携带或以制剂形式口服,若要发挥其生理功能,必需要耐受胃酸而活着到达肠道[30-31]。因此作为益生菌,应当具备一些生物学特性,例如耐酸性。本研究中,酸马奶引子样品pH值低至3.54,且仍有大量的乳杆菌属存活,因此该酸马奶引子样品可作为优良益生菌的珍贵来源。
4 结 论
本研究对内蒙古科尔沁地区酸马奶引子样品化学成分和细菌多样性进行分析。化学成分测定结果表明,该酸马奶样品pH值为3.54,乳糖、半乳糖均较低,未检测到葡萄糖;4 种有机酸中乳酸含量最高,其次为丁酸;共检测12 种饱和脂肪酸和7 种不饱和脂肪酸,不饱和脂肪酸中α-亚麻酸含量最高。细菌多样性分析结果表明,该样品中细菌主要分布于4 个属,分别为乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)、乳球菌属(Lactococcus)、链球菌属(Streptococcus);乳杆菌属为其绝对优势菌属。
该酸马奶引子样品不仅含有较高水平的α-亚麻酸,且含有相对含量高达84.08%、耐酸能力较强的乳杆菌属,因此可作为优良的微生物资源,用于乳酸杆菌属、乳球菌属等益生菌的分离和筛选。
