组成型过表达ido基因对4-羟基异亮氨酸合成的影响及其发酵培养基的响应面优化
2019-07-26何继龙李英滋韩世宝满德恩郭脉海战俊杰张成林
何继龙,李英滋,韩世宝,满德恩,郭脉海,战俊杰,张成林,,*
(1.天津科技大学生物工程学院,天津 300457;2.菱花集团有限公司,山东 济宁 272073)
L-异亮氨酸羟化物——4-羟基异亮氨酸具有血糖浓度依赖的促进胰岛素分泌特性,以及促进脂肪代谢等功能,对糖尿病具有良好的治疗效果[1-4]。同时,4-羟基异亮氨酸还具有降血脂、保护肝功能等作用[5-7],具有广阔的应用前景。目前4-羟基异亮氨酸的工业化生产主要采用胡芦巴种子提取法,然而此方法生产效率低(1 kg胡芦巴种子仅能提取出150 mg 4-羟基异亮氨酸),致使生产规模小、产量低,严重限制了其应用[8]。此外,化学合成法因在生产过程中使用会产生乙醛等有毒或易爆物且存在提取收率低等不足,仍停留在研究阶段[9-13]。Kodera[13]、Ogawa[14]等在苏云金芽孢杆菌(Bacillus thuringiensis)中发现异亮氨酸羟化酶(isoleucine dioxygenase,IDO),由ido基因编码,该酶能够以L-异亮氨酸和α-酮戊二酸为底物特异性催化生成4-羟基异亮氨酸(图1)。在前期研究中,利用该酶开发出静息细胞法合成4-羟基异亮氨酸,但底物L-异亮氨酸和α-酮戊二酸价格较高致使该方法不利用工业化生产[15]。Smirnov[12]、Kivero[16]等将异亮氨酸羟化酶编码基因ido转化至大肠杆菌并在发酵过程中添加L-异亮氨酸,实现前体物添加法合成4-羟基异亮氨酸,然而该方法存在L-异亮氨酸被额外消耗及耗糖高等不足。
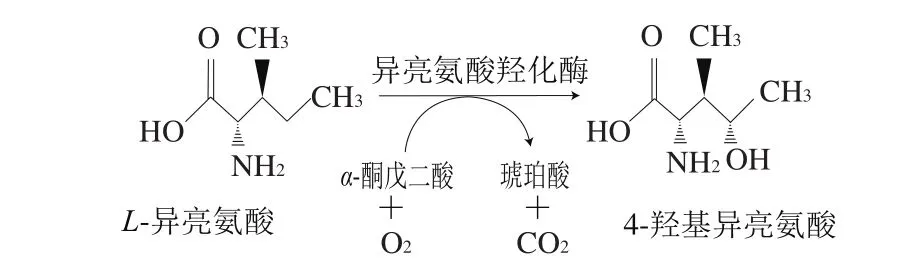
图1 异亮氨酸羟化酶催化生成4-羟基异亮氨酸的反应示意图Fig. 1 Reaction route for IDO-catalyzed synthesis of 4-hydroxyisoleucine
前期研究从苏云金芽孢杆菌TCCC 11826中克隆出ido基因(Accession No. KC884243)[17],利用该基因以L-异亮氨酸生产菌Corynebacterium glutamicum YILW-2为出发菌株[18],构建了4-羟基异亮氨酸生产菌HIL016,实现发酵法合成4-羟基异亮氨酸。在HIL016菌株中,采用诱导型质粒pXMJ19过表达ido基因,然而诱导剂IPTG通常对菌体细胞生长存在抑制作用且因其价格高昂不利于工业化生产。针对该问题本研究构建组成型表达质粒并考察ido基因组成型过表达对4-羟基异亮氨酸合成的影响,在此基础上利用响应面法优化该菌株摇瓶发酵培养基。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
本研究所用4-羟基异亮氨酸生产菌株谷氨酸棒杆菌HIL016(C. glutamicum YILW-2ΔaceAPppc::PtufPgltA::Ptuf/pXMJ19-ido)、大肠杆菌(Escherichia coli)DH5α以及质粒pXMJ19和pXMJ19-ido均由本实验室保藏。
1.1.2 引物
本研究所用引物见表1。
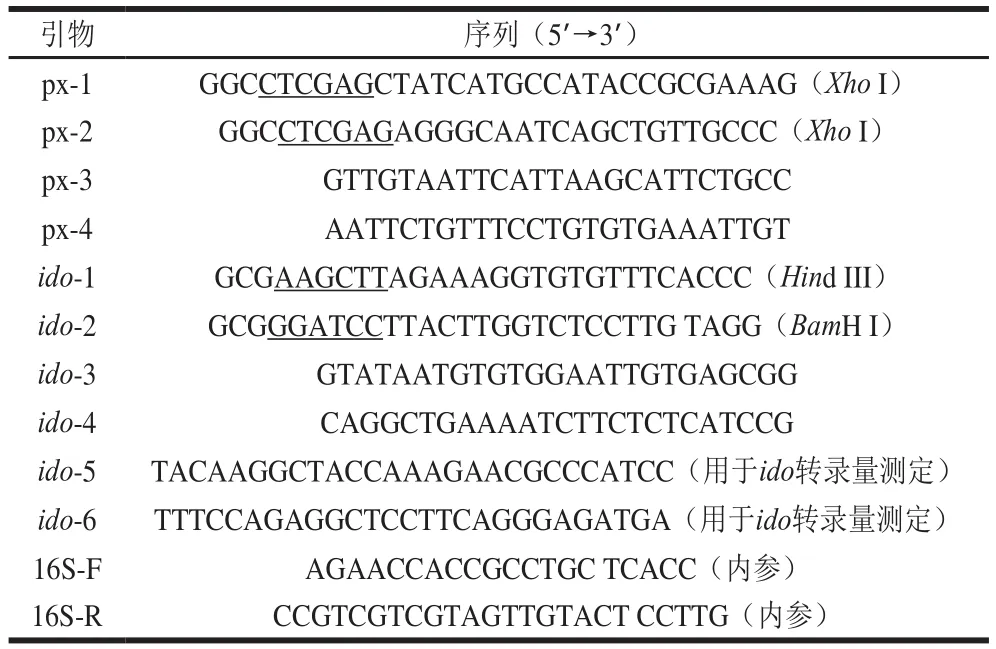
表1 实验所用引物Table 1 Primer sequences used in this study
1.1.3 培养基
LB培养基:胰化蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH 7.0~7.5,121 ℃高压蒸汽灭菌20 min[19]。
LBG培养基:LB培养中添加5 g/L葡萄糖,pH 7.0~7.5,115 ℃高温蒸汽灭菌15 min。
种子培养基:葡萄糖25 g/L,酵母粉5 g/L,(NH4)2SO45 g/L,KH2PO4·3H2O 2 g/L,MnSO4·7H2O 0.6 g/L,玉米浆40 mL/L,豆饼水解液 15 mL/L,pH 6.7~7.0,115 ℃高压蒸汽灭菌15 min。
发酵培养基:葡萄糖100 g/L,(NH4)2SO43 g/L,KH2PO4·3H2O 1.5 g/L,MgSO4·7H2O 0.6 g/L,MnSO4·7H2O 0.015 g/L,FeSO4·7H2O 0.015 g/L,VB10.001 g/L,谷氨酸3 g/L,酵母粉0.5 g/L,玉米浆30 mL/L,pH 6.7~7.0,115 ℃高压蒸汽灭菌15 min。
1.1.4 试剂
限制性内切酶、T4 DNA连接酶、ExTaq DNA聚合酶、RNAiso Plus、primeScriptTMRT、SYBR®Premix Ex Taq™ II等 宝生物工程(大连)有限公司;4-羟基异亮氨酸标准品 美国Sigma公司;化学试剂均购于国药集团化学试剂有限公司。
1.2 仪器与设备
U3000高效液相色谱仪 美国赛默飞世尔科技公司;PTC-1148型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;7500实时荧光定量PCR仪 美国ABI公司;PD-10除盐柱 英国GE Healthcare公司;ZORBAX Eclipse AAA氨基酸柱美国Agilent公司。
1.3 方法
1.3.1 组成型表达质粒pXM01的构建
根据质粒pXMJ19中阻遏蛋白编码基因lacI上下游序列设计引物px-1和px-2(表1)[20]。以质粒pXMJ19为模板,利用引物px-1和px-2进行PCR扩增,扩增产物经纯化后利用Xho I酶切并经琼脂糖凝胶电泳、切胶、回收。回收产物经T4 DNA连接酶连接后转化至E. coli DH5α感受态细胞中,然后涂布于含30 μg/mL氯霉素的LB固体培养基,于37 ℃倒置培养。挑取转化子单菌落,利用引物px-3和px-4进行菌落PCR鉴定,将鉴定正确的质粒命名为pXM01。
1.3.2 ido基因组成型表达质粒pXM01-ido及菌株HIL017的构建
以质粒pXMJ19-ido为模板,利用引物ido-1和ido-2扩增ido基因,扩增产物经纯化后利用BamH I和Hind III双酶切,经琼脂糖凝胶电泳、切胶、回收后连接至经相同酶切的pXM01。将上述连接产物转化至E. coli DH5α感受态细胞中,然后涂布于含30 μg/mL氯霉素的LB固体培养基,于37 ℃倒置培养。挑取转化子单菌落,经活化后提取质粒,分别利用Hind III及BamH I和Hind III进行单、双酶切验证,并由苏州金唯智生物科技有限公司测定质粒中ido序列。将鉴定正确的质粒命名为pXM01-ido。
将pXM01-ido转化至不含质粒pXMJ19-ido的HIL016感受态细胞(2.5 kV,25 μF,200 Ω,1 mm电击杯),然后涂布于含30 μg/mL氯霉素的LBG固体培养基[21-22],于32 ℃倒置培养。挑取单菌落活化后提取其质粒利用引物ido-3和ido-4进行PCR鉴定,将鉴定正确的菌株命名为HIL017。
1.3.3 实时定量PCR
根据ido及谷氨酸棒杆菌C. glutamicum ATCC13032 16S rDNA(内参)序列采用Primer5.0软件设计用于实时定量PCR的引物(表1)。分别将HIL016和HIL017接种至LBG培养基(含30 μg/mL氯霉素),于32 ℃、220 r/min振荡培养。对于HIL016,当OD600nm为0.6~0.8时(2~3 h)添加终浓度为0.2 mmol/L的IPTG。分别于4、8、12、24 h和36 h收集培养物,按照说明书提取菌体总RNA并反转录成cDNA。分别以接种至发酵培养基(0 h)的含质粒pXMJ19的HIL016及含pXM01的HIL017细胞为对照。利用实时荧光定量PCR仪进行检测。采用2-ΔΔCt法对ido的转录量进行分析[23]。
1.3.4 IDO酶活性测定
按1.3.3节方法收集培养4、8、12、24 h和36 h的HIL016和HIL017细胞,重悬于10 mL Tris-HCl缓冲液(100 mmol/L,pH 7.0),利用超声破碎仪破碎细胞。将细胞破碎物于4 ℃、13 000×g离心30 min后取上清液,然后利用PD-10除盐柱过滤除盐。取上述滤液100 μL加入900 μL含10 mmol/L α-酮戊二酸、10 mmol/L L-异亮氨酸、5 mmol/L FeSO4·7H2O和10 mmol/L抗血酸的Tris-HCl缓冲液(100 mmol/L,pH 7.0),反应30 min后测定利用高效液相色谱仪测定4-羟基异亮氨酸浓度[8],以每毫克总蛋白每分钟催化生成的4-羟基异亮氨酸(nmol/(min·mg))表示IDO比活力。
1.3.5 Plackett-Burman(PB)试验设计
选取前期研究中对4-羟基异亮氨酸产量影响较大的9 个因素(N=9),每个因素分为高(1)和低(-1)2 个水平,进行PB试验设计(表2)。按照设计方案进行12 次试验,响应值为4-羟基异亮氨酸产量,筛选出对其有显著影响的因素。
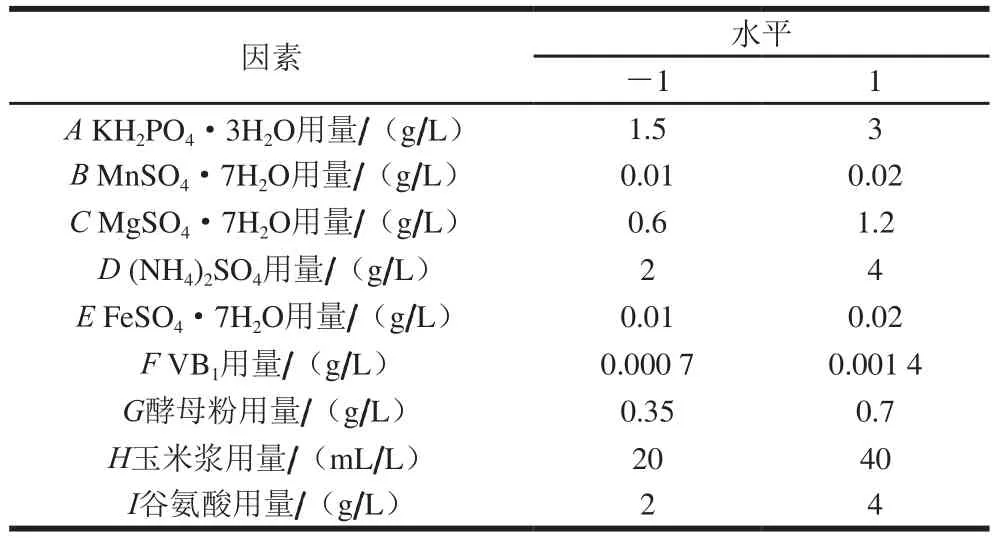
表2 PB试验设计因素与水平Table 2 Factors and levels used for PB experimental design
1.3.6 Box-Behnken试验设计
以4-羟基异亮氨酸产量为响应值,利用软件Design Experts V8.0.6,对1.3.5节筛选出的对4-羟基异亮氨酸产量影响较大的因素玉米浆、谷氨酸和FeSO4·7H2O用量,设计3因素3水平的响应面试验(表3),按照设计方案共进行15 次试验。
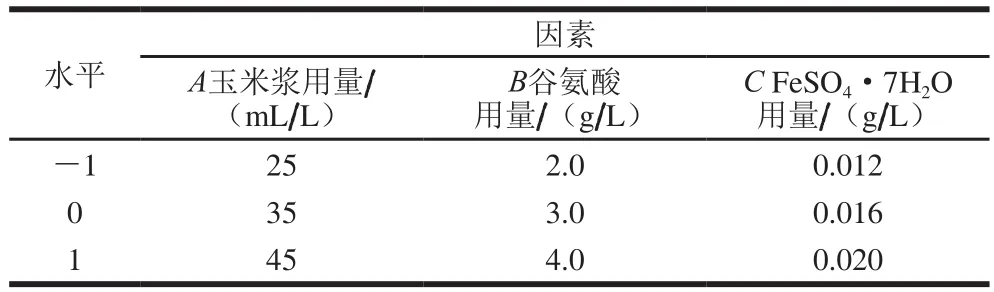
表3 Box-Behnken试验设计因素及水平Table 3 Factors and levels used for Box-Behnken design
1.3.7 摇瓶发酵实验
将活化后的4-羟基异亮氨酸生产菌株以10%(体积分数,下同)接种量接种至含30 mL种子培养基(含30 μg/mL氯霉素)的500 mL摇瓶中,于32 ℃、220 r/min振荡培养10~12 h。将种子培养物以10%接种量接种至含30 mL发酵培养基(含30 μg/mL氯霉素)的500 mL摇瓶中,以苯酚红作为pH值指示剂,用氨水维持pH 7.0~7.5,于32 ℃、220 r/min振荡培养48 h[24]。对于HIL016,当OD600nm为0.6~0.8时添加终浓度为0.2 mmol/L的IPTG。
1.3.8 菌株HIL017中pXM01-ido质粒的稳定性检测
将菌株HIL017于LBG液体培养基传代,每次传代培养12 h。取不同传代次数的培养物,适当稀释后涂布于LBG固体培养基,于32 ℃倒置培养。挑取100 个单菌落,分别接种至不含氯霉素和含30 μg/mL氯霉素的LBG固体培养基,于32 ℃倒置培养。按式(1)计算HIL017中pXM01-ido质粒的稳定性[25]:

挑取含氯霉素LBG固体培养基中的单菌落活化后按1.3.6节方法进行摇瓶发酵实验,测定其4-羟基异亮氨酸产量。
1.3.9 氨基酸及生物量检测
发酵结束后,取1 mL发酵液,于4 ℃、8 000×g离心5 min后取上清液。经2,4-二硝基氟苯衍生后利用高效液相色谱仪测定4-羟基异亮氨酸、L-异亮氨酸、L-缬氨酸和赖氨酸浓度。检测条件为:ZORBAX Eclipse AAA氨基酸柱,50%乙腈-50 mmol/L醋酸铵二元梯度洗脱。发酵液经离心后,用生理盐水洗涤菌体沉淀3 次,后用适量生理盐水重悬。利用分光光度计测定其发酵液OD600nm,根据公式(2)计算菌体生物量(以干质量计):

1.4 数据分析
每组实验均设置3 个平行并重复3 次,利用SPSS 13.0统计软件对实验数据进行分析。
2 结果与分析
2.1 ido基因组成型表达质粒及菌株的构建
pXMJ19为谷氨酸棒杆菌常用表达质粒,该质粒含tac启动子和lacO元件,基因的转录受lacI编码的LacI蛋白阻遏。按1.3.1节构建lacI缺失的组成型表达质粒pXM01。利用鉴定引物进行PCR扩增,结果如图2A所示,PCR产物经琼脂糖凝胶电泳后,出现碱基数约为1 000 bp的条带,与理论值(1 188 bp)接近;而以pXMJ19为模板扩增出碱基数约为2 000 bp的条带,与预期值(2 160 bp)接近,表明lacI成功从pXMJ19敲除。
将基因ido的PCR扩增产物按1.3.2节方法连接至pXM01。将获得的质粒进行酶切验证,结果如图2B所示,质粒经单酶切获得碱基数约为6 000 bp的条带,与pXM01(5 635 bp)和ido(723 bp)碱基数之和接近;质粒经双酶切获得碱基数分别为5 500 bp和750 bp的条带,分别与pXM01和ido碱基数接近,表明ido成功连接至pXM01,即pXM01-ido质粒构建成功。对该质粒中ido基因测序发现,其碱基序列未发生突变。
将重组质粒pXM01-ido转化至HIL016感受态细胞,提取转化子质粒进行PCR鉴定,以不含ido基因的pXM01为对照。如图2C所示,以从转化子提取的重组质粒为模板扩增出碱基数约为850 bp的片段,而以pXM01为模板扩增出碱基数约为150 bp的片段,与其理论值(分别为848 bp和155 bp)接近,表明pXM01-ido成功转化至HIL016,即HIL017构建成功。
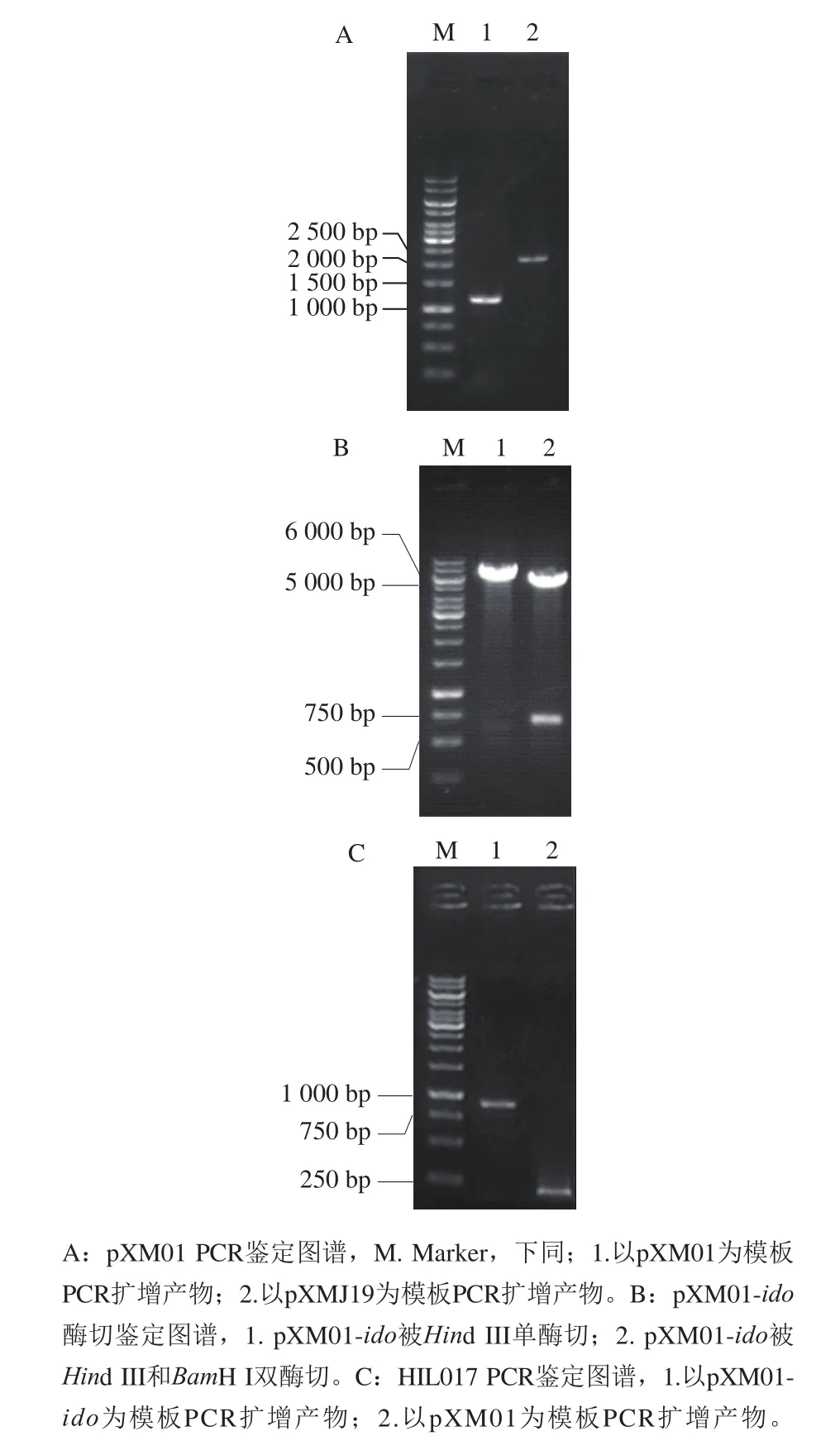
图2 pXM01 PCR鉴定、pXM01-ido酶切鉴定及HIL017 PCR鉴定图谱Fig. 2 Identification of pXM01, pXM01-ido and HIL017
2.2 菌株HIL016和HIL017的ido基因转录量及IDO比活力分析
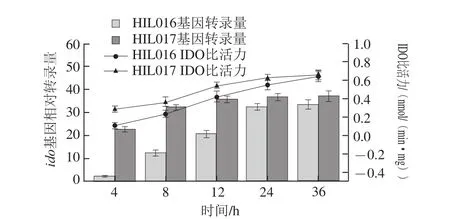
图3 菌株HIL016和HIL017的ido相对转录量及IDO比活力Fig. 3 Transcription level of ido and specific activity of IDO in HIL016 and HIL017
如图3所示,随着培养时间的延长,菌株HIL016和HIL017的ido相对转录量及IDO比活力均逐渐提高,24 h后趋于稳定。然而4~12 h时,HIL017的ido相对转录量及IDO比活力均高于HIL016,24 h后二者无显著差异。表明利用构建的阻遏蛋白基因lacI敲除质粒pXM01实现了ido基因的组成型表达,且该质粒更有益于发酵前期ido基因的过表达。
2.3 ido基因组成型过表达对4-羟基异亮氨酸合成的影响
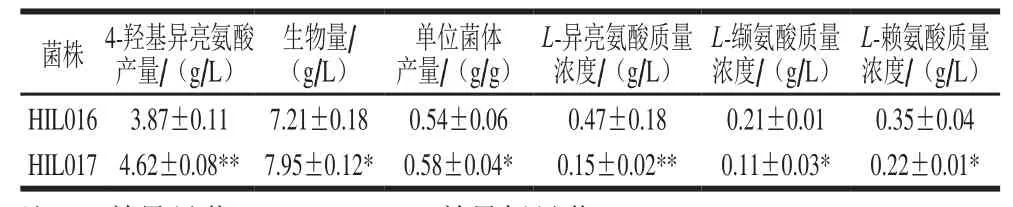
表4 菌株HIL016和HIL017摇瓶发酵主要参数Table 4 Shake-flask fermentation parameters for HIL016 and HIL017
为考察ido基因组成型过表达对4-羟基异亮氨酸合成的影响,利用HIL017进行摇瓶发酵实验,以ido基因诱导型过表达菌株HIL016为对照,结果如表4所示,经发酵48 h HIL017的4-羟基异亮氨酸产量和生物量分别为4.62 g/L和7.95 g/L,较对照菌株HIL016高19.4%和10.3%。诱导剂IPTG对细胞生长有一定的抑制作用,与HIL016采用诱导型质粒相比,HIL017采用的pXM01质粒中阻遏蛋白编码基因lacI被敲除,无需诱导即可组成型表达ido基因,避免了IPTG对细胞生长的抑制作用,故其生物量高于HIL016。由表4可知,HIL017的4-羟基异亮氨酸单位菌体产量较HIL016高7.4%,表明组成型表达ido基因可提高菌株HIL017的4-羟基异亮氨酸合成效率。此外,HIL017的副产物(L-异亮氨酸、L-缬氨酸和L-赖氨酸)生成量均显著低于HIL016,其原因可能是L-异亮氨酸和L-缬氨酸的合成均需丙酮酸[26],由于组成型表达ido基因显著提高了IDO比活力,使得更多的L-异亮氨酸合成4-羟基异亮氨酸,从而消耗更多的丙酮酸用于合成L-异亮氨酸,故L-缬氨酸生成量降低。L-异亮氨酸和L-赖氨酸均以L-天冬氨酸为前体物[27],L-异亮氨酸的过量消耗意味着更多的L-天冬氨酸用于L-异亮氨酸合成,故L-赖氨酸合成量降低。本研究考察了tac启动子组成型表达ido基因对4-羟基异亮氨酸合成的影响,目前已报道的用于谷氨酸棒杆菌的组成型启动子包括Ptuf、Psod、PgapA和PCP_2454[28-31]。在后续研究中,拟利用上述启动子调控ido基因转录,以考察其转录水平与IDO酶活性以及4-羟基异亮氨酸产量的关系。
2.4 菌株HIL017中pXM01-ido质粒的稳定性分析
对HIL017进行传代并测定其质粒稳定性及4-羟基异亮氨酸产量,如图4所示,经20 次传代,pXM01-ido的稳定性(98.4%)及HIL017的4-羟基异亮氨酸产量(4.61 g/L)未见显著降低,表明菌株HIL017中pXM01-ido稳定性好。
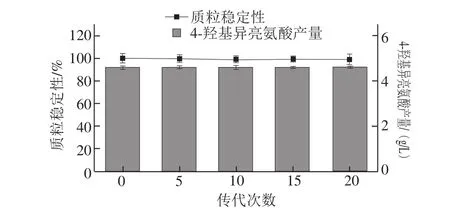
图4 HIL017中pXM01-ido稳定性及4-羟基异亮氨酸产量Fig. 4 Stability of pXM01-ido and production of 4-hydroxyisoleucine by HIL017
2.5 PB试验结果
选取KH2PO4·3H2O等9 种成分用量为因素,选用N为9的PB试验设计。根据预试验,设定每个因素的高水平为低水平的2 倍,进行12 次试验,以4-羟基异亮氨酸产量作为响应值,结果如表5所示。
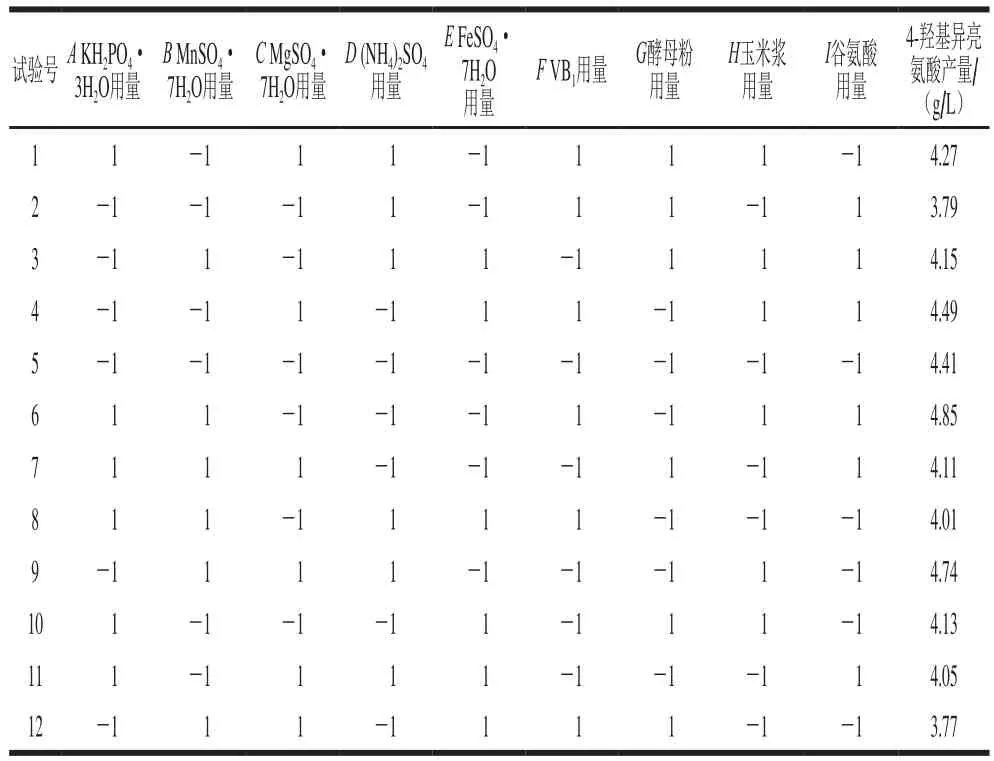
表5 PB试验设计及响应值Table 5 PB design with response
利用Design Experts V8.0.6分析软件对表5中的数据进行分析,获得各因素的偏回归系数及其显著性。如表6所示,9 个因素对应响应值影响的显著性顺序为玉米浆>谷氨酸>FeSO4·7H2O>MgSO4·7H2O>酵母粉>KH2PO4·3H2O>VB1>(NH4)2SO4>MnSO4·7H2O,FeSO4·7H2O、玉米浆与谷氨酸用量3 个因素对4-羟基异亮氨酸的产量影响极显著(P<0.01)。由其效应值可知,FeSO4·7H2O和谷氨酸用量为负效应,说明其在高水平时不利于4-羟基异亮氨酸的合成;而玉米浆为正效应,说明其在高水平时有利于4-羟基异亮氨酸的合成。因此,在后续实验中,在FeSO4·7H2O和谷氨酸高水平基础上减少其用量,在玉米浆低水平基础上增加其用量。对于其他不具显著影响的因素,正效应因素取1水平,负效应因素取-1水平。
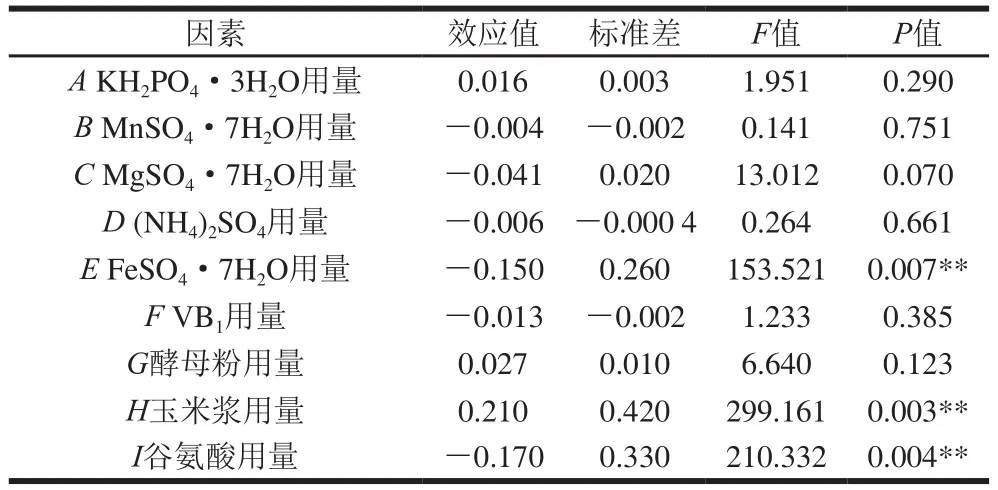
表6 PB试验设计各因素的回归系数及其显著性Table 6 PB design factors regression coefficients and significance test
2.6 最陡爬坡试验结果
根据因素玉米浆、谷氨酸和FeSO4·7H2O用量效应的大小确定最陡爬坡试验相应变化的方向及步长,设计最陡爬坡试验。如表7所示,从第1组到第3组4-羟基异亮氨酸产量逐渐提高,而从第4组后下降,即第3组为最陡爬坡的拐点。故选择第3组(玉米浆、谷氨酸和FeSO4·7H2O用量分别为35 mL/L、3.0 g/L和0.016 g/L)作为下一步响应面试验因素水平的中心点。
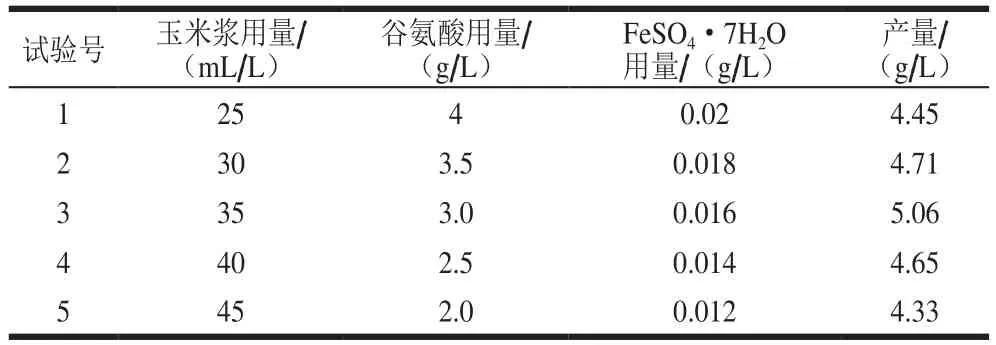
表7 最陡爬坡试验设计及结果Table 7 Design and result of the steepest ascent tests
2.7 Box-Behnken响应面试验结果
Box-Behnken试验结果如表8所示。利用软件Design Experts V8.0.6,对表8的数据进行多元回归分析,得到回归方程为:
Y=5.49+0.12A+0.082B+0.025C+0.068AB-0.037AC+0.018BC-0.37A2-0.14B2-0.03C2
回归方程的方差分析结果如表9所示,模型的P值为0.005,说明模型的差异性极显著;相关系数R2为0.961 5,表明该模型能够解释96.15%的响应值变化,校正相关系数R2Adj为0.892 1,即仅有变异6.94%不能由该模型来解释,说明模型与试验拟合良好;变异系数为1.5%,证明试验结果可信度高;失拟项P为0.418(>0.05),表明该模型失拟不显著。在模型中,A和A2对4-羟基异亮氨酸影响极显著,B和B2对4-羟基异亮氨酸影响显著,其余因素对4-羟基异亮氨酸影响不显著。
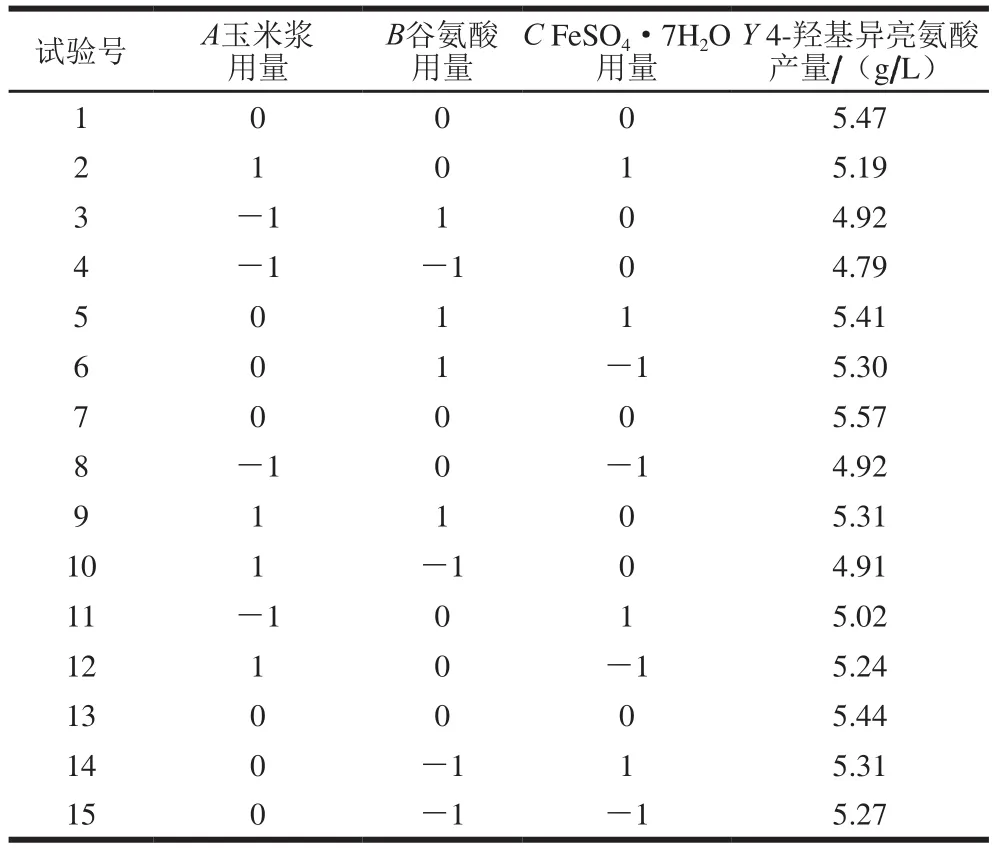
表8 Box-Behnken试验设计及结果Table 8 Box-Behnken design with results
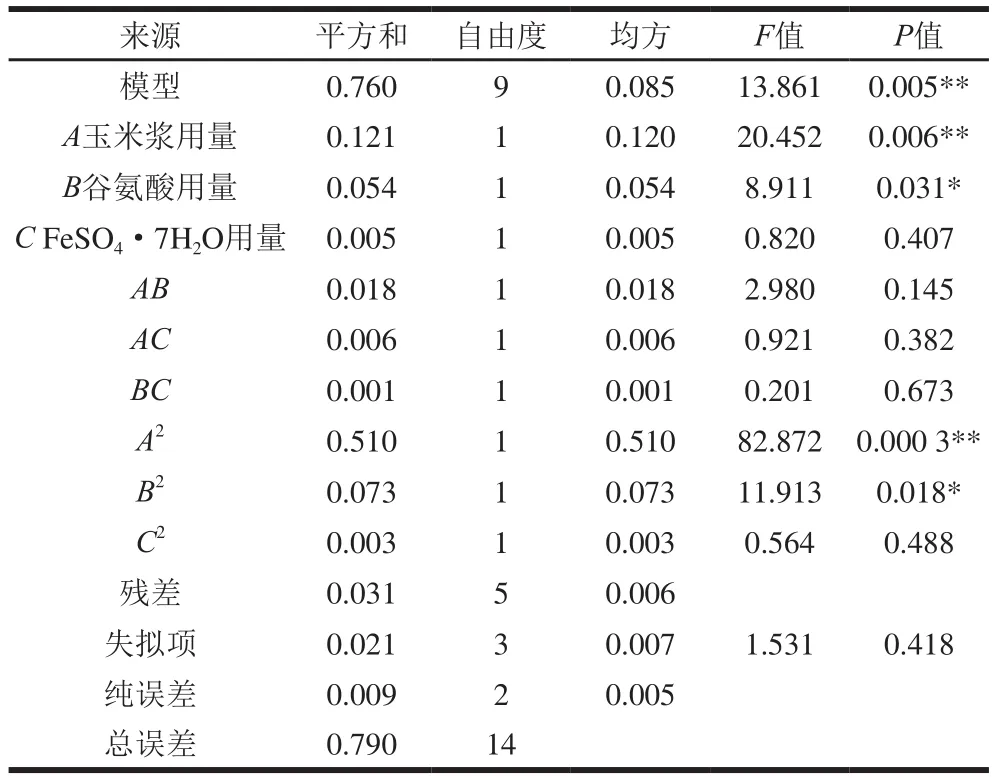
表9 回归模型的方差分析Table 9 Analysis of variance of regression model
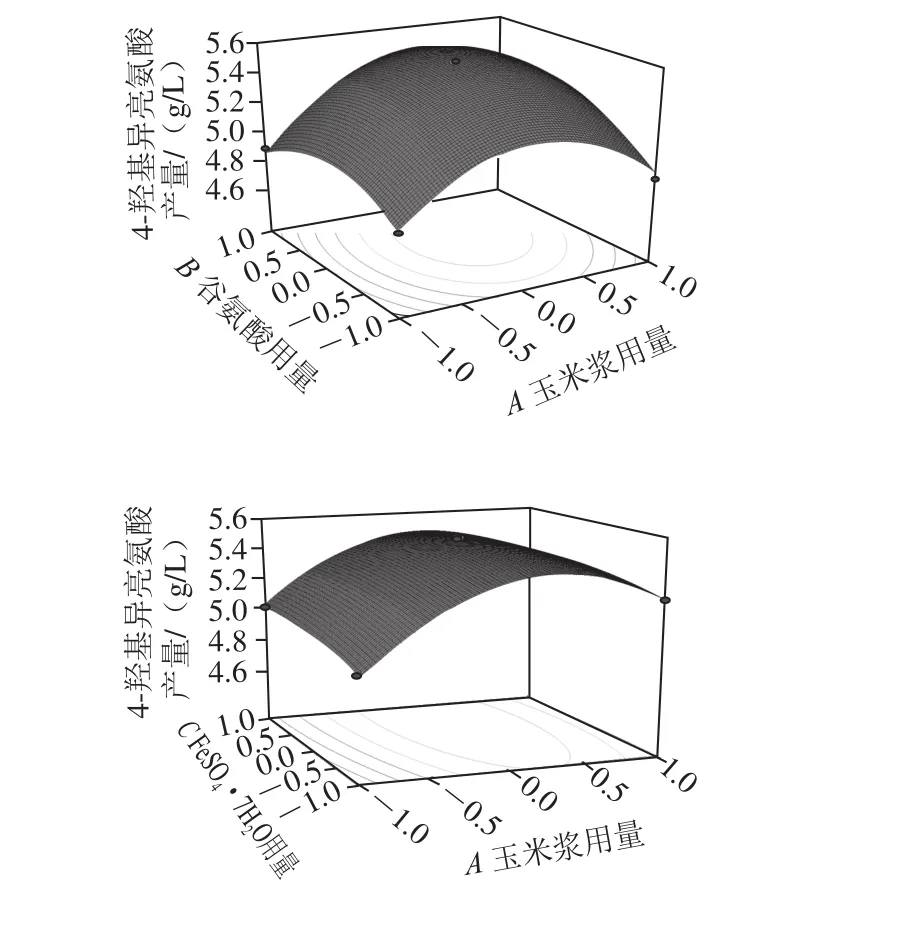
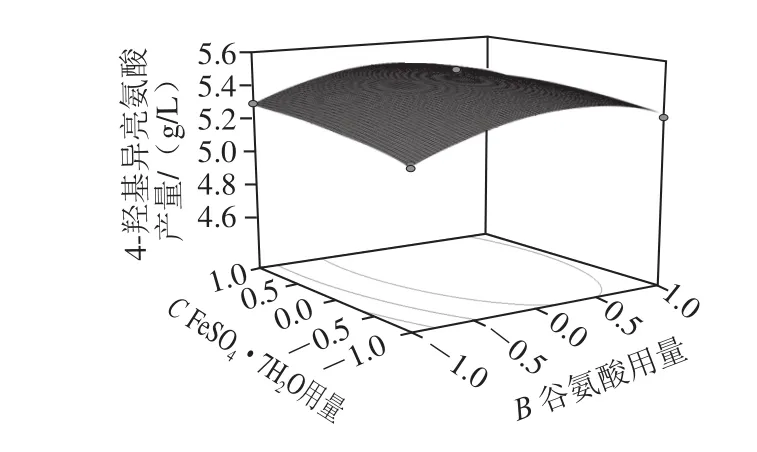
图5 各因素交互影响4-羟基异亮氨酸产量的响应面和等高线图Fig. 5 Response surface and contour plots for 4-hydroxyisoleucine production influenced by interaction among corn syrup, glutamic acid and FeSO4·7H2O
由图5可知,FeSO4·7H2O的含量一定时,随着培养基中玉米浆和谷氨酸用量的增加,4-羟基异亮氨酸产量先增加后降低,在玉米浆和谷氨酸用量分别为34.1 mL/L和2.98 g/L时达到最大值5.57 g/L。当谷氨酸用量一定时,玉米浆和FeSO4·7H2O用量之间的交互作用并不显著;而当玉米浆用量一定时,谷氨酸和FeSO4·7H2O用量之间的交互作用依然不显著。通过Design Experts V8.0.6分析软件,得到的优化结果为玉米浆34.1 mL/L、谷氨酸2.98 g/L、FeSO4·7H2O 0.016 7 g/L,4-羟基异亮氨酸的理论值为5.57 g/L。
2.8 优化培养基效果验证
利用上述优化后的培养基进行摇瓶发酵实验,以验证模型的有效性。结果表明,在最佳培养基条件下,经48 h摇瓶发酵,4-羟基异亮氨酸产量达到5.53 g/L,与理论值5.57 g/L接近,说明该模型能很好地预测4-羟基异亮氨酸产量,证明了模型的有效性。利用优化后的培养基使得HIL017的4-羟基异亮氨酸产量较优化前提高19.7%。
3 结 论
构建了ido组成型表达质粒pXM01-ido及菌株HIL017,其4-羟基异亮氨酸产量较ido诱导型过表达菌株HIL016高19.4%,生物量和单位菌体产量也显著提高,表明ido组成型过表达效果更佳。通过PB试验确定了HIL017发酵培养基中玉米浆、谷氨酸和FeSO4·7H2O用量为主要影响因素,利用最陡爬坡试验确定这3 种因素的中心值分别为35 mL/L、3.0 g/L和 0.016 g/L。响应面法确定的最优用量为玉米浆34.1 mL/L、谷氨酸2.98 g/L、FeSO4·7H2O 0.016 7 g/L,此时4-羟基异亮氨酸理论产量为5.57 g/L。验证实验结果表明,所建模型能很好地预测4-羟基异亮氨酸产量,最佳条件下为5.53 g/L,较优化前提高19.7%。
