氩氦刀冷冻消融联合经导管肝动脉化疗栓塞治疗肝细胞癌
2019-07-26许家健邓婉芳曾维斌邢世江
李 新,许家健,邓婉芳,曾维斌,邢世江
(南方医科大学附属小榄医院肿瘤科,广东 中山 528415)
原发性肝细胞癌早期大多缺乏特异性症状和体征,临床上50%以上的病例明确诊断时已失去手术机会。经导管肝动脉化疗栓塞 (transcatherter arterial chemoembolization,TACE)为非外科手术治疗肝细胞癌的首选方法,但单纯TACE治疗肝细胞癌后,肿瘤组织不能达到完全坏死,病灶周围有残留的肿瘤细胞。近年来,TACE联合微创消融技术治疗肝癌得到了临床的重视,并较单纯TACE有较好疗效[1]。氩氦刀冷冻消融逐渐用于多种肿瘤的治疗,也为肝癌的综合治疗提供了新的途径,据文献[2]报道早期肝癌的氩氦刀冷冻消融治疗可以达到手术的效果,氩氦刀冷冻消融联合TACE治疗肝细胞癌可以优势互补,是一种较理想的治疗手段。但目前对于氩氦刀冷冻消融联合TACE与单纯氩氦刀冷冻消融治疗的对比研究报道较少,因此我们就氩氦刀冷冻消融联合TACE治疗肝细胞癌后的近期疗效、1 a生存率及不良反应进行比较研究,现将结果报道如下。
1 资料与方法
1.1 一般资料选择我院2011年3月至2014年12月收治的56例肝细胞癌患者,均行影像学检查及甲胎蛋白(alpha-fetoprotein,AFP)检查,同时行穿刺活检,经病理学检查确诊,结果均符合肝细胞癌病理学诊断标准[3]。2组病例均因肿瘤局部病变、年龄、全身状况等因素不适宜或不愿接受手术治疗,未发现远处转移,预计生存时间3个月以上,血常规、出凝血时间及肾功能检查所有指标正常。56例患者随机分为2组。对照组27例行氩氦刀冷冻消融治疗,其中男22例,女5例;年龄33~68岁,中位年龄57岁;肝功能Child-Pugh分级:A级16例,B级11例;肿瘤病灶最大直径(5.2±1.8)cm;病灶数(3.9±1.0)个;所有病例均伴有乙型肝炎病毒性肝炎后肝硬化。观察组29例行氩氦刀联合TACE治疗,其中男25例,女4例;年龄32~66岁,中位年龄56岁;Child-Pugh分级:A级17例,B级12例;肿瘤病灶最大直径(5.0±2.0)cm;病灶数(3.7±1.0)个,所有病例均伴有乙型肝炎病毒性肝炎后肝硬化。2组患者在性别、年龄、肿瘤病灶大小、病灶数及Child-Pugh分级等基线资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法对照组27例单纯行氩氦刀冷冻消融治疗,观察组29例先行TACE治疗,2~4周后行氩氦刀冷冻消融治疗。
冷冻消融采用以色列伽利略公司的Cryo-Hit低温冷冻消融系统,冷冻消融针为17G,直径为1.47 mm。CT扫描采用荷兰Philips公司Brilliance Big Bore大孔径16排螺旋CT机。TACE治疗采用美国GE公司Innova3100数字减影血管造影(Digital Subtraction Angiography,DSA)系统。
氩氦刀冷冻消融治疗具体方案:根据CT扫描的病灶大小和部位,确定消融针的数量。常规消毒皮肤,采用质量分数2%利多卡因行局部麻醉,在CT引导下将冷冻消融针头精确刺入肝肿瘤部位,根据肿瘤大小采用多针重叠冷冻。连接冷冻消融系统,先启动氩气快速降温至-160~-140 ℃,冷冻10~15 min,然后启动氦气复温至20 ℃ 2 min,再次重复冷冻消融1次,再次复温到20 ℃,然后拔出消融针。冷冻过程中每间隔5 min进行1次CT扫描,观察冰球形成情况及邻近组织的影响,根据冰球覆盖病灶的范围,必要时调整消融针的角度和深度,使冰球覆盖整个肿瘤,且超过肿瘤外缘l cm为宜。同时避免重要结构的冷冻损伤,冷冻完成后即刻CT扫描观察冷冻结果及对周围结构的影响。
TACE治疗具体方案:采用Seldinger法选择经皮右侧股动脉穿刺,利用短导丝置入导管鞘,然后在DSA下进行插管操作。将导管选择性插入肿瘤供血动脉,再将导管超选择插入靶动脉,行灌注化疗。根据肿瘤大小、供血情况注入化疗药物(表阿霉素40~60 mg,丝裂霉素10 mg,氟尿嘧啶750~1 000 mg或顺铂40~80 mg)和碘化油5~20 mL的混合物,必要时加用明胶海绵颗粒栓塞。治疗结束后,拔管、穿刺部位压迫止血,穿刺侧肢体制动12 h,平卧24 h,以防止穿刺部位出血。
1.3 观察及随访1)AFP:治疗前,治疗后1个月、6个月、1 a复查;2)增强CT:治疗后1个月复查,以后每3个月复查1次;3)随访:每个月随访1次,随访时间1 a。统计患者治疗后1 a生存率。
1.4 疗效评价参考RECIST 1.1标准[4]评价近期疗效,完全缓解 (CR):所有目标病灶消失、无新病灶出现,并维持4周;部分缓解(PR):基线病灶的长径总和缩小30%,并维持4周;稳定(SD):基线病灶总和有缩小,但未达到PR,或有增加,但未达到PD;进展(PD):基线病灶的长径总和增加20%,或出现新病灶。以CR+PR计算有效率。
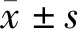
2 结果
2.1 2组治疗前后AFP水平比较治疗前,2组患者AFP水平比较差异无统计学意义(P>0.05)。2组治疗后AFP水平均显著低于治疗前,差异均有统计学意义(P均<0.05)。治疗后,观察组患者AFP水平显著低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 2组治疗前后AFP水平比较 μg·L-1
注:与同期对照组比较,1)P<0.05;与同组治疗前比较,2)P<0.05
2.2 2组近期疗效比较观察组有效率(69.0%)明显高于对照组(40.7%),差异有统计学意义(P<0.05)。见表2。
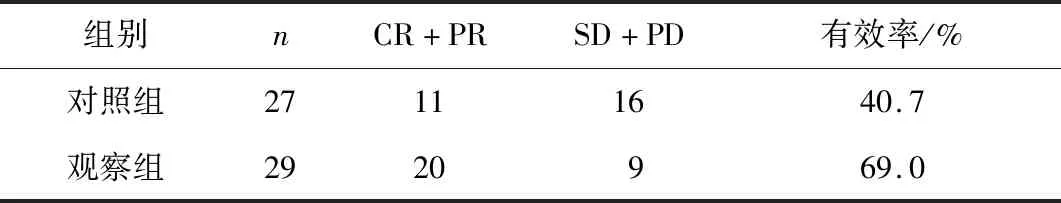
表2 2组近期疗效比较
注:2组有效率比较,P<0.05
2.3 2组1 a生存率比较观察组1 a生存率(79.3%)明显高于对照组(51.9%),差异有统计学意义(P<0.05)。
2.4 2组不良反应比较不良反应包括上腹痛及发热,部分患者有一过性转氨酶升高。对照组有1例出现了大量的血性胸腔积液,给予胸腔穿刺引流,10 d后胸腔积液完全吸收,该患者同时出现了Ⅳ度血小板减少,给予输浓缩血小板及白介素-11治疗,14 d后恢复正常。2组不良反应比较差异无统计学意义(P>0.05),均可以耐受。
3 讨论
大多数临床确诊的肝癌患者已属晚期,失去了手术根治性切除的机会。对于无法手术的患者,如何提高其治疗效果,是目前亟待解决的问题。TACE是临床上治疗中晚期肝癌最常用的方法之一,其通过局部化疗药物的灌注治疗和阻塞肿瘤供血动脉双重作用,杀死靶区内的肿瘤细胞,发挥抗肿瘤效果[5]。但TACE治疗并不能使肝癌病灶完全坏死,经常仍有残留的肿瘤细胞,其原因可能与肿瘤复杂的血供有关,如供侧支循环的建立等使动脉不能完全栓塞,影响栓塞术的治疗效果。文献[6]报道单纯TACE治疗原发性肝癌病灶坏死率仅20%,1 a生存率仅为40%~50%。故TACE治疗后,如何选择其他的局部治疗方法,如射频消融及氩氦刀冷冻消融等,以进一步杀灭残存肿瘤细胞,已成为国内外临床研究的热点。有随访资料表明,氩氦刀冷冻手术后的生存率与肝切除的生存率相当[7]。
由于氩氦刀冷冻消融是一种肿瘤的局部治疗方式,消融范围有限,不能彻底消融位于病灶周围的难以检测到的亚临床病灶,而TACE则能解决这一问题[8]。本组资料显示,氩氦刀冷冻消融结合TACE治疗肝细胞癌的有效率优于单纯氩氦刀冷冻消融。我们认为,氩氦刀冷冻消融联合TACE治疗肝细胞癌可以优势互补,是治疗中晚期肝细胞癌的有效手段。
研究[9-12]发现,AFP水平不仅与病灶退缩有明显的相关性,而且还显示其具有预后评估价值。本文结果表明,与单纯氩氦刀冷冻消融相比,氩氦刀冷冻消融联合TACE的治疗效果更好,这与AFP的下降有显著相关性,这与国内文献[13]报道相一致。本组资料还表明,氩氦刀冷冻消融联合TACE治疗1 a生存率明显优于单纯氩氦刀冷冻消融。其原因可能有:1)TACE发现了治疗前未发现的小病灶并进行了栓塞,避免了氩氦刀冷冻消融时遗漏部分微小病灶;2)TACE减少了肿瘤的血供,冷冻时肿瘤局部温度迅速达到靶温度,防止周围温度较低而导致消融不足;3)氩氦刀冷冻消融可以使TACE治疗后周围残留的病灶进一步坏死,使2种方法的治疗效果相互叠加。
关于氩氦刀冷冻消融与TACE治疗的先后顺序,目前尚有争议。多数学者认为TACE后给予氩氦刀冷冻消融治疗效果较好[14],我们认为对于血供丰富的肿瘤先行TACE治疗,但对于少血供的肿瘤可先行氩氦刀冷冻消融治疗,再根据情况行TACE。
总之,氩氦刀冷冻消融联合TACE是肝细胞癌的一种疗效肯定、安全可靠的治疗方法,是无法手术切除患者的理想选择,这也为中晚期肝癌患者提供了一个新的治疗思路。
