白刺链霉菌(Streptomyces albospinus)CT205次生代谢产生活性物质的分离纯化及结构鉴定
2019-07-25孙敏王小姣丁宇涵王世梅李建杰
孙敏 王小姣 丁宇涵 王世梅 李建杰
(1 南京农业大学资源与环境科学学院/江苏省固体有机废弃物资源化高技术研究重点实验室,南京 210095;2 英国谢菲尔德大学,谢菲尔德S3 7HF)
放线菌类群中的链霉菌属(Streptomyces)是一类重要的微生物资源,其次生代谢产物繁复多变,产生的抗生素在植病生物防治方面具有重要作用[1]。放线菌产生的农用抗生素因其易降解、不易使有害生物产生抗药性等特点已成为无公害农药的主体和未来农药的发展方向[2]。白刺链霉菌(Streptomyces albospinus)CT205是本实验室保存的一株拮抗放线菌,研究发现该菌株对多种植物病原真菌具有较好的抑制作用,盆栽试验及田间试验表明对黄瓜枯萎病及草莓根腐病有很好的防控效果[3-4]。其发酵上清液的乙酸乙酯萃取液对黄瓜尖孢镰刀菌及啤酒酵母等具有较强的抑制作用,前期对该活性物质的性质亦进行了初步研究[5],为了明确该活性物质的成分,通过硅胶制备薄层板对其进行分离纯化,并通过1H NMR,13C NMR图谱、红外光谱和HPLC-Tof -HRMS鉴定其化学结构,本文报道其分离纯化及结构鉴定的结果。
1 材料与方法
1.1 供试菌株
白刺链霉菌(Streptomyces albospinus)CT205及啤酒酵母(Saccharomyces cerevisiae)实验室分离保存[4]。
1.2 培养基
种子培养基:黄豆粉30.0g,葡萄糖 5.0g,酵母膏5.0g,碳酸钙5.0g,去离子水1000mL,pH7.5。
液体发酵培养基:蔗糖20.0g,可溶性淀粉30.0g,蛋白胨2.0g,黄豆粉8.0g,NaCl 2.0g,MgSO4·7H2O 0.5g,CaCO33.0g,K2HPO4·7H2O 0.5g,去离子水1000mL,pH8.0。
1.3 S.albospinus CT205液体发酵
将S.albospinusCT205在PDA斜面上活化,用接种环取新鲜的CT205斜面孢子2~3环接种于灭菌的种子摇瓶培养基中(250mL三角瓶中装液量50mL),于28℃摇床,170r/min培养48h,镜检菌丝生长旺盛,确认无污染后,以10%接种量接种到发酵摇瓶培养基中(1000mL三角瓶中装液量300mL),28℃摇床发酵96h,得S.albospinusCT205的发酵液。发酵过程中定时取样,观察菌丝体形态,测定发酵液pH值变化,并用牛津杯法测定发酵液粗提物拮抗圈的大小,用以表征活性成分相对含量的变化。拮抗圈大小的测定方法:取发酵液,6000r/min,4℃,离心15min,取上清液,等体积乙酸乙酯萃取,减压浓缩,按50:1的比例获得浓缩液,取200μL加入牛津杯中,以啤酒酵母为指示菌(每皿涂布100μL 108/mL啤酒酵母细胞),测定拮抗圈的大小。
1.4 S.albospinus CT205代谢产生活性物质的提取及纯化
活性物质的提取及检测参照文献[5]上的方法进行。即将发酵液离心,取上清液,等体积乙酸乙酯萃取,收集酯相,减压浓缩,获得粗提物,用甲醇溶解,用毛细管取少量点样在GF254硅胶板,进行薄板层析,层析系统为氯仿:乙酸乙酯:甲醇:甲酸(16:1:2:0.04),展层结束,在紫外光下观察各斑点位置,计算其Rf值,并佐以生物自显影法[6],确认活性成分的位置。
根据上述结果通过制备型硅胶板(10cm×20cm)进行层析分离,割取活性物质对应条带,用甲醇浸泡24h,6000r/min,4℃,离心5min,取上清液,减压浓缩后获得活性成分,再用GF254薄板检测斑点是否单一,如斑点不单一,再重复进行制备型硅胶板层析分离,获得单体化合物。取少量用甲醇稀释,以啤酒酵母为指示菌用牛津杯法检测其抗菌活性。
1.5 活性物质紫外(UV)吸收光谱检测
紫外可见分光光度计(美国Perkin Elmer,Lambda 25)对活性物质进行全波长(190~400nm)紫外扫描,以分析纯甲醇溶液做参比。
1.6 活性物质HPLC-Tof -HR-MS检测
将割板制备的活性物质,先用少量甲醇溶解,然后用甲醇溶液高倍稀释(×1000),纸片法检测抗菌活性仍有较大抑菌圈。将样品稀释液过0.22μm的微孔滤膜进行预处理,再送样到分析型HPLC(Waters公司)检测,泵型号1525,紫外检测器型号2487,色谱柱型号Waters 4.6mm×150mm C18反向柱,进样量10μL,流动相:甲醇:水=60:40,并根据样品极性进行调整。在此基础上采用相同流动相,利用高分辨串联质谱TripleTof®5600+MS系统(AB SCIEX公司,TripleTof®00的升级产品)检测。HPLC-Tof -HR-MS检测在南京农业大学理学院中心实验室进行。
1.7 活性物质核磁共振(NMR)波谱检测
1H NMR检测,称取样品及放线酮标准品3~5mg分别溶于0.5mL CD3OD中。13C NMR检测,称取样品及其标准品各30~35mg溶于0.5mL CD3OD中,检测。采用德国Bruker UltraShiedTM400 Plus核磁共振波谱仪检测(TMS为内标)。
1.8 活性物质红外光谱(FTIR)检测
采用傅里叶变换红外光谱分析仪(FTIR)对活性物质进行红外光谱(FTIR)分析。将甲醇溶解的样品在红外光谱仪上进行检测。
2 结果与分析
2.1 S.albospinus CT205液体发酵
S.albospinusCT205在种子摇瓶培养48h后,接种发酵摇瓶,定期取样观察菌丝生长情况,结果见图1。在油镜(10×100)下观察菌丝形态变化,CT205在培养24h后菌丝快速生长,48~72h菌丝生长进入对数期,呈网状分布,72~96h菌丝生长进入稳定期。
发酵过程中取样测定发酵液pH值的变化及发酵液中活性物质抑菌圈的大小,结果如图2所示。接种后发酵起始pH=6.89,随着发酵时间的延长,pH值呈下降趋势,24h时pH=6.56,较起始阶段下降0.33个单位,72h时pH降至6.41,96h后的pH=6.12,较起始降低0.88个单位。发酵液中活性物质的含量,则随着发酵时间的延长逐渐增加,发酵48h抑菌圈直径58.5mm,72h时抑菌圈68.2mm,96h时抑菌圈达到72.7mm。
2.2 活性物质的提取及纯化
S.albospinusCT205摇瓶发酵96h后,离心取上清,用乙酸乙酯萃取,离心取酯相,减压浓缩得浓缩液,用甲醇溶解。选用GF254硅胶板展层,经紫外观察及生物检测Rf=0.68的组分具有抗菌活性。在制备型硅胶板上多次层析分离,割取有活性的条带,用甲醇浸泡24h,浓缩回收样品,TLC纯度验证,最终获得纯化的化合物。
2.3 活性物质的紫外吸收光谱

图1 S.albospinusCT205发酵过程中菌丝形态变化(10×100)Fig.1 Change of mycelia morphology during the fermentation of S.albospinus CT205(10×100)

图2 S.albospinus CT205发酵液pH及活性物质相对含量变化Fig.2 Changes of pH and relative content of active substance in S.albospinus CT205 fermentation broth
前期研究发现该活性物质对热和紫外线均表现出较强的稳定性[5],经查阅文献发现,耐热、耐紫外辐射且抗真菌的抗生素种类并不多,放线酮(actidione)具有与此相似的特性[7]。将待测活性物质与放线酮标准品分别进行紫外扫描,结果如图3所示,两者的紫外吸收光谱相似,最大吸收峰均在λ=215nm处。
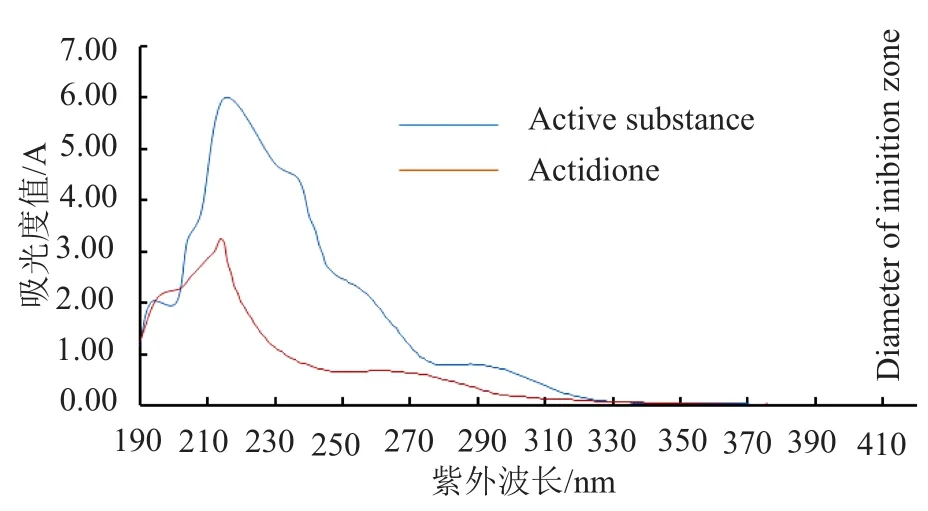
图3 活性物质和放线酮的紫外吸光谱图Fig.3 Ultraviolet absorption spectra of active substance and actidione
2.4 活性物质的HPLC-Tof -HR-MS检测
对活性成分进行HPLC-Tof -HR-MS检测,其一级质谱图(图4)的质荷比(m/z)为282.1701,二级质谱图(图5)的分子离子峰的m/z为282.1692,离子提取流图(XIC)(图6)分析发现该活性成分在正离子峰模式下的分子离子峰为[M+H]+=282.2,可以确定其分子量为282.2,其与放线酮标准品的分子量(282.2)及一级质谱图、二级质谱图一致(限于篇幅放线菌酮标准品二级质谱图未列出)。

图4 活性物质及放线酮一级质谱图Fig.4 Primary mass spectrograms of active substance and actidione

图5 活性物质二级质谱图Fig.5 Secondary mass spectrogram of active substance

图6 离子提取流图Fig.6 Extracted ion chromatogram
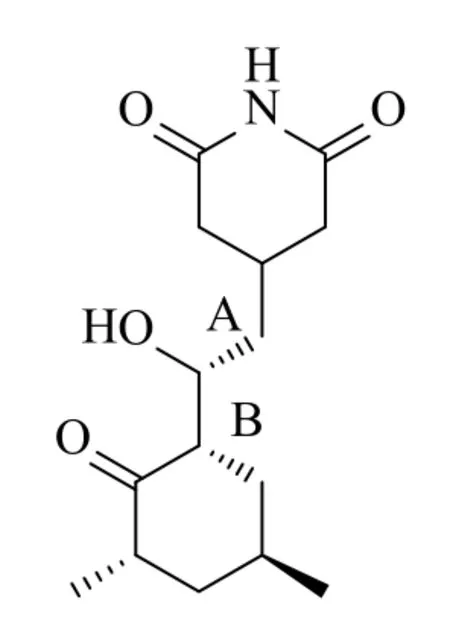
图7 放线酮结构式Fig.7 Structure of actidione
根据活性成分二级质谱图,结合放线酮的结构式(图7)及其断键的位置可以看出当A、B两处的化学键同时断裂时,可以得到链状结构-C(OH)-CH2-C(O)-CH2(CH2)-CH2-CH(CH3)-CH2-和六元环结构NH(CO)2(CH2)2C-CH2-,并且该断裂结构所对应的m/z分别为157和119。由此可以得到部分的质谱裂解图:从m/z=282到m/z=265,失去m/z=17的碎片,此碎片为叔碳所连接的羟基结构的分子量,从m/z=282到m/z=157,失去m/z=124的碎片,此碎片为叔碳所连接的羟基及其仲碳连接的羰基的六元环同时被打碎,所剩下的肽键所连接的六元环状结构的分子量。根据分子离子峰(m/z=282.2):质谱图的主要裂解碎片解释如图8所示。从XIC中(图6)可以看出该活性成分的保留时间(tR=4.953min)与放线酮的保留时间(tR=4.951min)一致,经图谱比对可以确定在tR=4.953min处的化合物成分即是放线酮,又称环己酰亚胺(cycloheximide)其分子式为C15H23NO4。
2.5 活性物质的核磁共振波谱
根据HPLC-Tof -HR-MS的检测结果得出该活性物质为放线酮,分子式C15H23NO4。根据已知分子式对该活性物质及其放线酮标准品进行NMR波谱检测。对样品的1H NMR谱、13C NMR谱结果进行分析,可以得出:1H NMR(400MHz,Methanol-d4)δH:4.02(q,J=5.9Hz,1H),3.31(p,J=1.7Hz,1H),2.79~2.51(m,4H),2.42~2.30(m,3H),2.22~2.13(m,1H),2.12~2.01(m,1H),1.98~1.86(m,1H),1.75(td,J=13.2,4.8Hz,1H),1.59(td,J=13.0Hz,4.7Hz,1H),1.50~1.41(m,2H),1.27(d,J=7.1Hz,3H),0.95(d,J=6.4Hz,3H);13C NMR(100MHz,Methanol-d4)δC:214.8,174.3,174.2,66.2,50.8,42.7,40.3,39.8,38.0,36.5,35.2,27.6,27.0,17.2,13.4。同时将活性物质的1H NMR谱、13C NMR谱检测结果与放线酮的1H NMR谱、13C NMR谱检测结果进行比对,谱图数据相一致,故确认该活性物质为放线酮。
2.6 活性物质的红外光谱

图8 活性物质质谱离子碎片裂解图Fig.8 Ion fragmentation diagram of active substance by mass spectrometry
活性物质含有不同的结构和原子组成的功能基团,从红外光谱可以获得该物质的结构信息,活性物质在3000~3600cm-1处具有吸收峰,可以判定该物质为有机物,根据(表1,图9)物质的FTIR特征吸收峰及归属,可以看出,该活性物质在3297cm-1处有一个-N-H伸缩振动峰,放线酮在3300处有一个同样的-N-H伸缩振动峰,判定该活性物质为存在-NH酰胺类有机化合物。2943cm-1是-N-H的对称和反对称伸缩振动吸收峰,2833cm-1是-C-H伸缩振动吸收峰,1451cm-1是-C-H弯曲振动吸收峰,1411cm-1是-C-N伸缩振动吸收峰,1111和1022cm-1是碳水化合物的-C=O的伸缩振动吸收峰,598cm-1是-OH面内弯曲振动吸收峰[8-9]。综上所述,该活性物质为含有-NH2、-OH等多种官能团的胺类化合物。同时与放线酮标准品的红外光谱比对分析得出该活性物质与放线酮的红外光谱在不同频率下产生的官能团伸缩振动吸收峰的响应值的位置范围(表1)相一致。进而判断该活性物质与放线酮为同一物质,即该活性物质为环己酰亚胺,详情如表1。
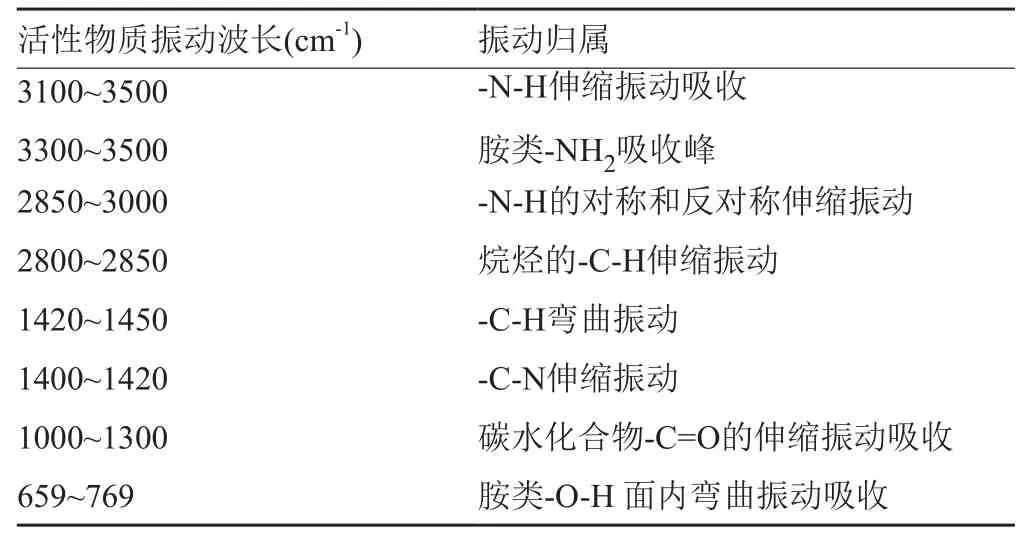
表1 活性物质FTIR特征吸收峰及归属Tab.1 The characteristic absorption peaks and attribution of active substance FTIR
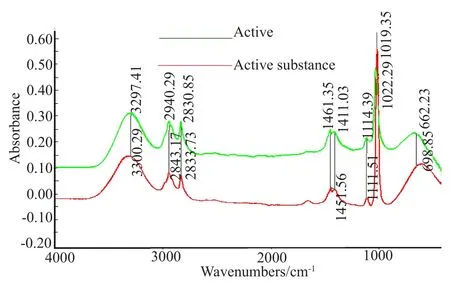
图9 活性物质与放线酮红外光谱比对Fig.9 Infrared spectra of active substance and actidione
3 讨论
S.albospinusCT205代谢所产生的活性物质经有机溶剂萃取,薄板层析、生物检测及生物显影检测,确定了其Rf值,并用制备型硅胶板分离获得小批量物质。前期研究发现该活性成分对热和紫外线均表现出较强的稳定性,查阅《抗菌素生物理化特征》[7],发现放线酮具有类似特性。将活性成分进行紫外扫描,发现其在215nm处具有最大吸收峰,吸收光谱图与放线酮相似。对该活性成分进行了HPLCTof -HR-MS检测,从一级质谱图、二级质谱图检测的结果确定该物质的分子量为282.2,XIC图显示在tR=4.953min处有最大吸收峰值。与HPLC-Tof -HRMS检测的放线酮标准品图谱比对,发现待测物质与放线酮的一级质谱、二级质谱及XIC图谱的结果一致,确定其分子量和放线酮标准品相同。经红外光谱检测,碳谱氢谱数据分析,得到该物质的分子式,功能基团和基本骨架结构,并且通过与放线酮标准品的红外光谱,1H NMR谱,13C NMR谱图进行比对分析,佐证了该活性物质就是放线酮,其分子式为C15H23NO4,又称环己酰亚胺(cycloheximide)。
早在1948年德国化学家Ford和Leach从灰色链霉菌(S.griseus)中分离鉴定出放线酮,发现其对酵母菌拮抗作用强,对细菌无作用或拮抗作用较小[10]。蔡润生等[11]研究报道金色链霉菌(S.saureus)除代谢产生制霉菌素外,还产生另外一种抗生素—放线酮,具有较强的抗病原真菌能力。放线酮是广谱抗生素,在防治农作物真菌病害上应用广泛,如用于防治烟草黑胫病、烟草赤星病、小麦锈病、茶叶立枯病和玫瑰霉病等[12]。闫贵龙等[13]曾研究用放线酮防控青贮玉米霉变,效果良好,同时放线酮也是鼠类的忌避剂[14]。
放线酮能够特异性地抑制新蛋白质的合成,因此常作为蛋白质合成过程的有效抑制剂,应用于蛋白的表达、细胞凋亡机制等代谢调控方面的研究,在医学及分子生物学上有广泛的用途[15-18],如谭晓华等[15]的试验结果表明1.0~2.0μg/mL的放线酮能拮抗儿茶素诱导的大肠癌细胞株的凋亡;王小辉[19]报道放线酮可以有选择性的诱导人原单核白血病细胞系U937细胞凋亡。放线酮虽然是一个古老的抗生素,但仍然有许多新功能有待挖掘。
致谢:感谢南京农业大学理学院实验中心徐江艳老师在HPLC-Tof -HR-MS检测上给予的帮助。
