耐药细菌的适应性代价及补偿性进化
2019-07-25杨焰游雪甫李聪然
杨焰 游雪甫 李聪然
(中国医学科学院北京协和医学院医药生物技术研究所药理研究室,抗感染药物研究北京市重点实验室,北京 100050)
抗生素的过度使用对细菌施加了强烈的选择压力,促进了抗生素耐药菌株的进化和传播,导致耐药危机的产生。当前,解决这一危机的两个主要策略是限制抗生素的使用和开发新型抗菌药物[3]。限制抗生素的使用被认为不仅可以降低抗生素的使用量,也有利于消除耐药菌,隐含其中的机制是获得耐药性降低了耐药菌的适应性[4],即产生了适应性代价(fitness cost),使得耐药菌在抗生素选择压力消失时难以与敏感菌竞争,从而很快从群体中被清除。耐药性的适应性代价能够影响耐药菌的种群动态,包括耐药菌出现的速率、抗生素存在下耐药菌的稳定数量以及选择压力移除后耐药菌的消失速率,因此适应性代价有助于预测耐药性的进化轨迹[5],进而指导抗生素在医药和农业领域的合理使用;适应性代价还有助于设计具有新型作用机制的抗菌药物,例如开发可以与抗生素联合使用以抑制耐药性进化、降低细菌适应性的辅助药物来增加目前使用的抗生素的敏感性,从而延长当前抗生素的使用寿命[6]。总之,从限制抗生素的使用和开发新型抗菌药物两个方面来讲,耐药性的适应性代价对控制耐药危机都具有重要的意义。
然而,耐药菌可通过进化进一步积累其他特定突变来改善适应性代价,这种能使其适应性上升的突变称为“补偿性进化(compensatory evolution)”[7],补偿性进化通过各种不同的机制回复耐药菌的适应性代价,导致耐药菌的转移速率、毒力、生存能力的增强,这使得利用适应性代价逆转耐药性的愿景变得似乎十分困难。适应性代价和补偿性突变是细菌耐药性进化的重要环节,本文综述了细菌病原体抗生素耐药性的适应性代价产生的原因、研究方法、研究进展及补偿性进化的机制,并讨论了适应性代价研究中存在的问题及展望。
1 适应性代价产生的原因
细菌耐药的遗传机制主要包括3种[8]:一是染色体介导的耐药性,是指细菌本身固有的耐药性或者通过染色体突变产生的耐药性;二是转座子介导的耐药性,转座子是基因组中可以从一个位点向另一个位点移动的一段DNA序列,转座时可以携带外来的耐药基因,从而赋予微生物对抗生素药物的耐药性;三是质粒介导的耐药性,质粒是一种独立存在的、可自身复制的染色体外的基因成分,通过接合或转导作用在不同细菌之间转移,从而赋予细菌耐药性。细菌在面对抗生素选择压力时,可以通过以上变异机制获得耐药性,而当抗生素压力解除时,由于这些突变改变了其体内在生理生化中起关键作用酶的结构,某些耐药机制会成为菌株的额外负担,从而产生适应性代价,表现为在没有抗生素存在时,与野生型菌株相比,耐药性突变株生存能力、转移速率和毒力的降低[9]。如果某一耐药机制的适应性代价很大,在不存在抗生素压力的情况下,耐药菌株将无法与野生型菌株竞争,从而很快从群体中被清除。因此,对特定菌株的特定耐药机制进行适应性代价评估,有助于更加全面的理解细菌病原体抗生素耐药性的进化轨迹。
2 适应性代价的研究方法
细菌的适应性代价主要通过两种方法来衡量,一种是在流行病学数据的基础上,通过数学模型拟合抗生素的使用量与耐药菌株频率变化的函数关系。Austin等[10]采用种群遗传学方法结合流行病学数据,分析了施加抗生素选择压力对耐药性的影响,以及抗生素使用量与耐药菌株频率的关系,发现β-内酰胺类和青霉素耐药适应性成本很低,随着β-内酰胺类和青霉素使用量的增加,耐药菌的产生频率增加,但二次感染的能力降低;Whittles等[11]建立了一个数学模型,模拟了英格兰头孢克肟敏感菌和耐药菌的发展史和传播方式,并拟合了2008—2015年间Gonorrhoea感染的诊断和处方数据,认为适应性代价是2012年后耐药菌检出频率降低的主要原因;Salvatore等[12]建立了一个以家庭为单位的病例对照研究,从流行病学的角度评价了耐药菌的适应性。数学模型能够在现有数据的基础上预测细菌的适应性代价,客观地反映抗生素与耐药性的关系,量化维持和发展耐药性的作用力。但是,数学模型的参数不能将所有的影响因素纳入计算,应用函数拟合只是大体上的估计,存在统计偏差。
适应性代价衡量的另一种方法是实验性方法,有部分文献是在相同的培养条件下,分别测量突变型菌株和野生型菌株的生长速度,通过比较生长速度的差别来评价适应性(图1a)。而在大量文献中被广泛使用的方法是竞争性实验,该方法被认为是衡量适应性的“黄金标准”,其原理是将耐药突变菌株与缺乏该突变的野生型菌株共培养时,适应性高的菌株计数将超过适应性较差的菌株,通过监测野生型菌株和耐药菌株随时间推移相对菌计数的变化来衡量适应性。竞争实验包括体外实验(图1b)和体内实验(图1c),体外实验通常在标准培养基中进行,体内实验在实验动物中进行。为了便于区分突变型与野生型,通过用lac Z+/lac Z-或者cfp/yfp荧光蛋白基因进行菌株标记。实验过程中,在无抗生素的条件下将突变型和野生型菌株按照1:1的比例混合培养,进行连续传代培养,监测一定时间内(通常为24h)突变型和野生型菌株的数量,通过相对菌计数比例的变化来推断突变型的适应性,如果突变菌株具有适应性代价,则其比例将降低,适应性通常用选择系数(s)来表示,选择系数的计算主要有如下两种方法。
Lenski等[14]提出的选择系数计算方法如下:
sl=(突变株倍增数/野生株倍增数)-1
Dykhuizen[15]估计选择系数的公式如下:
干旱分区的指标与分区的等级单位有密切关系。一般高等级分区如全国一级干旱分区,以反映影响干旱及其灾害的地带性自然因素为主要依据;低等级分区主要以反映非地带和社会因素的综合作用为主导指标,较常用的是以反映水利条件和农业生产状况为主的社会因素指标来进行划分。

图1 适应性代价的实验性测量[13]Fig.1 Determining fitness of bacterial strains[13]
sd=[ln(n1f/n1i)-ln(n2f/n2i)]/No.of generations
其中,n1f和n1i是指在竞争结束时和开始时突变型菌株的数量,n2f和n2i是指在竞争结束和开始时野生型菌株的数量。
这两种计算方式在文献中都被广泛采用[16-17],但没有严格的标准应该选择哪种方法。Melnyk等[18]认为sl缺少代时这一重要的参数,他们采用了一个简单的生长模型评价了这两种方法的联系,认为sl与sd之间存在紧密的线性关系,当竞争实验进行了4代及更多代后,sl是sd的1.7倍。
适应性的测量方法的不同会导致耐药菌株适应性代价的评价结果的差异,随着分子生物学与生物信息学的发展,如今大部分的研究采用分子标记的竞争实验测量细菌的适应性代价,与仅仅以生长速度表征适应性的方法相比,竞争实验能够描述细菌全部生长周期的情况,包括生长速度、细菌的生理变化、毒力和转移率等。然而,竞争性实验并不一定能检测到小的适应性效应,需要与数学模型和计算机预测相结合进行测量;竞争性实验也不能完全的反映细菌获得耐药性后的生理变化,在关注相对菌计数变化的同时还应该关注菌株全面的生理变化,综合考量细菌的适应性代价;另外,具体的宿主环境可以决定不同机制的抗生素耐药适应性成本,体外测量的结果可能无法完全反映临床环境中的情况,还应结合临床研究和流行病学数据来评价细菌的适应性代价。
3 细菌耐药的适应性代价
以“bacterial antibiotic resistance”和“fitness cost”为关键词在PubMed数据库进行检索,共检索到253篇文献,其他文献通过这些文献的参考文献进行回溯式检索。这些研究通过体外、体内实验评价了不同细菌的耐药性适应性代价,本研究将近年来耐药性细菌的适应性代价研究结果进行了总结(表1),对所统计的文献进行简要的分析发现,由于细菌种群的复杂性,适应性代价的测量结果也受到许多因素的影响,如细菌耐药的遗传机制、适应性代价的测量环境、测量范围等。
3.1 适应性代价与耐药遗传机制
细菌耐药性一般通过染色体突变或者携带耐药基因的移动元件介导产生。Vogwill[53]采用Meta分析已发表的关于适应性代价的文献,发现相对于染色体突变介导的耐药性,由质粒介导的耐药性产生的适应性代价更低,可能的原因是染色体突变介导的耐药进化是一种从头进化(de novo evolution),细菌不可能从最初就具有适应性来抵消这些基因突变产生的代价,而耐药性质粒在之前的宿主中就已经经历过一次选择,导致适应性代价的相对降低,这也许可以解释为什么由质粒介导的耐药性更加普遍。该文献还分析发现相同的质粒在不同的宿主中适应性代价不同,说明耐药性质粒的适应性代价与宿主菌的遗传背景有关,这一观点在染色体突变介导的耐药性中也得到证明,例如在Campylobater jejuni中,其gyrA基因C257T位点发生点突变后产生耐药性,Southern等[19]通过体内竞争实验测定不同突变菌的适应性,发现菌株遗传背景不同的菌株适应性代价不同。
3.2 适应性代价随环境的变化而不同
实验发现耐药性的适应性代价随着环境的变化而不同,甚至同一种突变在不同环境中,产生的代价也不同[54],其内在机制目前有几种假说。代谢控制理论(metabolic control theory)[55]认为在不同的环境下,细菌对突变靶酶的活性有不同水平的需求,酶活性的变化将导致细菌突变体的适应性变化。Hall等[39]通过添加核糖体抑制剂间接抑制转录速率从而降低RNA聚合酶的需求,导致铜绿假单胞菌对利福平的耐药性成本降低,证明了该理论。另一种假说认为适应性代价在压力条件下或营养匮乏的环境中增加[24],但最近有研究发现耐药突变菌在营养受到限制的培养基中,相对于野生型菌株适应性更高[25]。适应性代价随环境的变化而变化,体外的竞争实验与体内的竞争实验往往有差异,有的体内外结果甚至完全不同,这提示在适应性代价研究过程中应尽可能模拟细菌生长的真实环境,使体外测量结果与体内测量结果相协调。
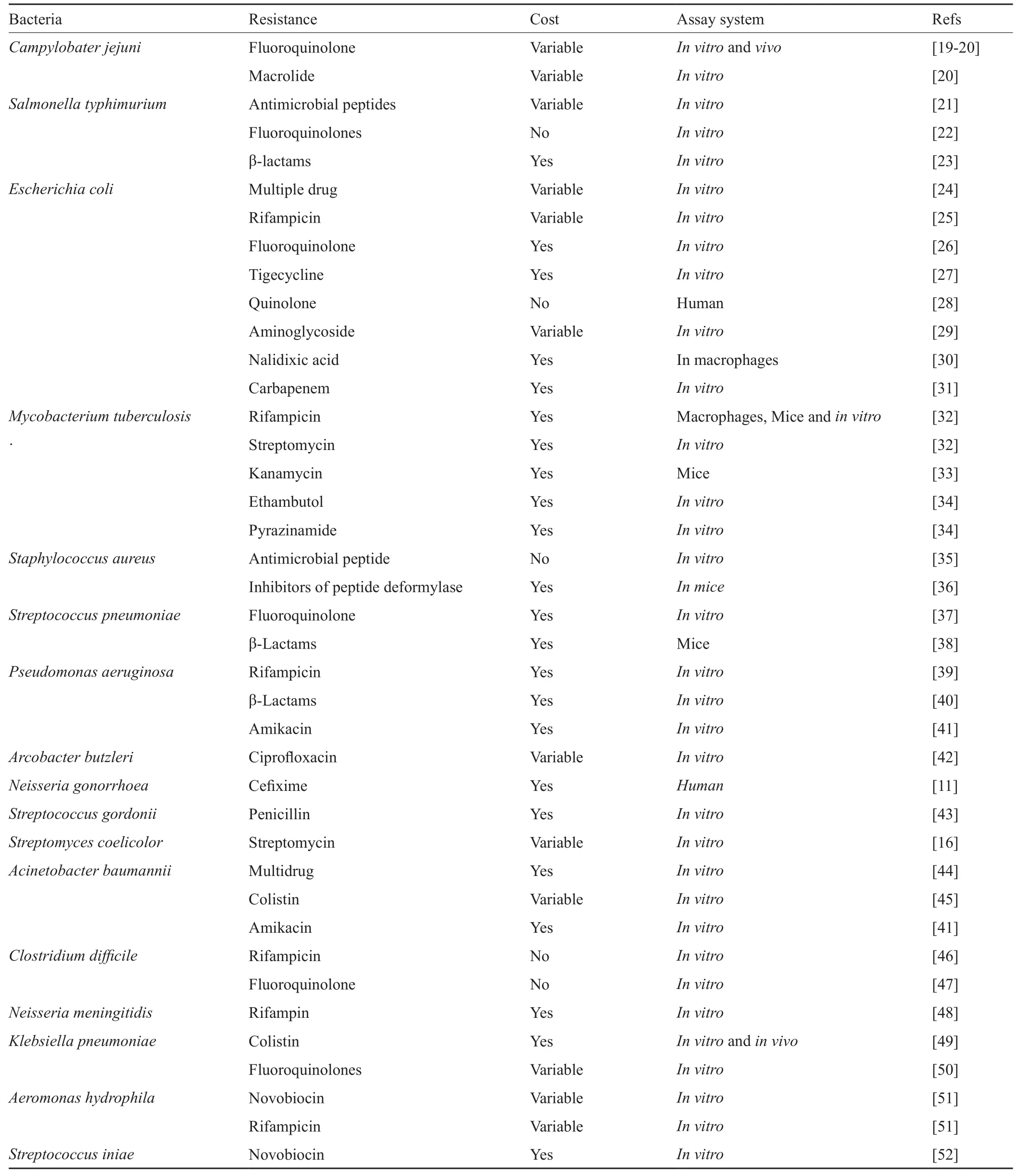
表1 耐药细菌的适应性代价Tab.1 The fitness cost of drug-resistant bacteria
3.3 有些耐药性“没有代价”
抗生素耐药性的适应性代价是决定耐药菌进化成功的关键参数,但在细菌的适应性代价的检测中发现有些耐药性并“没有代价”或者表现出很低的代价,Baker等[22]采用改进后的经典竞争实验方法,检测了伤寒沙门菌(Salmonella typhi)由于gyrA和parC基因突变导致对氟喹诺酮耐药的适应性代价,发现即使在抗生素不存在的情况下,11个耐药菌株中有6个相较于敏感菌株具有显著的适应优势。对于这类没有适应性代价且依然保持高水平耐药性的细菌,应该引起更多的关注,因为这可能是临床上治疗相关耐药菌失败的原因[56]。某些耐药菌的适应性代价“没有成本”,可能的原因是检测手段过于单一,检测的方法或者检测的维度不足,这提示我们应该进行多方面的检测,包括体内外的适应性评价、细菌毒力的检测、转移率的评价等。另外,研究适应性代价的实验方法具有局限性,小的负向和正向效应不易与中性事件区分[57],从而导致某些耐药细菌“没有成本”。
4 补偿性进化
细菌获得耐药性产生适应性代价,使人们认为可以通过减少抗生素的使用降低耐药性细菌的产生频率,从而逆转细菌的耐药性。但适应性代价可以通过补偿进化得到改善[58],在动物模型或培养基中进行连续传代以后发现虽然有些耐药菌的耐药性消失,但大部分耐药菌的耐药性依然保持[59]。补偿性进化被认为是在没有抗生素压力下耐药菌长时间持留的原因[45]。目前,补偿性进化的机制主要包括以下几种:二次突变、异位显性(epistasis)效应、基因重复(gene duplication)和非突变性补偿。
4.1 二次突变
二次位点突变在适应性代价的补偿机制中广泛存在[60],是指细菌在积累某个基因的耐药突变后,在该基因或其他功能相关基因上积累另外的突变,通过调整蛋白或蛋白复合物的空间结构来回补耐药突变导致的功能损伤,包括基因内和基因外的二次补偿突变。最近的研究发现在体外实验中,结核分枝杆菌rpoBS450L突变介导的利福平耐药性的适应性代价,可以通过rpoB基因内的累积突变得到补偿[61]。而在小鼠模型中,有研究发现对链霉素、利福平和萘啶酸耐药的鼠伤寒沙门菌突变株大部分适应性降低,但补偿性进化实验后,由于rpsL基因突变产生的对链霉素耐药的适应性代价通过rpsL基因内突变以及rpsD、rpsE基因外突变得到了补偿,gyrA突变产生的对萘啶酸耐药的适应性代价通过gyrA基因内突变得到了补偿,rpoB突变产生的对利福平耐药的适应性代价通过rpoB基因内突变得到了补偿[4]。大部分的二次突变研究关注于靶标改变引起的耐药性,Knopp等[62]研究了由外膜孔蛋白缺少而导致的耐药性所赋予的适应性是如何得到遗传补偿的,他们发现适应性代价可以通过两种突变机制得到改善,一是phoR和pstS基因的突变导致PhoE孔蛋白的组成性高水平表达;二是hfq和chiX基因的突变破坏Hfq依赖性小RNA调节,导致ChiP孔蛋白的过表达。
4.2 异位显性效应
异位显性原来的含意是指某一基因受不同位点上别的基因抑制而不能表达的现象[63],而在群体遗传学和数量遗传学中指的是非等位基因的遗传效应的非相加性作用。异位显性效应对适应性成本的影响体现在:正向异位显性效应能减少或消除适应性代价,负向异位显性效应能增加适应性代价[64]。异位显性效应在细菌耐药性的进化中发挥着重要的作用[5],在大肠埃希菌中,由拓扑异构酶中突变引起的对氟喹诺酮类药物的耐药性依赖于药物外排系统基因[65];在分枝杆菌中,体外竞争实验揭示了利福平耐药(rpoB基因突变)和喹诺酮类耐药(gyrA基因突变)之间的异位显性效应,发现不同的耐药基因突变组合产生的适应性代价差异显著[66]。异位显性效应是一种常见的现象,在其他的细菌如鼠伤寒沙门菌[67]、铜绿假单胞菌[68]等也被观察到,能够影响细菌耐药性的进化轨迹,对这种相互作用更深入的理解将有助于预测细菌耐药性的发展。
4.3 基因重复
基因重复是一种普遍的生物学过程,它最显著的贡献就是为生物的进化提供了最原始的遗传物质基础,通过突变和选择的作用,重复基因可以增强生物本身的耐药能力例如抗生素耐药性能力,从而改变耐药菌的适应性[69]。Nilsson等[70]构建了对肽去甲酰酶抑制剂具有耐药性的Salmonella enterica突变株,在没有抗生素的情况下,这些耐药性突变赋予细菌适应性代价,通过在没有抗生素的培养基中连续传代,发现fmt/folD基因的突变可以部分改善适应性代价,在外源性补偿的fmt突变体中,大约1/3携带相同的、重复的metZ和metW基因,这些重复基因编码产生高水平的tRNAi,tRNAi水平的升高补偿了甲酰基转移酶活性的缺乏,并允许翻译起始以非甲酰化甲硫氨酰tRNAi进行,因此增加了耐药菌的适应性。虽然基因重复在细菌耐药性的获得和补偿性进化中十分普遍,但是重复基因尤其是小的重复片段,与突变基因相比稳定性低,不易识别和研究[69],基因组测序方法和生物信息学的发展将有助于基因重复的研究。
4.4 非突变性补偿
以上的研究表明,抗生素耐药机制赋予的适应性成本可以通过基因内或基因外第二位点的突变或者重复基因而得到改善,且通常没有耐药性的丧失。而研究得较少的一个潜在的补偿机制是通过调控细菌生理变化来改善适应性代价,由于生理反应非常迅速,因此这种机制难以被确定。Olivares等[71]的研究最早提供了例证,他们发现铜绿假单胞菌通过代谢重新连接(metabolic rewiring)以增加有氧呼吸,使过度表达药物外排泵MexEF-OprN赋予的适应性代价产生的有害作用降低。Freihof er等[72]也发现分枝杆菌通过过表达tlyArRNA甲基化酶,甲基化相邻16S rRNA C1409位点使tlyA表达增加,导致16S rRNA中的点突变(特别是A1408G突变)产生的耐药性所赋予的适应性代价显着降低。Olivares等[73]最近构建了一组独立过表达MexAB-OprM、MexCD-OprJ或MexXY外排泵的铜绿假单胞菌突变株,发现代谢补偿可能是抗生素耐药性铜绿假单胞菌突变株过量表达外排泵适应性代价补偿的通用机制。Zampieri等[74]结合代谢组学方法和基因组测序,建立了一种新的模型,分析了代谢作用对于细菌耐药性进化的影响,证明了抗生素耐药性的条件依赖性补偿机制。关于非突变性补偿机制的研究不断在增加,说明这一机制正在引起人们的重视,关注细菌的生理变化不仅有助于全面认识细菌的进化过程,而且某些可对细菌产生不利影响生理变化可能有助于药物的设计、细菌感染治疗方案和干预策略的制定。
5 结语与展望
适应性代价被认为可以限制耐药性细菌病原体的持留和传播,因此可能成为逆转耐药性的方法之一,但是在没有抗生素的情况下,补偿性进化可使细菌在保持耐药性的情况下适应性代价得到改善。目前,对抗生素耐药性的适应性代价、补偿性进化的研究还存在诸多问题,例如适应性代价和补偿进化是否依赖于抗生素或物种,如果具有依赖性,其内在机制是什么?适应性代价的大小是否与给定突变赋予的耐药性水平存在相关性?体外测量结果如何与体内测量结果相协调?实验性测量结果如何与临床观察结果相协调?补偿性进化的机制也不足以解释所有观察到的现象,存在实验结果与临床研究的差异。临床研究发现抗生素使用停止后,病原体的耐药性通常会下降,这表明补偿性进化可能在体内无效[75]。随着分子生物学与生物信息学的不断发展,相信此类问题会被逐步解答,其将有助于我们更好地预防和控制细菌耐药性的产生和发展。
抗生素耐药性产生的适应性代价以及补偿性进化是细菌进化的一项重要内容,对特定菌株的特定耐药机制进行适应性代价评估和补偿性进化的研究,将有助于更加全面的理解细菌病原体抗生素耐药性的发展轨迹,为解决抗生素耐药危机提供新的思路。
