比较Thermo STP6F药敏测定卡与微量肉汤稀释法测定链球菌对抗菌药物的敏感性
2019-07-25赵婉彤姚剑杰秦惠宏
赵婉彤, 潘 芬, 姚剑杰, 秦惠宏, 张 泓
肺炎链球菌在引起5岁以下儿童死于肺炎的致病菌中排名第一[1]。近年来随着抗生素的广泛应用,细菌耐药性不断增高,还相继出现了多重耐药菌株,给临床抗感染治疗带来困难,药敏试验在临床治疗中显得愈发重要。目前临床上常用的药敏测定方法有纸片扩散法、微量肉汤稀释法、E试验法和VITEK 2自动化仪器法等。为临床提供快速、准确、方便的链球菌药敏试验测定方法,本文以微量肉汤稀释法为金标准(以下称标准方法),比较赛默飞(Thermo)药物敏感性试验STP6F苛养菌参考卡(以下简称Thermo STP6F药敏卡)测定临床分离链球菌对抗菌药物的敏感性,现将结果报道如 下。
1 材料与方法
1.1 菌株
收集上海市儿童医院临床送检标本中的链球菌共199株进行本项实验。经MS鉴定,其中肺炎链球菌123株、化脓链球菌40株、无乳链球菌36株。质控菌株肺炎链球菌ATCC 49619,来自上海市临床检验中 心。
1.2 主要试剂与材料
细菌培养用血平皿为上海伊华生物有限公司产品,抗菌药物粉剂购自大连美仑生物技术有限公司(头孢噻肟,N0929AS,92.20%;甲氧苄啶,A0709AS,99.80%;磺胺甲唑,M0505AS,99.90%)和中国食品药品检定研究院(青霉素,130437,93.10%;头孢吡肟,130524-201404,84.50%;红霉素,130307-201417,93.30%;克林霉素,130422-201306,84.90%;左氧氟沙星,130455-201607,97.30%;美罗培南,130506-201403,87.00%;四环素,130306-201419,969 μg/mg;万古霉素,130360,1 066 μg/mg)。Thermo STP6F药敏卡(B6062A)、接种培养基 [CP112-10](920765)和自动加样机Sensititre®Autolnoculator®[V3010]由Thermo生物公司提供。
1.3 方法
将菌株复苏后分区划线接种于血平皿,培养后挑取典型单菌落传代1次,置于35 ℃、5%CO2条件下再次培养20~24 h。采取直接菌落悬液法配制0.5麦氏浊度的菌液备用。
1.3.1 微量肉汤稀释法 按美国临床和实验室标准化协会(CLSI )M07-A9[2]的标准操作程序进行,无菌操作将反复冻融的50%裂解的马血(Laked horse blood,LHB)与双倍阳离子调节肉汤(Caton-adjusted Mueller-Hnton Broth,CAMHB)混合,配成5% 冻融裂解马血培养基,并在15 min内完成药敏试验。35 ℃空气环境下培养20~24 h,根据CLSI M100-S26[3]提供的折点判读其敏感性。
1.3.2 Thermo STP6F药敏卡 按试剂盒说明书操作,将0.5麦氏浊度的细菌悬液接种至11 mL接种培养液中混匀后,根据Sensititre®Autolnoculator®[V3010]使用说明书对药敏板进行加样,用黏性密封膜盖上药敏板所有微孔,孵育条件及结果判读同微量肉汤稀释法。
1.4 统计分析
按ISO 20776-2指南计算以下指标[4],①基本一致率(essential agreement,EA):两种方法得到的最低抑菌浓度(minimum inhibitory concentration,MIC)值完全一致或相差在±1个倍比稀释度之内;②分类一致率(categorical agreement,CA):指按CLSI折点对两种药敏测试方法获得的MIC值判读敏感、中介或耐药结果的一致性;③重大偏差(very major discrepancy,VMD):标准方法获得的MIC值为“耐药”(R)而测试方法获得的MIC值为“敏感”(S);④ 较大偏差(major discrepancy,MD):标准方法获得的MIC值为S,而测试方法获得的MIC值为R;⑤ 次要偏差(minor discrepancy,mD):两方法中任一个MIC值为“中介”(I),而另一MIC值为S或R。综合比较所有菌株对测试获得的所有MIC值的两种方法结果计算得出总体CA和EA,总VMD、MD和mD以百分数表达。当EA>90%、CA>90%、VMD<1.5%、MD<3%、mD<10%时则认为测试方法药敏结果可接 受。
2 结果
2.1 两种方法测试肺炎链球菌药敏结果
Thermo STP6F药敏卡板条测定10种抗菌药物对74株青霉素敏感肺炎链球菌(PSSP)和49株青霉素不敏感肺炎链球菌(PNSP)共123株肺炎链球菌的MIC值,与标准方法测试结果相比较,总体EA为95.5%,CA为94.6%,VMD、MD及mD分别为0.5%、1.2%和4.6%。除青霉素(以非脑膜炎折点计算)和美罗培南两种测试方法获得MIC值的CA分别为89.4%和81.3%外,其余抗菌药物包括头孢吡肟、头孢噻肟、克林霉素、红霉素、左氧氟沙星、四环素、甲氧苄啶-磺胺甲唑和万古霉素等MIC值的CA均大于90%(表1)。青霉素出现13株涉及中介结果mD(10.6%),未发生VMD和MD。美罗培南结果中有7株细菌的MIC值是差异±2个稀释度,其中有3株Thermo STP6F药敏卡将耐药误判为敏感(VMD,12.5%),1株将敏感误判为耐药(MD,2.0%)(图1)。除美罗培南外,其余所检测的抗菌药物均未出现VMD。

表1 Thermo STP6F对123株肺炎链球菌测试结果与微量肉汤稀释法比较Table 1 Susceptibility of 123 S. pneumoniae strains determined by Thermo STP6F plate and reference method broth microdilution
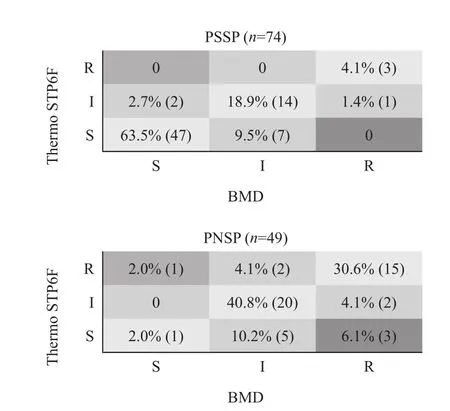
图1 Thermo STP6F测试PSSP和PNSP对美罗培南敏感性结果与微量肉汤稀释法比较Figure 1 Susceptibility testing results of meropenem against 123 strains of Streptococcus pneumoniae compared between broth microdilution (BMD) and Thermo STP6F plate
2.2 两种方法测试化脓链球菌药敏结果
对于化脓链球菌,两种方法测得的抗菌药物MIC值的总EA和CA分别为95.0%和99.2% ,VMD及MD皆为0.8%,mD为0。其中头孢吡肟、头孢噻肟、克林霉素、红霉素、美罗培南、青霉素和万古霉素等抗菌药物MIC值的EA和CA 均为100%,左氧氟沙星、四环素的CA和EA分别为97.5%和85.0%、95.0%和75.0%(表2)。CLSI文件中的甲氧苄啶-磺胺甲唑无判读折点,无法计算CA,其EA 90%。四环素和左氧氟沙星各有1株MIC结果被Thermo STP6F 错误鉴定为耐药(MD),另外四环素还有1株MIC结果被错误鉴定为敏感(VMD)。
2.3 两种方法测试无乳链球菌药敏结果
对于无乳链球菌,两者总体CA为97.8%,EA为93.6%,VMD为1.1%,MD为0.9%,mD为1.2%。其中头孢吡肟、头孢噻肟、美罗培南、青霉素、四环素和万古霉素的CA均为100%。克林霉素和左氧氟沙星的CA均大于90%,红霉素的EA和CA均为88.9%(表3)。对于CLSI无适用耐药折点的抗菌药物,其CA按敏感或非敏感计算。

表2 Thermo STP6F 对40株化脓链球菌测试结果与微量肉汤稀释法比较Table 2 Susceptibility of 40 S. pyogenes strains determined by Thermo STP6F plate and reference method broth microdilution
3 讨论
国际上常采用CNAS-CL01等[5-6]提供的方法和标准评估AST新方法或设备。本文比较了Thermo STP6F药敏卡和微量肉汤稀释法两种药敏试验方法,测定10种抗菌药物对临床分离的199株链球菌的MIC值,结果显示肺炎链球菌、化脓链球菌和无乳链球菌的两种测试方法获得的结果EA和CA较好,但其中肺炎链球菌的青霉素和美罗培南CA低于90%,与国外报道的研究结果类似[7-8]。
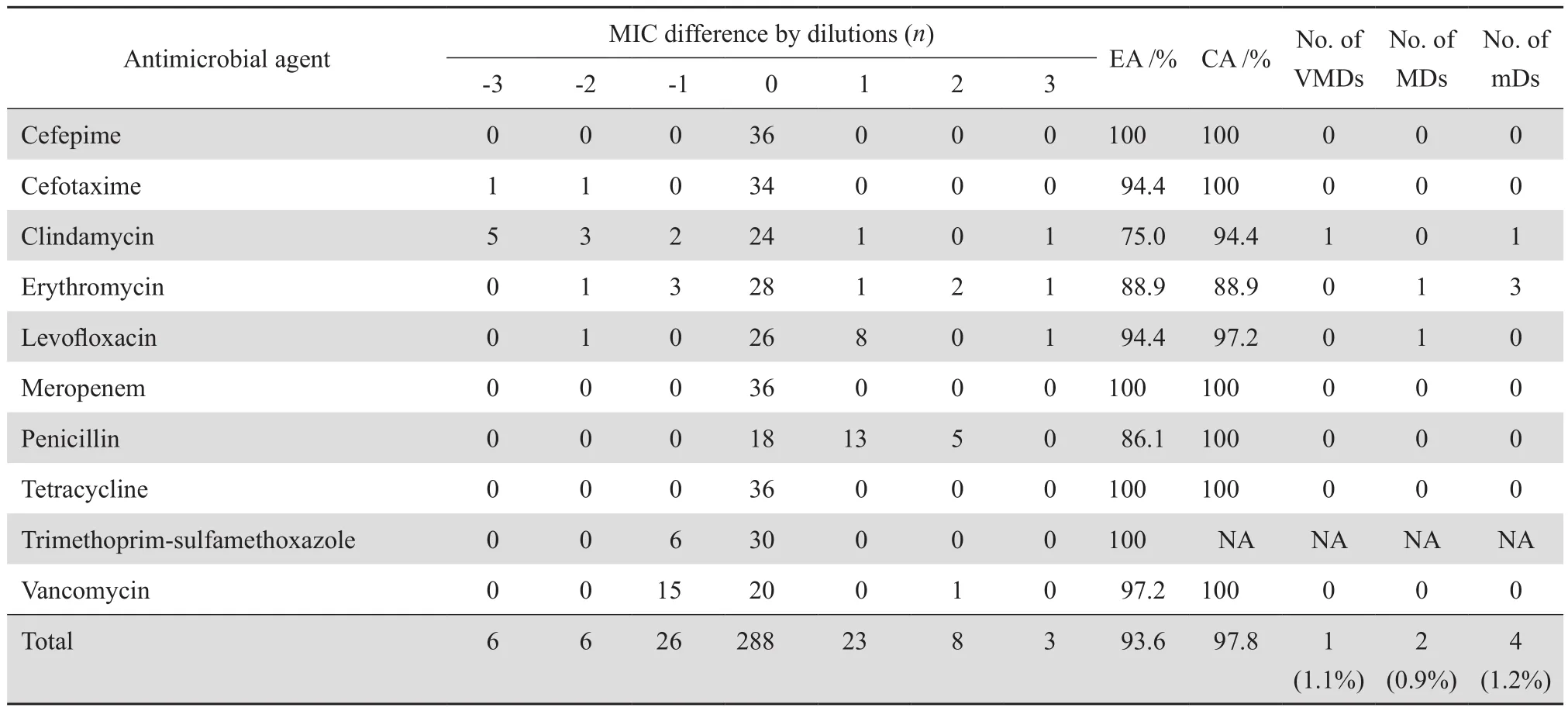
表3 Thermo STP 6F 对36株无乳链球菌测试结果与微量肉汤稀释法比较Table 3 Susceptibility of 36 S. agalactiae strains determined by Thermo STP6F plate and reference method broth microdilution
本组资料显示Thermo STP6F药敏卡测试头孢噻肟、红霉素、左氧氟沙星和青霉素的MIC值结果比金标准微量肉汤稀释法高,与Rennie等[7]、Charles等[8]研究结果一致。VITEK 2因其方便快速等优点在国内微生物临床实验室中应用广泛,但熊安英等[9]研究指出VITEK 2-Compact AST-GP68由于检测原理局限使其对青霉素、美罗培南等药敏试验结果易出现假耐药现象。本组资料显示Thermo STP6F 药敏卡的青霉素结果常发现拖尾或跳孔现象,使终点难以确定,且MIC结果的判读受人为主观因素影响较大,一定程度上造成了MIC值的差异。故在实验操作中特别注意使菌悬液充分乳化,避免细菌悬浮分散不均匀。当用肺炎链球菌测试氯霉素、克林霉素、红霉素、利奈唑胺和四环素时,判读时在拖尾生长开始的最低浓度处读取MIC,微弱生长的小点应忽略不计,培养基中的甲氧苄啶和磺胺类抑制剂可以允许一些轻微的生长,与对照比较读取终点浓度应与生长对照相比抑制≥80%的生长。本组资料显示虽然对于肺炎链球菌青霉素结果有近63.9%(23/36)的结果高出1个稀释度,但其MD和VMD均为0。
74株PSSP和49株PNSP的美罗培南EA分别为98.6%和87.8%,123株肺炎链球菌美罗培南CA为81.3%。CA较低的主要原因是有19株细菌发生了mD,其中有15株细菌Thermo STP6F测定的MIC值低于标准方法测定MIC值1个稀释度,故12株标准方法结果判断为中介、Thermo STP6F结果为敏感;3株标准方法结果为耐药、Thermo STP6F结果为中介;此外,2株标准方法结果为中介、Thermo STP6F结果为耐药,2株标准方法结果为敏感、Thermo STP6F结果为中介。但在化脓链球菌和无乳链球菌中,美罗培南的EA为100%,可能由于化脓链球菌和无乳链球菌美罗培南MIC值都很低,从而呈现出的EA和CA均较好。稀释法易受菌悬液浓度、抗生素拮抗剂含量和钙镁离子含量等影响,Rennie等[7]指出肉汤法中使用的微量体积肉汤会降低发现生长缓慢耐药亚群的可能性,但这一点还尚不完全清楚 。对于肺炎链球菌美罗培南还没有可靠的纸片扩散法药敏试验,检测其体外抗菌活性最好使用稀释法确定。当青霉素对于非脑膜炎分离株MIC≤0.06 mg/L(或苯唑西林抑菌圈直径≥20 mm)时,可预报美罗培南为敏感,当青霉素MIC>0.06 mg/L时,对美罗培南中介或耐药的结果用E试验法复核[10]。
本文根据ISO 20776-2文件[4]中的要求,MD基于标准方法测定得出的敏感菌株数计算,VMD基于标准方法确定为耐药分离株数目计算,而国内许多研究的偏差基于所有菌株总数计算[9,11-12],得出的偏差值会明显偏 低。
本组资料显示受试的各组链球菌属细菌对各种抗菌药物的敏感性两种方法的CA有差异。如青霉素、头孢噻肟、头孢吡肟、美罗培南和万古霉素等对化脓链球菌、无乳链球菌MIC值都相对较低,两种方法的CA均达100%。但肺炎链球菌对青霉素等上述β内酰胺类就不尽然,两种方法测试肺炎链球菌对青霉素的敏感性,74株PSSP的CA为87.8%;49株PNSP的CA为91.8%;123株肺炎链球菌总的CA为89.4%;而123株肺炎链球菌对万古霉素总的CA为100%。提示CA与细菌对抗菌药物敏感和耐药性有关。
基于以上研究结果提示,Thermo链球菌MIC药敏板条结果与手工微量肉汤稀释法一致性较好,操作简便,假敏感和假耐药的风险很低,但其抗菌药物浓度梯度覆盖面窄,部分药物结果与微量肉汤稀释法有差异,临床微生物室可根据具体的目的和实验室条件选择合适的检验方法,互为完善,在用于检测肺炎链球菌对美罗培南药物敏感性必要时建议结合E试验法复核结 果。
