荧光聚合酶链反应熔解曲线法快速检测结核分枝杆菌及异烟肼耐药突变的临床应用价值
2019-07-25李芳芹
阳 央, 冯 智, 侯 欢, 李芳芹
结核病是危害人类健康的古老疾病,至今仍是全球十大死亡原因之一。据世界卫生组织2018年全球结核病控制报告,2017年中国新发结核病患者占世界的9%,平均感染人数63/100 000,位居全球第二,也是耐药结核病发生最多的三大国家之一;耐多药/利福平(RIF)耐药结核病平均发生数5.2/100 000[1],一例未治疗的耐药结核菌感染患者每年可以传染10~15个人,耐药结核病已成为全球结核病死灰复燃的重要原因,严重威胁公共卫生健康[2]。耐药性出现和迅速蔓延的一个因素是缺乏快速诊断,因此,快速诊断耐药结核病获得菌株耐药信息是控制结核病传播和治疗的关键。
异烟肼(INH)是结核病化疗的基础,是治疗和预防最重要药物,荧光聚合酶链反应(PCR)熔解曲线法是根据结核分枝杆菌野生型序列和突变序列不同熔点温度(Tm)而产生不同熔解曲线设计,其基本原理是在一定环境下,双链DNA在其长度和序列一定时,Tm值也一定,是其固有性质,当发生点突变、插入或缺失,Tm值下降,下降的幅度与发生点突变的类型、插入或缺失的碱基数目以及突变位点的位置有关;利用荧光标记的探针对耐药突变的位点进行特异性扩增,然后做熔解曲线,通过与野生型菌株比较从而判断是否发生突变。本研究意在探讨此方法在临床快速检测结核分枝杆菌及其INH耐药突变的应用价值。
1 材料与方法
1.1 材料来源
1.1.1 标本来源 痰液标本来源于延安市传染病医院2018年4-12月住院的370例肺结核确诊患 者。
1.1.2 仪器与试剂 MGIT320仪及配套试剂购于美国BD公司,Lab-Aid 824全自动核酸提取仪及SLSN-96实时荧光PCR仪购于上海宏石医疗科技公司,HC-2518R高速冷冻离心机购于安徽中科中佳公司,结核分枝杆菌DNA提取和结核分枝杆菌复合群(MTBC)检测试剂及INH耐药突变检测试剂盒来自厦门致善生物有限公司。
1.2 方法
1.2.1 检测与突变评估 在P2+实验室按照操作规程对痰液标本应用MGIT320进行液体培养及药敏,采用磁珠法提取痰液中MTBC的DNA,实时荧光PCR仪进行MTBC及INH耐药突变快速检测。剔除培养法结核阳性和MTBC阳性,因含菌量低未进行表型药敏与耐药突变检测或药敏试验失败的菌株,以培养法药敏为金标准,评估熔解曲线法耐药突变检测。
1.2.2 INH耐药突变 INH耐药突变根据靶序列的熔解变化检测ahpC启动区(-44~-30以及-15~3位点)、inhA94密码子、inhA启动区(-17~-8位点)、和KatG315密码子是否突变。参照说明书判断结果[四个通道任意一通道中样品的熔点低于阳性对照2 ℃及以上时(ΔTm≥2 ℃)判断为突变型]。
1.2.3 统计学方法 数据采用Excel统计处理,SPSS 22.0进行统计学分析,两种方法差异性检测采用McNemarχ2检验,采用Kappa检验分析两种方法检测结果一致性(Kappa≥0.8高度一致;0.6≤Kappa<0.8 一致性较好;0.4≤Kappa<0.6 一致性中等;Kappa<0.4 一致性较差)。
2 结果
2.1 结核分枝杆菌检出比较
370例肺结核患者,培养法检出MTBC 175株,阳性率47.3%,其中148株进行了培养法表型药敏试验;熔解曲线法检出157株,阳性率42.4%,其中128株进行了分子学药敏试验。两种方法检测MTBC的结果差异无统计学意义(P=0.073),一致性中等(Kappa=0.510),熔解曲线法检测MTBC的灵敏度69.1%,特异度81.5%,见表1。
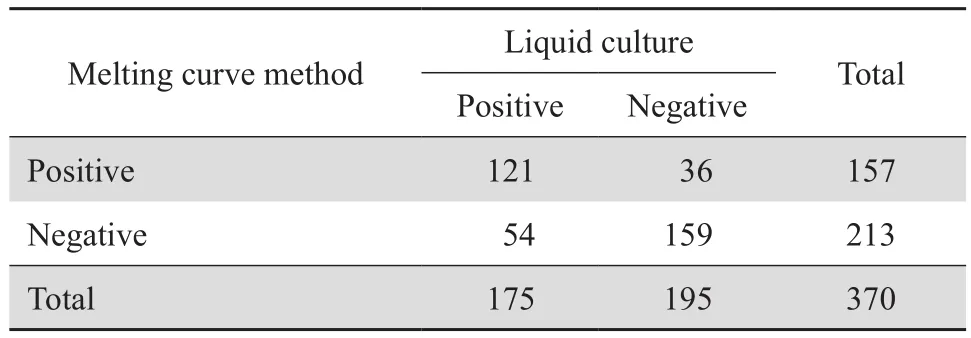
表1 荧光PCR熔解曲线法与MGIT320液体培养法检测MTBC结果Table 1 Detection of Mycobacterium tuberculosis complex by fluorescence PCR melting curve analysis and MGIT320 mycobacterial liquid culture
2.2 INH耐药结果比较
同时有药敏结果的115株菌株进行比较,培养法20株耐药,95株敏感;熔解曲线法25株耐药,90株敏感,两种方法检测结果比较差异无统计学意义(P=0.125),具有高度一致性(Kappa= 0.807),熔解曲线法INH耐药突变检测灵敏度95.0%,特异度93.7%,见表2。

表2 INH耐药突变与MGIT320液体培养法药敏结果Table 2 Correlation between isoniazid resistance mutation detected by melting curve method and MGIT320 mycobacterial liquid culture and susceptibility testing
2.3 INH典型突变
25株INH耐药突变株中熔解曲线法检出17株KatG基因突变,其中1株合并ahpC启动区突变,1株KatG基因缺失;3株inhA基因突变,5株为杂合样品,典型KatG315突变熔解曲线见图1,典型inhA突变熔解曲线见图 2。
3 讨论
随着现代分子生物学技术的发展,越来越多检测结核杆菌的分子生物学方法在临床得到了广泛应用,包括实时荧光定量PCR检测DNA,线性探针技术,基因芯片,半巢式全自动荧光定量PCR(Xpert MTB/RIF)及熔解曲线法等,其中Xpert MTB/RIF为WHO推荐方法,但仪器及检测价格昂贵,只能测定RIF耐药情况。相比较,由我国自主研发的荧光PCR熔解曲线法试剂盒能同时对多种一线及二线抗结核药物进行耐药检测[3],能快速获得较全面的耐药信息。
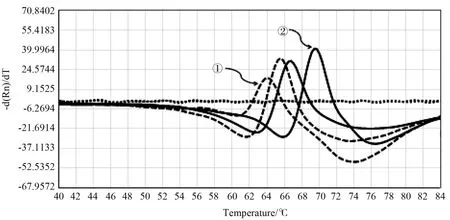
图1 KatG315突变熔解曲线Figure 1 The melting curve of KatG315 mutation

图2 inhA突变熔解曲线Figure 2 The melting curve of inhA mutation
本研究中培养法与熔解曲线法检出MTBC的结果无差异,熔解曲线法检出MTBC的灵敏度69.1%,特异度81.5%,灵敏度低于新疆相关研究[4]。培养法检出MTBC 54株阳性,而熔解曲线法MTBC检测阴性,灵敏度低可能原因:①直接以痰标本提取结核菌DNA,某些痰标本不合格或含菌量低(痰含菌量<200 CFU/ mL)达不到熔解曲线法检测灵敏度下限,造成假阴性,而培养法通常每毫升痰含100条以上抗酸菌可得到阳性结果;②核酸提取时痰液液化不全,或消化后存在抑制物,如血痰标本扩增可能受抑制,而内标可能对抑制物检测还存在一定局限,导致假阴性;③试剂盒反复冻融。熔解曲线法MTBC检出36株,而培养法阴性,可能主要原因是熔解曲线法既能检测死菌也能检测活菌,而液体培养只针对活菌,因此,熔解曲线法不能有效区分是否为活动性结核;另外,有研究表明,液体培养法前期用NaOH处理痰液时会杀死部分结核菌,特别是菌量少的标本[5],可能也是造成结果不一致的一个因素。
分枝杆菌最重要的耐药机制是由于基因突变或外排泵的激活,而不是像其他细菌中常见的耐药机制是由于获得耐药质粒或转位子,耐多药结核分枝杆菌,即至少同时耐INH和RIF的菌株,早在1985年就开始增多,INH耐药的主要机制是katG(S315T)及inhA基因的突变[6]。katG基因编码过氧化氢酶-过氧化物酶激活INH形成异烟酰阴离子或自由基,与NAD反应生成INH-NAD复合物,INH-NAD复合物抑制细胞壁分枝菌酸合成有关的靶点inhA蛋白,导致分枝菌酸生物合成的破坏和细菌死亡[7]。katG基因突变或缺失导致INH活化受阻,inhA突变导致INH作用靶点改变,从而产生耐药,快速检测INH耐药突变有助于早期发现耐多药结核病和广泛耐药结核病。
本研究中,培养法进行表型药敏试验检测率84.6%(148/175),熔解曲线法进行分子学药敏试验检测率81.5%(128/157),前者略高于后者,可能由于痰标本含菌量少,造成熔解曲线法MTBC检测出现假阴性,因此,多次送检也十分重要;另外,部分熔解曲线法检测MTBC阳性,但是阈值循环数(Ct)值在23以上,我们未进行突变检测,有研究表明,Ct值一旦高于23,很难进行突变检测[8]。同时有INH药敏结果的菌株进行统计学分析,两种方法耐药检测结果差异无统计学意义,熔解曲线法INH耐药突变检测的灵敏度95.0%、特异度93.7%,高于杜鹏等[9]、刘艳等[4]研究。表型药敏试验耐药而突变检测阴性的可能原因:①试剂盒本身检测存在局限,只针对ahpC启动区、inhA94密码子、inhA启动区及katG315密码子的突变,其他类型突变引起的耐药无法检测;②INH耐药机制复杂,如药物外排泵的改变,耐药突变可能无法检测;③可能存在异质性耐药[10](指同一标本中同时存在耐药和敏感的菌株),因耐药菌株所占比例较低(本试剂盒检测突变下限为40%)或试剂盒本身缺陷,熔解曲线法检测不到,INH异质性耐药MGIT DST可以检出预期1%耐药菌[11],而熔解曲线法检出INH异质性耐药通常突变比例下限20%~40%[3],有研究说明异质性耐药可能是多重耐药结核菌和广泛耐药结核菌产生的先兆[12-13],最近报道的一种高敏感检测异质性耐药的深度熔解法,能检出1%突变菌株比例的INH异质性耐药[14],可能弥补目前分子学方法异质性耐药检测的困境;④液体培养法污染率较熔解曲线法的污染率高,因此,部分培养法药敏结果存在假阳性的可能,同时目前耐药突变试剂盒48人份/盒,如果每次检测数量少,试剂盒反复冻融,可能导致检测效能降低,造成假阴性。表型药敏试验敏感而突变检测阳性的可能原因:①熔解曲线法只筛查核酸序列,部分不引起氨基酸改变的突变(沉默突变),会被判为突变型,而这种突变不会引起耐药的生物学改变;②试剂盒从方法学上并不能区分具体突变位点,而某些突变位点可能并不引起耐药;③可能与菌株的低浓度耐药有关,导致药敏结果敏感,而突变检测阳性,特别是在部分inhA突变菌株中,inhA的突变与低浓度INH耐药有关,本次3株inhA突变菌株中,1株药敏结果敏感;④同时存在异质性耐药或提取DNA不纯,导致熔解曲线出现各种杂合峰或复杂熔解曲线,而杂合峰或复杂熔解曲线等的耐药突变判断受仪器性能及人工判断的影响。本次实验中,5株杂合样品仪器自动判断为耐药,而药敏结果均显示敏感,对于杂合样品最好重复进行检验。因此,临床在INH突变检测耐药,而培养药敏敏感时,特别是抗结核治疗了一段时间和复治患者,此时检测到的耐药突变可能由于死菌引起,沉默突变或是与导致低浓度耐INH的突变等有关,是否需要改变治疗方案需要谨慎,最好根据临床抗结核效果和患者情况等因素决定是否改变,因为一些低浓度耐药的患者可能受益于高剂量INH的治疗[15]。本次实验不足在于,未对存在差异的菌株进一步测序,进行比较的菌株有限,我们将继续跟踪研究,以期更精准详尽的报告。综上所述,临床报告耐药突变阴性时,并不一定代表菌株对抗菌药物是敏感的,而报告耐药突变时,临床上抗结核治疗可能也是有效的。
本次通过对痰液样本直接检测表明,虽然荧光PCR熔解曲线法试剂盒还存在一些局限,但不可否认它在快速诊断结核病和INH耐药突变检测中具有重要价值,熔解曲线法对INH耐药突变检测表现出高灵敏度和特异度,相信未来随着分子生物技术的进一步发展,试剂盒和仪器的优化,快速、准确的分子药敏方法,必将开启抗结核治疗的精准时代。
