牦牛乳源嗜热链球菌直投式发酵剂的制备及应用
2019-07-24刘刚梁琪宋雪梅张炎
刘刚,梁琪*,宋雪梅,张炎
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(甘肃省功能乳品工程实验室(甘肃农业大学),甘肃 兰州,730070)
牦牛乳是一种特有的天然绿色产品,营养成分高于普通牛乳,是乳制品加工的最优原料之一[1]。全世界牦牛存栏数为1 400多万头,其中中国大陆占90%以上[2]。对于牦牛乳乳制品,国内乳品企业的发酵菌种均来自国外科汉森和丹尼斯克2个公司,我国密切关注国内菌种及发酵剂的发展,因此,对牦牛乳特有乳酸菌及其发酵剂的研究至关重要。真空冷冻干燥后的菌株具备活菌数含量高、遗传稳定性好等特点[3-4],但冷冻干燥也会导致微生物活力降低甚至死亡[5-6]。菌株在真空冷冻干燥过程中,菌体细胞由于机械损伤、DNA损伤等受到不同程度伤害[7],选择适当的冻干保护剂,则可使菌株保留自身的生物活性和理化特征[8]。因此,在工业化生产中,合适的保护剂不仅能有效地保护菌株的效能,而且能提高乳酸菌发酵剂和发酵产品的质量,从而使企业和农户增收增效。
本研究以甘肃藏区牦牛乳中筛选并诱变处理的嗜热链球菌[9]为研究对象,研究冻干条件和保护剂对其影响,以期为乳品发酵工业应用,尤其是牦牛乳品工业的应用提供直投式发酵剂资源。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
嗜热链球菌StreptococcusthermophilesQ4F8,由甘肃省功能乳品工程实验室分离纯化,于-80 ℃超低温冰箱冷冻保藏;商业发酵剂(嗜热链球菌和保加利亚乳杆菌),丹尼斯克有限公司。
1.1.2 培养基
GM17培养基[10]:多聚蛋白胨5 g,植物蛋白胨5 g,酵母膏2.5 g,牛肉膏5 g,乳糖5 g,抗坏血酸钠0.5 g,MgSO4·7H2O 0.25 g,KH2PO45 g,琼脂15 g,蒸馏水1 000 mL,调节pH值为6.9±0.2,于121 ℃高温灭菌20 min。
脱脂乳培养基:120 g/L的脱脂乳,于115 ℃下灭菌15 min。
1.1.3 试剂
脱脂乳(食品级):完达山乳业股份有限公司;谷氨酸钠、甘油、海藻糖、0.01 mol/L I2标准液、双乙酰标准液、三氯乙酸、NaHSO3、淀粉、邻苯二胺、NaCl、酚酞(分析纯):上海国药集团。
缓冲剂A(pH 6.86):Na2HPO4(11.876 g/L)溶液,KH2PO4(9.078 g/L)溶液,配制而成。
缓冲剂B(pH 6.0):NaOH(0.1 mol/L)溶液,KH2PO4(0.2 mo1/L)溶液,配制而成。
缓冲剂C(pH 6.4):KH2PO4(0.2 mo1/L)溶液,NaOH(0.2 mo1/L)溶液,配制而成。
1.2 仪器与设备
723型可见分光光度计,上海光谱仪器有限公司; SW-CJ-2FD型双人单面净化工作台,苏州净化设备有限公司; PHS-3C型pH计,上海仪电科学仪器股份有限公司;紫外灯,南京华强电子有限公司;YX280型手提式不锈钢压力蒸汽灭菌锅,上海三申医疗器械有限公司;LVDV-1数字旋转黏度计,上海方瑞仪器有限公司;TGL-20M台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;DW-86L386立式超低温保存箱,青岛海尔特种电器有限公司;电热恒温培养箱,上海一恒科学仪器有限公司; FR224CN型电子天平,奥豪斯仪器有限公司;BCD-539WF海尔家用电冰箱,青岛海尔股份有限公司;SCIENTZ-10ND冷冻干燥机,宁波生物科技有限公司。
1.3 方法
1.3.1 菌株Q4F8生长特性的研究
将活化后的嗜热链球菌Q4F8按3%的体积分数接种于GM17培养基,42 ℃恒温培养,每2 h取样,通过平板稀释涂布法,测定菌液的活菌数,连续测定至24 h,以时间和活菌数作图并绘制嗜热链球菌的生长曲线。
1.3.2 缓冲剂对菌株生长特性影响
通过菌株Q4F8的生长曲线,得出菌株开始“自溶”的时间点T[11]。将菌株活化后,分别以1.5%体积分数的接种量接种于优化后的培养基中,于42 ℃恒温培养,每隔2 h测定培养液的OD600值。从时间点T前2 h时为T1点,开始按照1.5%的量添加缓冲剂,此后每隔2 h添加1次,每次添加量为1.5%,直至菌落的OD值没有明显变化为止。
1.3.3 保护剂的配制
由于NaCl可影响糖代谢关键酶[12],从而能调节菌体细胞的糖代谢活动。因此,选择85 g/L的NaCl配制各个质量浓度梯度的冻干保护剂,灭菌后于4 ℃保藏,备用。其中,海藻糖和谷氨酸采用0.22 μm的微孔滤膜(有机相)过滤除菌,脱脂乳和甘油采用高温高压灭菌(115 ℃,15 min)。
1.3.4 发酵剂的制备
将菌株加入1.5%缓冲剂并发酵至对数后期,取发酵液离心(4 ℃),离心后菌泥中加入适量生理盐水溶解,将离心后的菌体和保护剂按1∶3(V/V)于旋涡振荡器混匀后,冰箱中预处理8 h,立即放入灭菌的真空冷冻干燥设备中处理。
冻干前首先用体积分数75%的酒精喷洒冷冻干燥机进行灭菌处理,迅速将预冻样品放入,进行抽真空冷冻24 h。真空冷冻干燥结束,对样品进行真空封口包装,4 ℃低温保藏。加入与冻干前样品等体积生理盐水与菌粉复容,采用稀释平板法测定菌落数,并计算存活率,如式(1)所示,试验平行3次。

(1)
1.3.5 离心条件对菌泥得率的影响
取最优条件下培养的发酵液,装入无菌离心管中,分别在4 000、5 000、6 000、7 000、8 000 r/min条件下,离心10、15、20 min。用等量的无菌生理盐水稀释沉淀,测定菌落数,计算菌泥得率(如式2所示)。
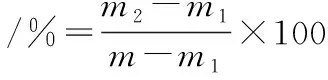
(2)
式中:m为加入发酵液后离心管质量,g;m1为离心管空质量,g;m2为离心后弃去上清液离心管质量,g。
1.3.6 预冻温度对菌株存活率影响
将制备好的菌悬液在42 ℃下放置30 min,分别在4、-20和-80 ℃下预冻8 h,以100 g/L脱脂乳为保护剂进行真空冷冻干燥,待菌液完全冻结后迅速转移至灭菌冷冻干燥机进行冻干,测定菌株存活率。计算参照公式(1)。
1.3.7 冻干保护剂的筛选
1.3.7.1 单一冻干保护剂对存活率的影响
选择不同浓度的脱脂乳、甘油、海藻糖、谷氨酸钠为保护剂,如表1所示,并测定菌株存活率。

表1 冻干保护剂试验因素及水平Table 1 Factors and the levels of cryoprotectant
1.3.7.2 复合冻干保护剂正交试验
按照L9(34)的试验设计方案制备冻干菌粉的保护剂,计算冻干后菌体的存活率为筛选指标,选取保护剂最优配方。保护剂添加水平见表2。

表2 复合冻干保护剂正交试验因素及水平Table 2 Factors and the levels of compound cryoprotectant
1.3.8 贮藏期发酵剂稳定性检测
将制备好的冻干保护剂菌粉通过非真空和真空包装,贮藏于-18、4和25 ℃,测定0、15、30、45、60、75和90 d后的活菌数。发酵剂中加入与冻干前等体积灭菌生理盐水(85 g/L)复溶,摇匀后稀释涂布计数,以活菌数为指标,研究贮藏期间发酵剂的稳定性。
1.3.9 冻干菌粉发酵性能验证
常温条件下,商业发酵剂和冻干菌粉用85 g/L灭菌生理盐水复溶冻干菌粉30 min,复溶菌液按3%接种于半脱脂牦牛乳中(脂肪含量≥3.1%),在42 ℃发酵直至凝乳。记录凝乳时间,测定滴定酸度、活菌数、黏度和感官评价。
1.3.9.1 滴定酸度测定
参照GB 5009.239—2016 食品安全国家标准酚酞指示法测定滴定酸度。
1.3.9.2 活菌数测定
参照GB 4789.2—2016 食品安全国家标准食品微生物学检验菌落总数法测定。
1.3.9.3 黏度测定
采用LVDV-1数字旋转黏度计,参数设置:选择3号转子,转速为6 r/min。单位为Pa·s。
1.3.9.4 感官评价
发酵乳凝乳后于4 ℃冰箱贮藏24 h,由10人组成评价小组,对酸乳的色泽、风味和组织状态进行描述及评分[13]。评价标准见表3。
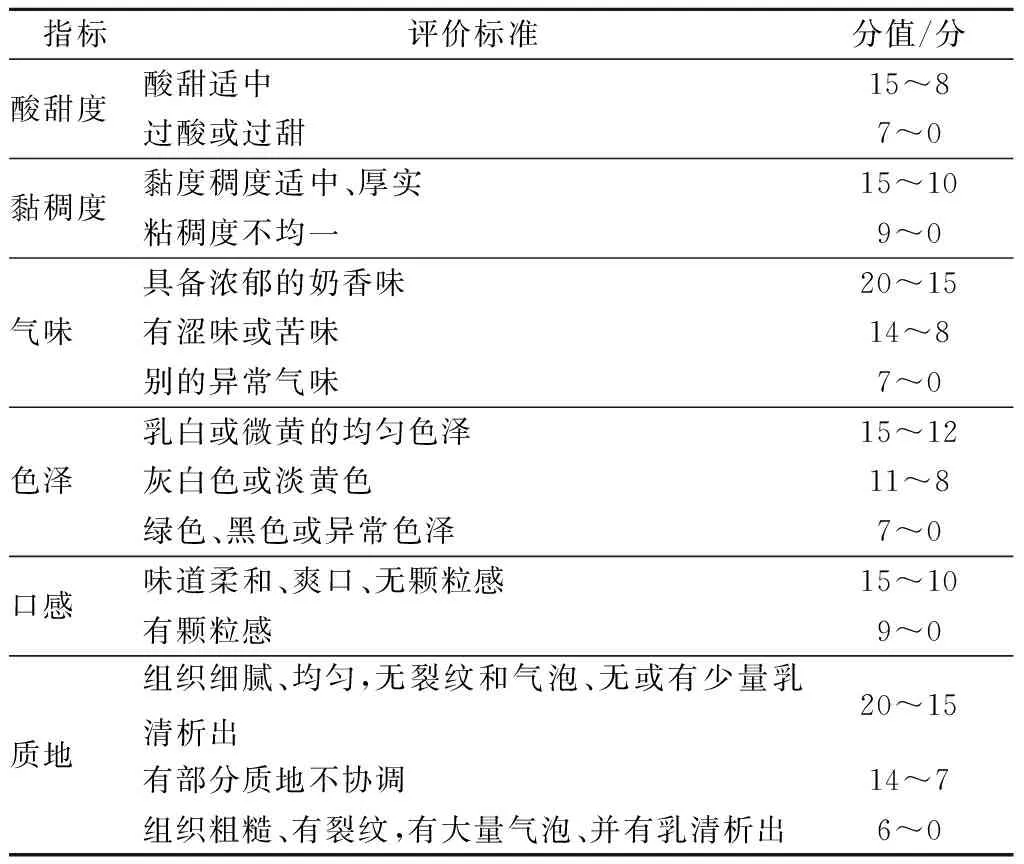
表3 酸奶感官评分标准Table 3 Standard for sensory characteristics of yogurt
1.4 数据统计分析
本试验数据均重复3次。采用Origin 2018软件进行绘图处理,SPSS 22.0软件进行统计分析,采用邓肯氏多重比较方法进行显著性分析。
2 结果与分析
2.1 菌株Q4F8的生长特性研究
对初始嗜热链球菌菌株活菌数的生长指标进行测定。由图1可以看出,0~4 h为该菌株的调整期,发酵液的各项指标基本保持一致。4~12 h进入对数期,菌体在适宜的生长环境下,其菌落数出现急剧增加的趋势。发酵12 h时菌株达到自溶点(0T)。微生物自溶是菌体在不利环境中生存的一种方式,发酵乳中乳酸菌自溶,既破坏发酵剂成分,又使得乳酸菌活菌数降低,自溶分解的细胞质,将会改变发酵乳的感官性状和生产周期[14-15]。
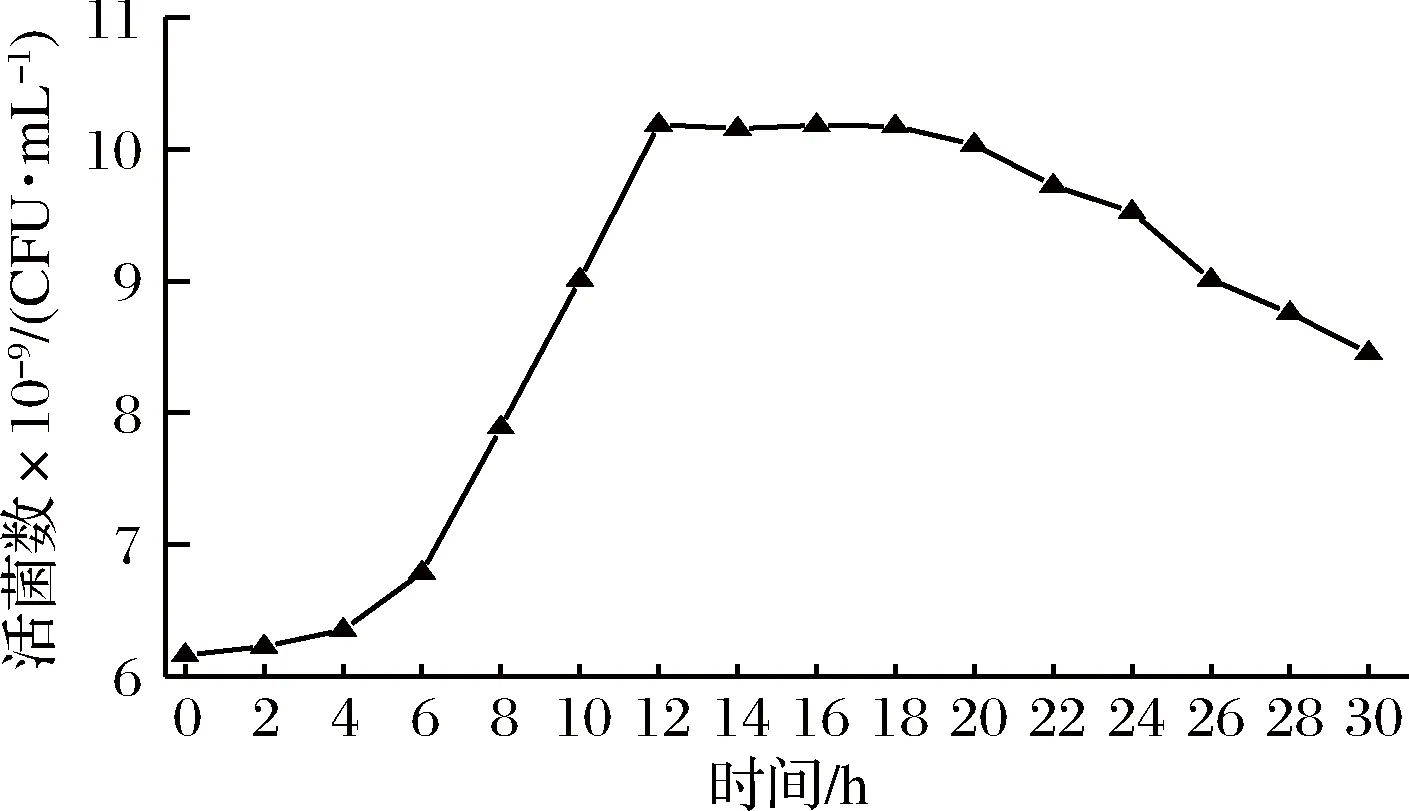
图1 嗜热链球菌Q4F8的生长曲线Fig.1 Growth curve of Streptococcus thermophilus Q4F8
2.2 缓冲剂对菌体生长特性的影响
由图2可知,在菌株培养至自溶点时期添加不同缓冲剂,菌株活菌数都有不同程度的增殖,增殖情况由强到弱依次为:缓冲剂A>缓冲剂C>缓冲剂B。同一时期,不同缓冲剂对菌株的生长量全部呈现显著性差异(P<0.05),说明缓冲剂可缓解乳酸菌的自溶现象。在一定范围内,缓冲剂可调节菌体自身产酸造成的影响,不同的环境条件对乳酸菌自溶程度和产品质构、风味产生不同影响[16-17]。因此,选择pH为6.86的缓冲剂较为适宜。
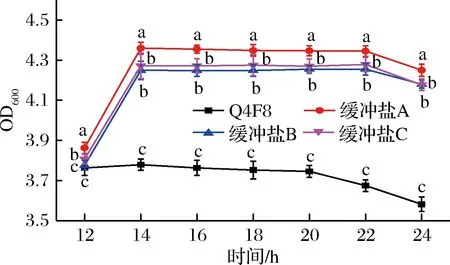
图2 缓冲剂对菌体生长特性的影响Fig.2 Effect of growth characteristic on cell注:a,b,c,d等不同字母表示试验结果差异性显著(P<0.05)。
2.3 离心条件的确定
由表4可知,随着离心转速和离心时间的增加,活菌数量和细胞存活率都呈现减小趋势,而菌泥得率呈现增长趋势。离心力越大对菌体的损伤越大,离心时间对菌体造成的损伤小于离心力造成的损伤,根据菌泥得率的趋势变化,在6 000 r/min离心10 min之后的菌泥得率变化不明显(P>0.05)且细胞存活率较高达到89.23%,故采用6 000 r/min离心10 min后收集菌体,得到菌体的最大收集量。研究表明,不同离心条件和离心时间影响菌体的代谢产物含量、细胞的抗冻性和贮藏性能,而离心温度对以上菌体的性能影响不显著性[18-19]。
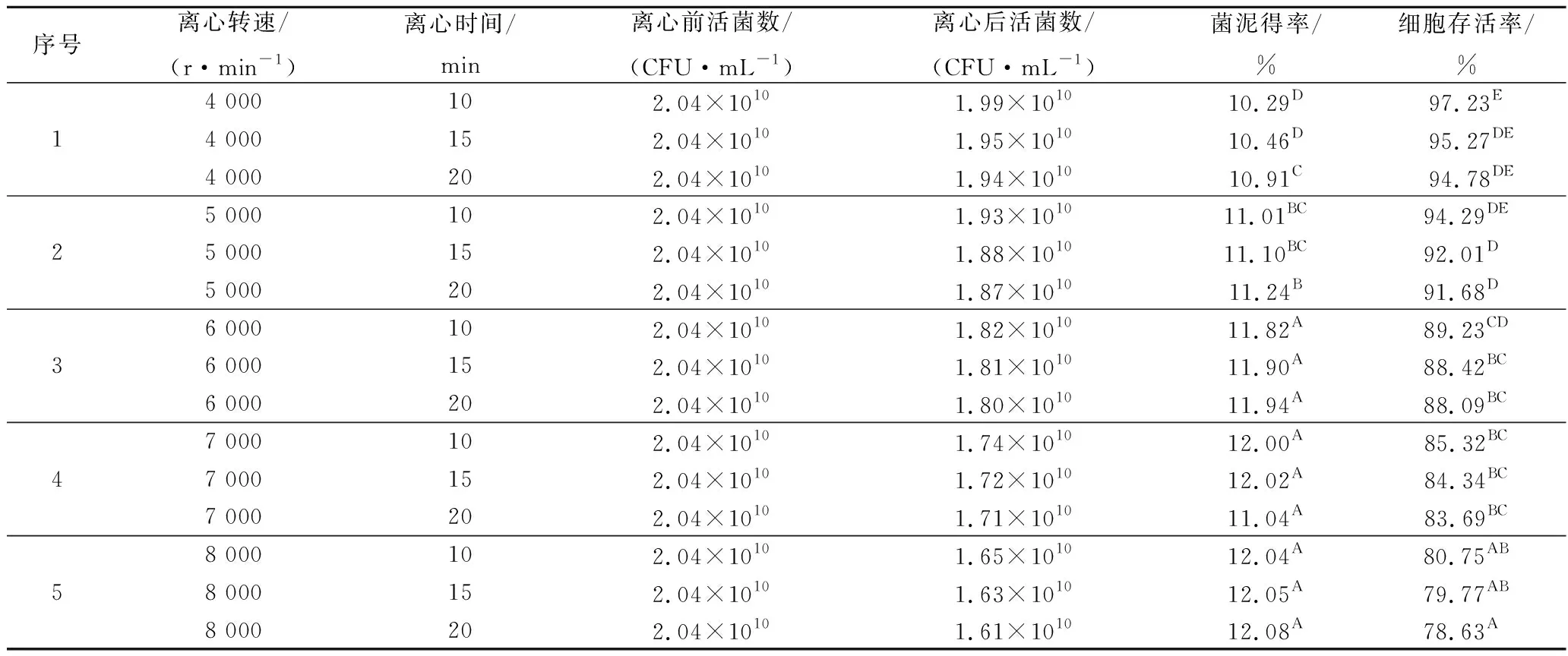
表4 离心条件的筛选试验结果×10-10Table 4 The screen experimental result of conditions for centrifuging
注:A,B,C,D等不同字母表示试验结果差异性及显著(P<0.01)。
2.4 预冻温度对菌株的影响
由图3可知,冻干菌株的存活率随着预冻温度的增加不断下降,但-80和-20 ℃变化不显著(P>0.05)。考虑到资源和成本的节约,选择-20 ℃作为该菌株的预冻温度。说明-20 ℃预冻处理,可明显提高冻干菌株的存活率,这与BRAVO[20]的报道相一致。乳酸菌直接冷冻会对其造成细胞膜的破坏和严重机械损伤,预冻温度不仅影响菌体细胞内冰晶的大小,而且对菌体的干燥时间也有很大影响。因此,研究预冻处理是非常有必要的。低温条件下,乳酸菌冷冻的处理直接影响菌株的活力,其活力受预冻温度、时间和速率的影响较大[21-22]。
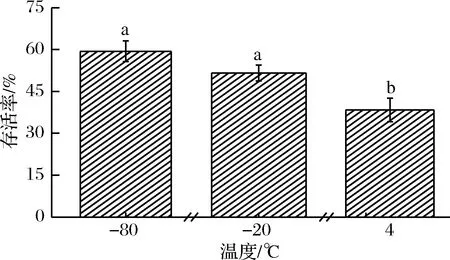
图3 预冻温度对菌株存活率的影响Fig.3 Effect of pre-freezing temperature on survival rate注:a,b,c,d等不同字母表示试验结果差异性显著(P<0.05)。
2.5 冻干保护剂的优化
2.5.1 单一冻干保护剂的优化筛选
由图4可知,从菌体细胞存活率最大情况分析得知,当单一保护剂质量浓度分别为150 g/L脱脂乳、10 g/L的谷氨酸钠、60 g/L的甘油和80 g/L的海藻糖时,其菌体细胞存活率最大。
脱脂乳是蛋白类保护剂,与菌体易形成多孔结构,在菌体表面形成保护层,减少菌体细胞表面积的暴露和细胞壁的损害[23-24];谷氨酸钠是抗氧化剂类保护剂,在冷冻干燥期间,乳酸菌会产生过氧化物自由基而导致细胞损伤,一定量的抗氧化剂可减轻细胞受到的损伤[25],且谷氨酸钠与水分子结合,水分子在冻干后可维持细胞生命活动,提高菌体存活率[26];甘油是渗透性保护剂,可自由进入细胞壁和细胞膜,冷冻时与菌体成玻璃态,从而抑制细胞冰晶的形成,保护具体免受伤害[26];海藻糖是糖类保护剂,其二糖形式效果最佳[27],如海藻糖的羟基和蛋白质形成氢键,稳定了菌体蛋白结构,提高乳酸菌的存活率[28]。
虽然各保护剂对乳酸菌可达到一定的保护作用,但要达到最佳保护效果必须通过各保护剂之间的协同作用,共同保护菌体细胞以提高乳酸菌菌体的存活率。
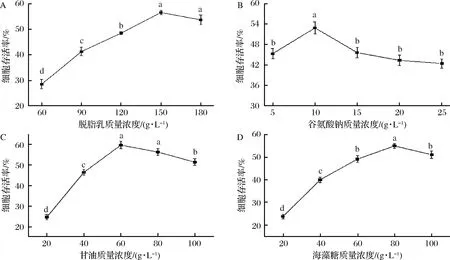
图4 单一冻干保护剂对菌株存活率的影响Fig.4 Effect of single protectant on survival rate注:不同字母表示差异性显著(P<0.05)。
2.5.2 复合冻干保护剂的正交筛选
按单一保护剂选取的最佳添加比例进行正交试验,正交试验结果如表5所示。
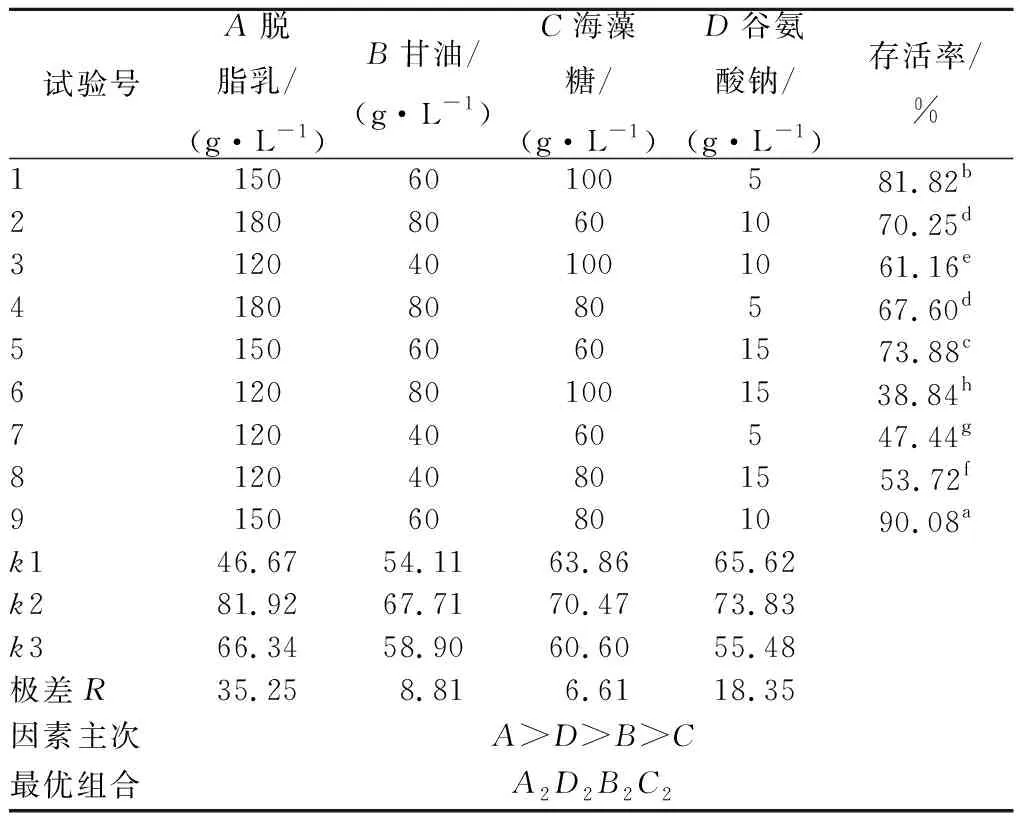
表5 复合冻干保护剂L9(34)试验结果Table 5 The results of orthogonal experimental design L9(34) on protectants
注:不同字母表示差异性显著(P<0.05)。
表5结果表明,相较单一保护剂对嗜热链球菌Q4F8菌株的存活率,复合保护剂具备更好的保护效果。符合保护剂能够相互达到互补,协同效果增强,从表5可以看出,正交试验得出的保护剂优化方案为:150 g/L脱脂乳、10 g/L的谷氨酸钠、60 g/L的甘油和80 g/L的海藻糖,虽然单一保护剂的最佳效果和正交试验一致,但通过正交试验得出的菌株Q4F8的存活率为90.08%,正好验证复合冻干保护剂是由单一保护剂相互间协同保护而作用的效果。正交试验最优结果与未添加的保护剂的存活率相比菌株呈显著性增加(无保护剂的冻干菌粉菌株存活率为21.16%)。
2.6 发酵剂贮藏稳定性研究
由图5可知,在真空包装和非真空条件下,发酵剂的贮藏稳定性存在明显差异(P<0.05)。经90 d的储藏,菌株在-18 ℃的真空条件下,其活菌数下降不明显(P>0.05)。

图5 发酵剂的储藏稳定性Fig.5 Storage stabilitys of starter
冷冻干燥期间,微生物表面水分活度降低,有益于菌体细胞的热稳定性,提高菌株的存活率[29]。储藏冻干菌粉时,储藏条件下的气体组分,特别是氧含量对储存效果有很大影响。当储藏温度高于玻璃化的转化温度时,分子间的运动空间增大,发生一系列反应,从而对菌体活力造成影响[30]。TCIXCIRA[31]研究发现,在氧气存在的情况下,冻干菌细胞膜中的脂质会和氧气发生氧化反应,严重影响菌粉储存期间的稳定性,所以对冻干菌粉进行储藏时,通常选择真空包装来避免氧化反应的发生。
2.7 发酵剂发酵特性研究
嗜热链球菌冻干发酵剂和商业发酵剂对比结果如表6所示,由于冻干发酵剂为单菌株的直投式发酵剂,而商业发酵剂则是球菌与杆菌两者的共生作用,较单一菌株加快了发酵进程,缩短了凝乳时间。由表6可知,虽然凝乳时间比商业发酵剂较长,但滴定酸度为89.790T和活菌数含量4.63 lgCFU/mL与商业发酵剂活菌数和滴定酸度之间不显著(P>0.01),冯家适用于商业化可能是由于实验过程中发酵菌株活力及富集时的含量高,导致冻干发酵剂的滴定酸度和活菌数的增大。冻干发酵剂酸乳酸甜适中、黏度厚实、色泽呈乳白色组织细腻均匀、无乳清的析出,感官评价91.60分,其黏度值和感官评价均与商业发酵剂呈极显著性差异(P<0.01)。风味物质一般在4 h左右产生,而酸乳的风味是由多种物质共同作用产生的结果[32],因此,冻干发酵剂长时发酵的酸奶其风味更加浓厚。

表6 冻干发酵剂检验结果Table 6 Results of fermentation performance on freeze-dried starter culture
注:不同大写字母表示每列数据间差异极显著(P<0.01)。
3 结论
牦牛乳不仅在蛋白质、脂肪和乳糖等营养价值均高于其他牛乳,而且是乳制品加工的最优原料之一[33],而牦牛乳中含有高产胞外多糖、产细菌素、耐酸和耐胆盐等性能良好的乳酸菌菌群,但针对牦牛乳的直投式发酵剂却无人问津,本研究将甘肃藏区牦牛乳酸奶中获得的一株嗜热链球菌[34]经诱变选育得到的高产EPS菌株进行功能性直投式发酵剂研究,通过冻干条件和保护剂的优良筛选,旨在开发用于牦牛乳酸奶的发酵剂。
通过正交试验优化,得到最佳牦牛乳直投式发酵剂制备条件为:选择pH为6.86的磷酸缓冲剂做缓冲剂培养、6 000 r/min离心10 min条件收集菌体、-20 ℃预冻处理和质量分数分别为150 g/L脱脂乳、10 g/L的谷氨酸钠、60 g/L的甘油和80 g/L的海藻糖作复合保护剂组合条件。最终表明嗜热链球菌单菌株发酵剂在牦牛乳发酵工业上具备良好的发酵特性,同时为功能性乳酸菌更好地服务于发酵工业和乳酸菌发酵剂的工业化制备与应用提供理论参考。
