鲈鲤仔稚鱼肠道形态发育及消化酶活性分析
2019-07-24严太明何治德阮会斌
严太明,李 松,2,何治德,3,何 亮,阮会斌,何 智*
(1.四川农业大学动物科技学院,成都 611130;2.广元市农业农村局,四川 广元 628000;3.泸州市农业农村局,四川 泸州 646000)
消化道发育直接关系到仔稚鱼的发育与生存,以及生长发育所需营养物质的消化、 吸收和繁殖等重要生命活动[1]。消化酶活性是消化系统结构完整和功能健全的重要评价指标[2-6],消化酶活性的提高,可以促进水产动物对营养物质的消化吸收,进而促进其生长发育[7]。因此,消化道发育研究能为掌握仔稚鱼营养需求特点、 优化投饵策略提供重要的参考依据[8],也有助于准确把握仔鱼开口时间和提高仔稚鱼成活率[4]。
鲈鲤(Percocypris pingi)隶属鲤形目鲤科(Cyprinidae)鲃亚科(Barbinae)鲈鲤属(Percocypris),是生活在淡水中的凶猛肉食性鱼类,主要分布于长江上游的干支流中[9-10]。目前,关于鲈鲤早期肠道形态发育和消化酶活性变化方面的研究未见报道。有鉴于此,本文采用形态学方法观察了鲈鲤仔稚鱼发育阶段肠道形态变化过程,通过常规石蜡切片法测定了其肠道黏膜褶皱高度,运用酶联免疫吸附法测定了鲈鲤仔稚鱼肠道胰蛋白酶、胰凝乳蛋白酶、α-淀粉酶和脂肪酶活性,旨在为鲈鲤早期发育生物学和消化生理提供基础资料,并为鲈鲤仔稚鱼配合饲料的开发提供依据。
1 材料和方法
1.1 材料来源及管理
鲈鲤受精卵由国电大渡河流域珍稀鱼类保护研究中心提供,于2018年4月2日孵化出膜。初孵仔鱼在消毒处理后的白色塑料箱(50 cm×40 cm×40 cm)中培育,水深 20 cm 左右,水温(20.6±0.7) ℃。当仔鱼开口摄食时进行饵料投喂[11],每天投饵3 次(时间:08:30;13:30;18:30),每次投喂足量剪碎的 3%盐水清洗后的水蚯蚓(Limnodrilus hoffeiteri),剪碎的长度随日龄增加逐渐增长[12]。
1.2 样本采集
1.2.1 肠道形态观察样本
全长和体重测量时间安排为 1、3、5、7、9、11、15、20、25、30、33、35、37、40、43、46、50、60、70、80 和 90 dah。参照刘亚秋等的报道[13],采集 1、3、5、7、11、25、30、33、35、46 和90 dah 鲈鲤仔稚鱼,每次随机取30 尾个体用MS-222(浓度为20.0 mg/L)麻醉后,使用SZM 体视显微镜对鲈鲤进行观察及拍照,记录其典型的发育形态特征(以50%以上的个体进入该发育阶段为准)。取样的前14 h 不投喂。同时选取307 dah 幼鱼肠道样本为对照,以确定肠道形态发育稳定期。
用电子游标卡尺测量鱼体全长 (total length,TL,mm)(精确度0.01 mm),用吸水纸吸干鱼体表水分后称重(body weight,BW,mg)(精确度 0.000 1 g),最后采用10%的中性福尔马林固定,用于肠道形态和肠黏膜褶皱高度结果观察。
1.2.2 消化酶活性样本
参照刘亚秋等的报道[13],并结合鲈鲤仔稚鱼肠道发育形态特征,选取 1、3、5、7、11、25、30、33、35、37和46 dah 鲈鲤仔稚鱼样品用于测量消化酶活性测定,每次取 60 尾。1~5 dah 取躯干;7 和 11 dah 去除头部、尾部和背部多余的肌肉,仅保留躯干部;25 dah之后在解剖镜下直接取出肠道。样本分装于经高温灭菌的10 个1.5 mL 离心管中,采用液氮速冻后转至-80 ℃的冰箱中,用于消化酶酶活性的测定。取样的前14 h 不投喂。
1.3 实验方法
1.3.1 鲈鲤肠道形态观察
根据王永明等[14]和张臣等[15]对鱼类肠道的分段方法,将鲈鲤肠道分为前肠、中肠和后肠。在解剖的过程中用佳能数码相机(型号:DS126431)对肠道进行拍照观察。
1.3.2 肠道黏膜褶皱高度分析
每个发育时期选取5 个鲈鲤仔稚鱼样本分离前、中和后肠用于肠道黏膜褶皱高度分析。按照常规石蜡切片法进行脱水、石蜡包埋、切片和苏木素-伊红染色。对每个样本的前、中、后肠随机选取5 张切片,每张切片选择6 个视野进行拍照,测定每个视野中至少5 个完整的肠道黏膜褶皱高度,取其平均值作为该肠段黏膜褶皱高度[16]。肠道黏膜褶皱高度采用形态学分析软件(JD 801,江苏捷达软件工程有限公司)进行统计。
1.3.3 消化酶比活力测定
每个发育时期选取5 管分装的鲈鲤仔稚鱼样本进行消化酶比活力测定。鲈鲤仔稚鱼的胰蛋白酶、胰凝乳蛋白酶、α-淀粉酶和脂肪酶比活力测定分别参照上海酶联生物技术有限公司研制的鱼胰蛋白酶试剂盒(ml064285)、鱼胰凝乳蛋白酶试剂盒(ml697451)、鱼α-淀粉酶试剂盒(ml036449)和鱼脂肪酶试剂盒(ml652113)操作说明书进行。
1.3.4 数据分析
2 结果与分析
2.1 鲈鲤仔稚鱼生长
在水(20.6±0.7) ℃[(19.2~22.6) ℃]条件下,鲈鲤初孵仔鱼全长(9.94±0.54) mm,90 dah 全长(42.08±2.50) mm,全长与日龄(days,d)的生长呈线性相关。初孵仔鱼体重(9.50±1.10)mg,90 dah 体重为(456.80±93.80) mg,体重与日龄(d)的生长关系为三项式。
2.2 肠道形态发育
鲈鲤初孵仔鱼肠道未分化,在鳔雏形期(5 dah)肠道开始贯通,在臀鳍形成期(33 dah)形态发育稳定,其发育过程经历了4 个发育阶段,具体发育过程描述如下。
肠管形成期(1~5 dah):初孵仔鱼[(9.54±0.54)mm]肠道未分化,心脏搏动 133 次/min,肌节34~36 节(图2A)。5 dah 仔鱼[(12.50±0.36)mm]肠道呈直管形且贯通,卵黄囊细长,可见鳔室雏形(图2B 和I)。肠道前部膨大期(11 dah):肠道前部膨大显著呈上翘形态(图2II)。此时,仔鱼脊椎形成,尾椎斜向上翘,背鳍褶前端隆起,背鳍原基呈三角形,尾鳍褶开始分化,边缘呈波纹状(图2C)。
肠道折点发育完成期:30dah 仔鱼[(21.96±1.21) mm]肠道中部出现明显上翘,肠道出现第一个折点(图2III)。33 dah 仔鱼[(23.56±1.33) mm]肠道呈“Z”形,形态上出现第二个折点,可分为前肠、中肠和后肠(图2IV)。
肠道形态发育稳定期:35~90 dah[(24.02±1.26)~(42.08±2.50) mm],肠道的形态发育基本稳定,呈“Z”形。307 dah 鲈鲤进入幼鱼期(图2H),稚鱼和幼鱼肠道形态差异不明显。
2.3 肠道黏膜褶皱高度
如表1所示,鲈鲤仔稚鱼(5~46 dah)的黏膜褶皱高度呈现前肠>中肠>后肠的变化趋势。背鳍形成期(30 dah,肠道出现第一个折点)时,前肠的黏膜褶皱高度[(618.96±48.63) μm]是背鳍形成期[25 dah,(343.15±25.92) μm,肠道呈直管形]的 1.8 倍,此后,随着个体发育仍呈逐步增高的趋势。中肠及后肠的黏膜褶皱高度变化趋势与前肠相似。

表1 鲈鲤肠道黏膜褶皱平均高度分析Table 1 Analysis of average height in intestinal mucosal fold of P.pingi
2.4 消化酶活性
在水温(20.6±0.7) ℃条件下,鲈鲤初孵仔鱼均能检测到胰蛋白酶、胰凝乳蛋白酶、α-淀粉酶和脂肪酶比活力。4 种消化酶比活力在整个早期发育阶段呈现先上升后下降的趋势。
出膜后胰蛋白酶比活力迅速上升,在鰾雏形期(5 dah)胰蛋白酶比活力出现第一个峰值[(381.86±106.30) U/mg protein](P<0.05)。之后,在肠道前部膨大的过程中,胰蛋白酶比活力再次迅速上升,而在肠管加粗的过程中呈下降趋势。在背鳍形成期(25 dah)时达到最低值[(223.87±62.01) U/mg protein],与孵出期仔鱼的胰蛋白酶比活力水平相似(P>0.05)。在肠道形态发育完成过程中(30~37 dah)胰蛋白酶比活力呈上升趋势,并在腹鳍形成期(37 dah)时达到最大值[(438.72±18.27) U/mg protein](P<0.05)(图3A)。
胰凝乳蛋白酶比活力在孵出期-臀鳍形成期[(1~33) dah]差异不显著(P>0.05)。腹鳍形成期(35 dah)之后,胰凝乳蛋白酶比活力显著增加到(16.91±3.64×10-3) U/mg protein,此后,胰凝乳蛋白酶比活力一直处于下降的趋势(图3B)。
α-淀粉酶比活力在孵出期-背鳍形成期(1~25 dah)差异不显著(P>0.05)。在臀鳍形成期时,α-淀粉酶比活力达到峰值(0.08±0.01) U/mg protein(图3C)。之后,α-淀粉酶比活力逐渐下降,在稚鱼期时,比活力[(0.04±0.01) U/mg protein]与孵出期仔鱼相似(P>0.05)。
脂肪酶比活力在孵出期-背鳍形成期差异不显著(P>0.05)。而在臀鳍形成期(33 dah)时显著增加,达到峰值[(0.12±0.02) U/mg protein](P<0.05)。随后脂肪酶比活力又逐渐下降,之后一直维持在(0.06±0.01)U/mg protein 水平(图3D)。
3 讨论与小结
鱼体内消化酶的发生并不是完全同步的,而是随着个体生长发育而演变[17]。研究个体发育过程中消化酶活性的变化对掌握仔稚鱼的营养需求、 制定投喂策略、 优化商业饵料的营养成分和提高成活率至关重要[5,18-19]。与红鳍笛鲷[5](Lutjanus erythopterus)、日本鬼鮋[19](Inimicus japonicus)、达氏鳇[2](Huso huso)和鲤[20](Cyprinus carpio)等的研究结果类似,本研究中胰蛋白酶、胰凝乳蛋白酶、α-淀粉酶和脂肪酶比活力在鲈鲤肠道未分化(1 dah,孵出期)时就能检测到,具备了消耗内源性营养物质的能力,这表明鲈鲤消化酶的发生受自身基因的调控,而并非是饵料所诱导[17,21-22]。
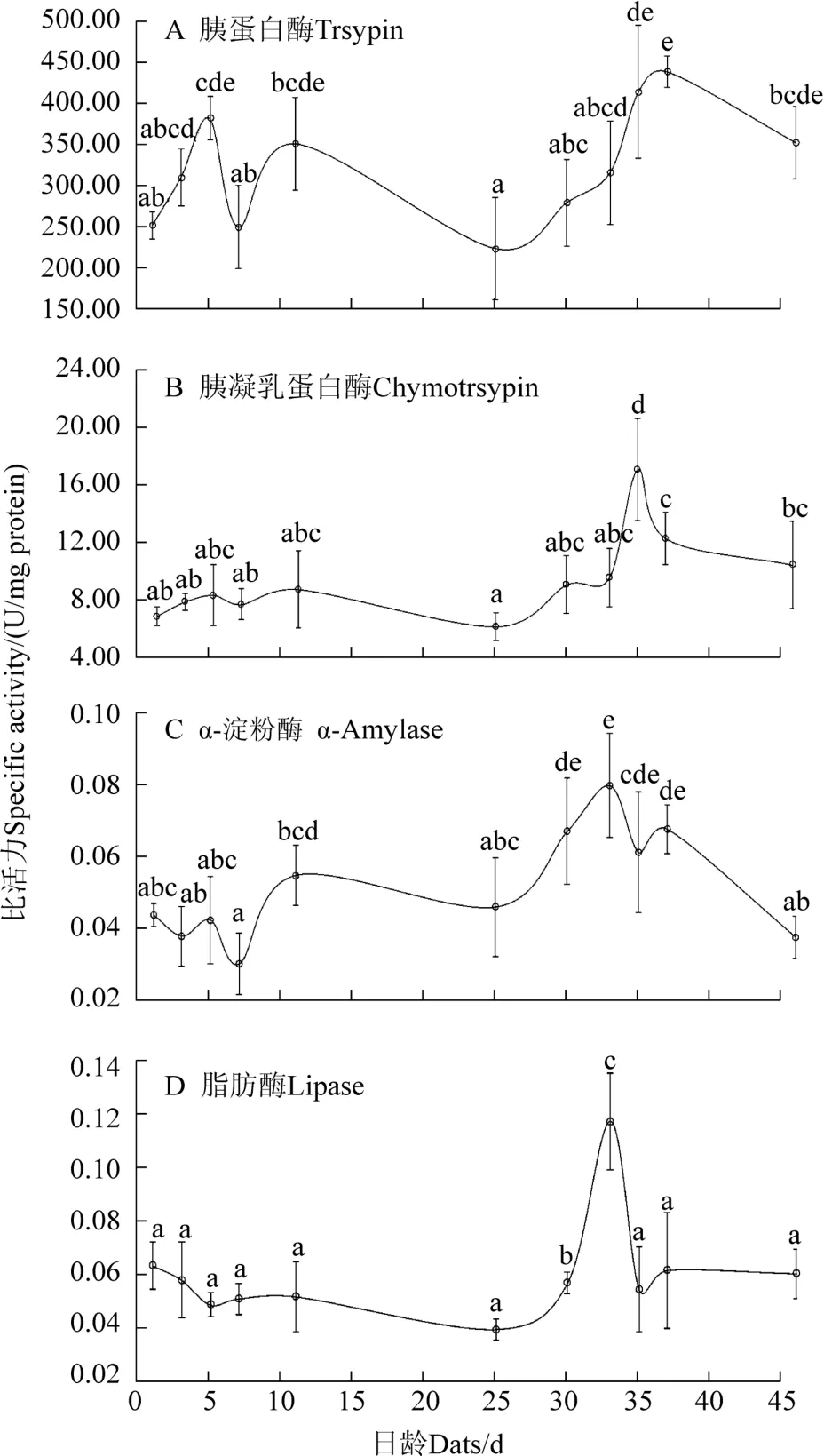
图3 鲈鲤仔稚鱼胰蛋白酶(A)、胰凝乳蛋白酶(B)、α-淀粉酶(C)和脂肪酶(D)比活力Figure 3 the activity of trypsin(A),chymotrypsin(B),amylase(C) and lipase(D) in P.pingi
本研究中,鲈鲤胰蛋白酶和胰凝乳蛋白酶比活力整体上呈现先上升后下降的变化趋势,而这种变化规律被认为是脊椎动物包括鱼类个体发育的一个明显特征[23]。这种类似的现象在尖吻鲈[24](Lates calcarifer)、豹纹喙鲈[25](Mycteroperca rosacea)和双斑绚鲇[26](Ompok bimaculatus)等鱼类中也存在。在鲈鲤肠道贯通且肠道黏膜褶皱出现(5 dat,鰾雏形期,开口摄之前)时,胰蛋白酶和胰凝乳蛋白酶比活力呈上升趋势,这可能是由于仔鱼从内源性营养向外源性营养转化前,增强仔鱼消化酶活力,为提升自身消化能力的准备[27]。此外,与斑马鱼[28](Barchydanio rerio)、绯小鲷[29](Pagellus erythrinus)和鲨鲷[30](Diplodus puntazzo)等的报道类似,鲈鲤在肠道形态变化之前,胰蛋白酶和胰凝乳蛋白酶比活力呈下降趋势,而在肠道形态变化过程中,肠道黏膜褶皱高度显著增加,胰蛋白酶和胰凝乳蛋白酶比活力显著增加。这表明,鲈鲤肠道形态发育过程中,需要大量可溶性蛋白质的积累[13,31],从而为适应消化道结构变化和功能的完善做足准备。
本研究发现,在鲈鲤肠道发育未完善之前,α-淀粉酶比活力呈逐渐上升的趋势,之后随着肠道发育的逐渐完善而比活力也逐渐降低,类似的研究结果在日本鬼鮋[19]等其他肉食性鱼类中也有报道。此外,在尖吻鲈和大黄鱼(Pseudosciaena crocea)肠道发育完善的过程中,α-淀粉酶比活力也会出现下降的趋势[23,32]。这些结果表明,α-淀粉酶比活力的变化与肠道发育完善程度有着密切联系。随着肠道功能的完善,鲈鲤的食性也在开始进行逐步的转换。
本研究中鲈鲤脂肪酶比活力呈现先上升后下降,最后进入平台期稳定的变化规律。在鲈鲤肠道形态结构变化过程中,肠道黏膜褶皱高度显著增加,脂肪酶比活力显著上升,而在结构基本完善后,脂肪酶比活力趋于稳定。鲈鲤脂肪酶比活力的这种变化趋势,与泥鳅[33](Misgurnus anguillicaudatus)和瓦氏黄颡鱼[34](Pelteobagrus vachelli)的研究结果相似,这可能是受食物摄入量变化和可溶性蛋白沉积影响[35]。而鲈鲤脂肪酶是否是肠道消化酶中最早稳定的,其是否可以作为肠道发育完善的指标,还需要进一步探讨。
综上,在鲈鲤仔稚鱼在发育过程中,胰蛋白酶比活力显著高于胰凝乳蛋白酶、α-淀粉酶和脂肪酶的比活力,表明鲈鲤对蛋白质具有较高的消化能力,故建议在鲈鲤仔稚鱼阶段多投喂动物性或高蛋白水平的饵料。同时,鲈鲤在背鳍形成期-臀鳍形成期(30~33 dah)期间,肠道的形态和组织结构变化最大,消化酶比活力也成显著上升的趋势。此后,肠道发育完善,α-淀粉酶活力显著降低,脂肪酶比活力趋于稳定。这就提示,在培育苗种的过程中应该加强肠道形态变化阶段食物营养的供应,优化投饵策略。
