小麦 G6PDH基因的生物信息学分析及其低温胁迫下苗期的表达特征
2019-07-24彭瞰看宋春华包雨卓徐庆华
田 宇,彭瞰看,宋春华,于 萍,刘 楠,包雨卓,孟 婧,徐庆华,苍 晶
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
植物在光照条件下,其绿色组织通过光合作用产生烟酰胺腺嘌呤核苷酸磷酸(NADPH),并用于碳固定、脂肪酸合成和氮同化等过程。然而,当植物在黑暗中生长时,光合或非光合组织通过氧化戊糖磷酸途径(OPPP)生成NADPH[1-2]。葡萄糖-6-磷酸脱氢酶(G6PDH-EC 1.1.1.49)是戊糖磷酸途径的限速酶,能够催化6-磷酸葡萄糖氧化生成6-磷酸葡萄糖酸-δ-內酯,同时生成NADPH[3]。NADPH通过与其他抗氧化酶的相互作用清除有害的活性氧,从而维持细胞的氧化还原平衡[4]。叶建仁和黄素红发现松树G6PDH活性高的针叶抗病性高于其他针叶[5]。Zhang等[6]发现马铃薯花叶病毒侵染烟草,会使烟草胞质和质体中G6PDH活性升高。当植物遭受低温[7]、干旱[8]、盐[9]等非生物胁迫时,其组织的G6PDH活性也均增加。可见,G6PDH在植物抵御生物及非生物胁迫时发挥重要作用。G6PDH分为细胞质G6PDH(cy-G6PDH)和质体G6PDH两类,分别存在于胞质和质体中[10],其中质体G6PDH又有P1(P1-G6PDH)和P2(P2-G6PDH) 两种亚型[11],不同亚型的G6PDH活性有所差别[12-13]。胞质亚型与质体亚型对还原力敏感性不同[14-15],质体中P1-G6PDH又比P2-G6PDH对NADPH更敏感[16-17]。各亚型G6PDH是否发挥作用以及如何发挥作用,与其存在的位置及周围环境有关。
小麦(Triticumaestivum)生长过程中会受到低温、干旱、盐碱、重金属、病虫害等各种生物及非生物胁迫,进而影响产量[18]。东农冬麦1号是东北农业大学自主培育的能克服黑龙江地区高寒气候条件的强耐寒小麦品种。从实验室前期东农冬麦1号的MicroRNA库-靶基因KEGG通路分析中可知,G6PDH在低温胁迫下差异表达[19],因此判断G6PDH在冬小麦抗寒性方面发挥着重要作用。本研究从Ensemble plants数据库中(http://plants.ensembl.org/index.html)获得 G6PDH蛋白序列及其基因序列,运用生物信息学手段对其基因结构进行分析,在此基础上对小麦 G6PDH蛋白进行分类及理化性质分析,同时对低温胁迫下强抗寒冬小麦品种东农冬麦1号和弱抗寒冬小麦品种济麦22的分蘖节及叶片中该酶基因不同亚型的表达模式进行定量分析,以期为深入探究G6PDH在小麦抗寒性方面的功能奠定理论基础。
1 材料与方法
1.1 材 料
试验所用冬小麦为强抗寒性品种东农冬麦1号和弱抗寒性品种济麦22,于2016年9月13日播种于东北农业大学试验田中,完全区组设计,3次重复,行长2 m,行距0.2 m,10行区。播种量450粒·m-2,播深5 cm,常规田间管理。待大田自然降温,连续10 d最低温度平均为5 ℃(对照温度,2016年10月8日)、0 ℃(2016年10月25日)、-10 ℃(2016年11月9日)和-25 ℃(2017年1月11日)时,随机选取长势一致的麦苗,剪取分蘖节和叶片,液氮速冻,-80 ℃ 保存备用。
1.2 方 法
1.2.1 G6PDH序列的获取与鉴定
从NCBI(http://www.ncbi.nlm.nih.gov/)获得G6PDH典型结构域序列,以其为标准序列,在Ensemble plants数据库(http://plants.ensembl.org/index.html)、水稻基因组数据库(http://rice.plantbiology.msu.edu/index.shtml)、TAIR (https://www.arabidopsis.org/)上进行blast同源序列比对,分别获得小麦(Triticumaestivum)、水稻(Oryzasativa)、拟南芥(Arabidopsisthaliana)中显著同源的 G6PDH蛋白序列。利用在线工具 SMART (http://smart.embl-heidelberg.de/)和Pfam (http://pfam.xfam.org/)对候选 G6PDH蛋白序列进行保守结构域分析,去除不包含G6DPH结构域的蛋白序列,再利用软件DNAMAN 8.0分别对3个物种的 G6PDH蛋白序列进行比对,去除冗余序列。随后在基因组数据库中获取小麦 G6PDH蛋白相应的基因序列。
1.2.2 生物信息学分析
利用ProtComp 9.0 (http://linux1.softberry.com/berry.phtml)对候选小麦 G6PDH蛋白进行亚细胞定位分析。通过在线分析工具ExPASy-ProtParam (http://web.expasy.org/protparam/)预测 G6PDH蛋白的基本理化性质。利用在线预测软件NPS-SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测G6PDH的二级结构,统计G6PDH二级结构中α-螺旋、β转角、无规则卷曲和延伸链等结构所占的百分比。用ExPASy-SWISS MODE (http://swissmodel.expasy.org/)预测 G6PDH蛋白的三级结构。利用MEGA 6.0软件中的邻接法算法(Neighbor-Joining)将获得的小麦 G6PDH蛋白序列分别与水稻、拟南芥中的同源蛋白序列构建系统进化树,设置参数为:Bootstrap进行1 000次检验并去除支持率低于50%的节点,选取P-distance模型,Pairwise Deletion处理数据缺失。通过Ensemble plants数据库获得TaG6PDH基因全序列及CDS序列,利用GSDS (http://gsds.cbi.pku.edu.cn/)对TaG6PDH基因的结构进行分析。通过MEME (http://meme.nbcr.net/meme/)对 G6PDH蛋白进行保守Motif分析,设置参数为:Motif长度20~50个字符,最多可检测到15个,并且允许显示重复位点。
1.2.3 总RNA的提取与cDNA第一链的合成
利用Ultrapure RNA kit(康为世纪,北京)分别提取越冬期分蘖节与叶片的总RNA。通过PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(TaKaRa,日本)进行cDNA第一链的合成。具体操作步骤参照试剂盒说明书。
1.2.4TaG6PDH基因的qRT-PCR分析
从小麦G6PDH三种亚型中各选取一个基因进行qRT-PCR分析。根据TaG6PDH4(胞质亚型)、TaG6PDH5(P1亚型)、TaG6PDH11(P2亚型)基因序列设计实时定量引物(表1),以Actin作为内参基因,在Mx-3000p Real-time PCR System(吉泰生物,上海)利用ChamQ Universal SYBR qPCR Master Mix(诺唯赞,南京)对基因进行qRT-PCR分析,反应体系及程序参照试剂说明书。每个基因的表达分析均进行3次生物学重复,基因相对表达水平采用2-△△CT法进行 计算。数据显著性分析利用SPSS软件进行 计算。
2 结果与分析
2.1 小麦、水稻、拟南芥G6PDH同源序列的获取
从NCBI上获取 G6PDH蛋白的保守结构域PLN02539的氨基酸序列,随后在小麦基因组数据库上进行blastp同源比对,获得26条蛋白同源序列,随后通过在线工具SMART和Pfam去除不包含保守结构域的序列,再通过DNAMAN 6.0比对去除冗余序列,最终确定12条候选序列,分别命名为TaG6PDH1~12(表2)。随后用相同的方法在水稻数据库进行blastp同源比对,筛选后获得4条水稻 G6PDH蛋白序列,分别命名为OsG6PDH1~4 (Acc:Os02g38840、Os07g22350、Os03g29950、Os03g20300)。最后在拟南芥基因组数据库(TAIR)中下载 G6PDH蛋白序列,共6条,分别命名为AtG6PDH1~6(Acc:AT5G35790、AT5G13110、AT1G24280、AT1G09420、AT3G27300、AT5G40760)。

表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequences
2.2 G6PDH蛋白的亚细胞定位及理化性质分析
ProtComp 9.0分析表明,小麦 G6PDH蛋白只存在于细胞质和质体两个部位。这12条小麦 G6PDH蛋白,只有3条定位在细胞质,其余9条皆定位在质体中。利用ExPASy-ProtParam分析12条蛋白的理化性质(表2),可以看出所有序列都含有20种氨基酸,序列长度在448~920 aa之间,最短的为TaG6PDH10和TaG6PDH11,最长的为TaG6PDH7。相对分子质量最大的是TaG6PDH7(103.22 kDa),最小的是TaG6PDH3 (50.95 kDa)。理论等电点最低的是TaG6PDH6(4.98),最高的是TaG6PDH9 (8.77),其中等电点>7的有5条,<7的有7条。氨基酸不稳定指数均大于40,均为不稳定蛋白质。平均亲水性系数均为负值,可见这12条蛋白质均为亲水蛋 白质。
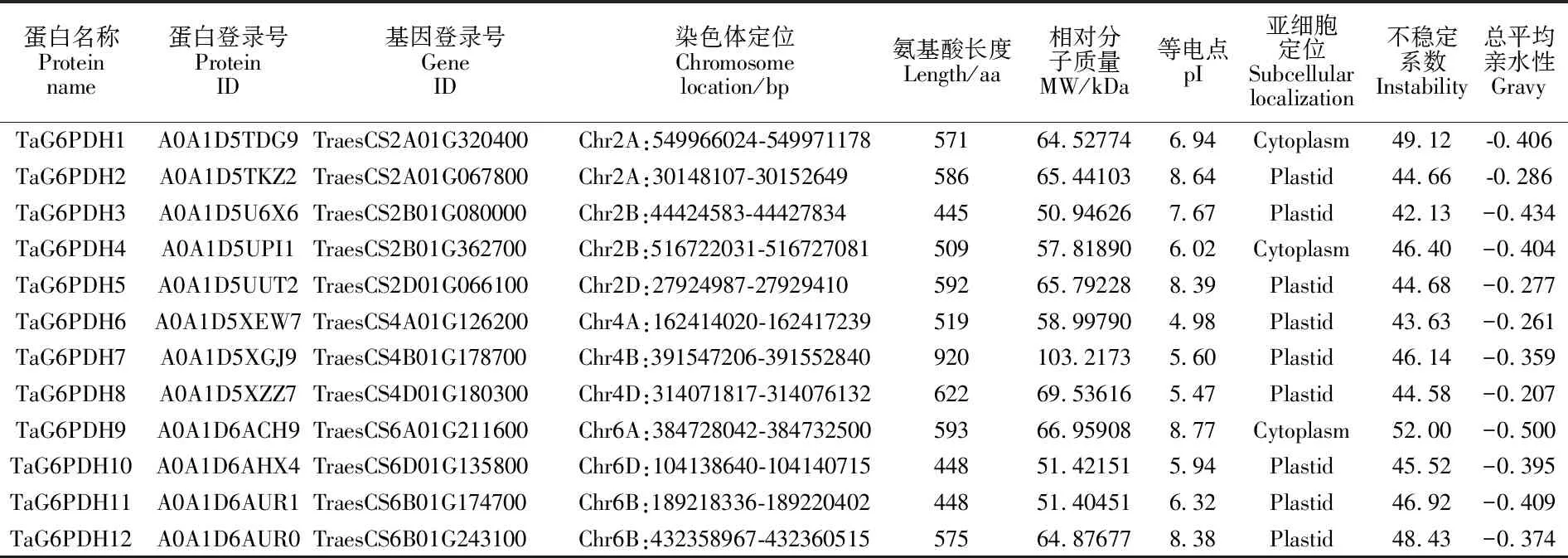
表2 G6PDH的理化性质Table 2 Physicochemical parameters of G6PDH
MW:分子量; pI:等电点。
MW:Molecular weight; pI:Isoelectric point.
2.3 TaG6PDH蛋白的二级及高级结构预测
蛋白二级结构是连接一级和高级结构的重要纽带和桥梁。利用SOPMA对小麦TaG6PDH蛋白进行二级结构预测,结果发现TaG6PDH蛋白二级结构主要由α-螺旋、延伸链、β转角和无规则卷曲4种成分组成(表3)。其中α-螺旋、无规则卷曲为主要成分,延伸链、β转角相对较少。α-螺旋含量最高的是 TaG6PDH3,最低的是TaG6PDH9,无规则卷曲含量最高的是TaG6PDH12,最低的是 TaG6PDH7。以TaG6PDH1为例绘制二级结构图,表明α-螺旋、无规则卷曲是构成 G6PDH蛋白的主要元件。
随后利用SWISS-MODEL对TaG6PDH蛋白质的三级结构进行预测,结果与二级结构相一致,α-螺旋、无规则卷曲依旧是主要的结构元件,占据了很大一部分空间(图略)。

表3 TaG6PDH蛋白的二级结构预测Table 3 Predicted secondary structure of TaG6PDH proteins
2.4 G6PDH蛋白的进化分析
将小麦、水稻、拟南芥 G6PDH蛋白进行系统发生树的构建来分析它们之间的进化关系(图1)。结果,G6PDH蛋白被分为4组,每组中都存在TaG6PDH、AtG6PDH、OsG6PDH。此外,还发现系统发生树中有4对姐妹组合,分别是TaG6PDH3-TaG6PDH5、TaG6PDH11-TaG6PDH12、TaG6PDH6-TaG6PDH8、TaG6PDH1-TaG6PDH4。
2.5 小麦 TaG6PDH基因结构分析
12条小麦TaG6PDH基因大体可以分为4组(图2),其中TaG6PDH2、 TaG6PDH3、TaG6PDH5为第1组,它们的基因结构都是由4个外显子与3个内含子构成。TaG6PDH10、TaG6DPH11、TaG6PDH12为第2组,其中TaG6PDH10、TaG6PDH11都由5个外显子与4个内含子构成,只有TaG6PDH12是由4个外显子与3个内含子构成。TaG6PDH6、 TaG6PDH7、TaG6PDH8为第3组,都是由6个外显子与5个内含子构成。第4组由TaG6PDH1、TaG6PDH4、TaG6PDH9组成,这3条基因的结构没有明显规律,这可能与其在植物体内行使主要功能有关。
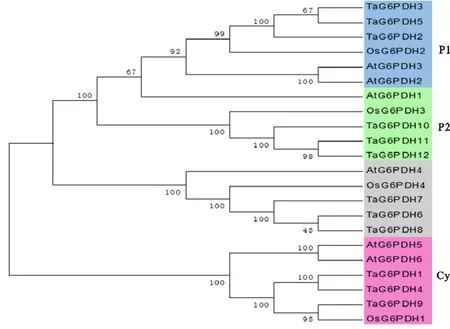
图1 G6PDH蛋白的进化树
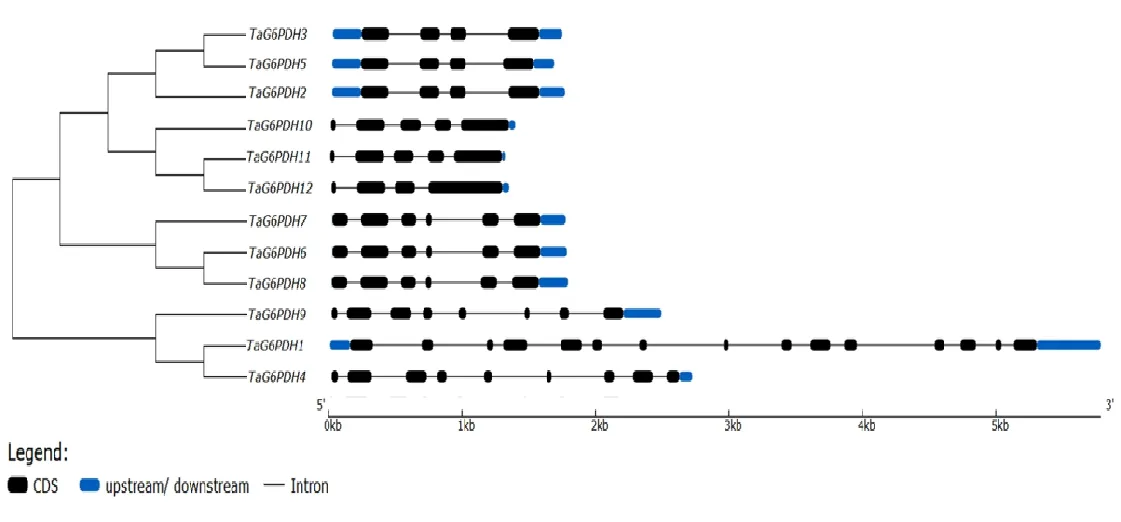
图2 小麦 G6PDH基因的结构
2.6 TaG6PDH蛋白的保守Motif分析
通过在线分析软件MEME (http://meme.nbcr.net/meme/)对 G6PDH蛋白进行保守Motif分析(图3),结果可见,这15个Motif的长度范围在20~50之间,通过Pfam上预测,可以发现Motif1~10中都存在G6PD_C结构域,Motif1、2、3、4、5、6、7、8、10均存在于12条 G6PDH蛋白中。与这9个Motif相比,Motif11只存在于 TaG6PDH3、TaG6PDH6、TaG6PDH11中;Motif12只存在于 TaG6PDH7、TaG6PDH8中;Motif13只存在于TaG6PDH2、TaG6PDH5中;Motif14只存在于TaG6PDH8中;Motif15只存在于TaG6PDH1、TaG6PDH4中。而Motif 9既不普遍存在于12条G6PDH蛋白中,也不个别存在于某几个蛋白中。此外Motif3中存在底物结合位点(RIDHYLGKEL),Motif4中存在NADP+结合位点(NEFVIRVQP)[11],这2个Motif都保守存在于12条TaG6PDH蛋白中。

图3 小麦 G6PDH蛋白的保守Motif
2.7 低温胁迫下 TaG6PDH的表达特征分析
分别从小麦G6PDH不同亚型中选取了3个基因(TaG6PDH4、TaG6PDH5、TaG6PDH11)进行低温胁迫下的表达模式分析。表4中东农冬麦1号和济麦22分蘖节及叶片中基因表达量均以 5 ℃为对照。胞质亚型TaG6PDH4在两个冬小麦品种的分蘖节和叶片中的表达量均随着温度的降低而逐渐升高,并且都在-10 ℃时快速升高,-25 ℃达到最大值。P1亚型TaG6PDH5在两个冬小麦品种的分蘖节中,随着温度的降低,表达量呈现先升高后降低的趋势,在-10 ℃时达到最高;而在叶片中,基因表达量的变化则是呈现逐渐升高的趋势,同样在-10 ℃开始快速升高, -25 ℃达到最大值;从表达量变化倍数上可以看出,TaG6PDH5叶片中的表达量要高于分蘖节。P2亚型TaG6PDH11在两个冬小麦品种分蘖节和叶片中的表达量变化随着温度的降低虽然也呈现上升的趋势,但变化倍数明显低于前两个基因(表4)。从3个基因的表达模式中可以看出,TaG6PDH的不同亚型随着温度的变化以及组织部位的不同,基因表达模式也有所区别。
3 讨 论
本研究表明,小麦 G6PDH蛋白只存在于细胞质与质体中,这与前人的报道结果一致[20];所分析的12条小麦 G6PDH蛋白中,有3条定位在细胞质,9条定位在质体,即质体中的同工酶数量大于细胞质中同工酶的数量,这与其他植物中 G6PDH蛋白的分布规律相一致[21]。
系统发生树中拟南芥、小麦和水稻的G6PDH具有很近的亲缘关系,证明G6PDH在进化上高度保守[22]。从先前报道中可知,拟南芥AtG6PDH5、 AtG6PDH6属于胞质亚型; AtG6PDH1属于质体P1亚型;AtG6PDH2、 AtG6PDH3属于质体P2亚型; AtG6PDH4比较特殊,定位在质体中,但并不属于P1、P2任何一种亚型[23]。因此,从进化关系上可以推断小麦的TaG6PDH1、TaG6PDH4、TaG6PDH9属于胞质亚型;TaG6PDH2、 TaG6PDH3、TaG6PDH5属于P1亚型;TaG6PDH10、TaG6PDH11、TaG6PDH12属于P2亚型。小麦的TaG6PDH6、 TaG6PDH7、TaG6PDH8与拟南芥的 AtG6PDH4亲缘关系较近,推断这3条蛋白定位于质体,但并不属于已知的任何一种亚型,具体功能有待后续研究。小麦不同亚型的TaG6PDH基因结构也有所差别,主要表现在外显子与内含子数量上的变化,这可能是由结构性的分化机制所导致的,例如,外显子和内含子的插入或缺失以及外显子化和伪外显子化[24]。12条小麦TaG6PDH蛋白Motif排列大体相近,Motif3中存在的底物结合位点(RIDHYLGKEL)与Motif4中存在的NADP+结合位点(NEFVIRVQP),保证了TaG6PDH蛋白的基础功能。

表4 低温胁迫下 TaG6PDH基因的表达模式Table 4 Expression patterns of TaG6PDH under cold stress
同一基因、同一列数据后的大、小写字母不同分别表示不同温度处理之间的差异达到了0.05和0.01显著性水平。
The upper and lower case letters within the same gene and the same column following the data indicate significant differences between different temperature treatments at 0.05 and 0.01 levels.
低温胁迫下两个冬小麦品种分蘖节中胞质亚型TaG6PDH4的基因表达量呈现逐渐升高的趋势,并且基因表达量变化倍数要远高于其他两种亚型的TaG6PDH基因,表明胞质亚型TaG6PDH4在冬小麦响应低温胁迫时发挥了主要作用。有文献报道,P1亚型在叶片等绿色组织中表达较高[25]。本实验中,低温胁迫下P1亚型TaG6PDH5基因在分蘖节中虽也有较高表达,但与其在叶片中的基因表达量变化相比依旧有很大差距,因此可以推断,低温胁迫下P1亚型 TaG6PDH主要是在叶片等绿色组织中发挥作用;而P2亚型TaG6PDH11基因表达量在分蘖节及叶片中都没有较大的变化,但整体趋势依旧是随着温度的降低而升高,可见,不同亚型的TaG6PDH对温度胁迫反应不同,但总体表现为 TaG6PDH在小麦抗寒方面发挥正向积极作用。东农冬麦1号是强抗寒冬小麦品种,而济麦22号则是弱抗寒品种,无论是在分蘖节还是叶片中,3种亚型的TaG6PDH基因在东农冬麦1号中的表达量变化倍数都要远高于济麦22,因此,可以认为TaG6PDH表达量变化可以作为判断小麦抗寒强弱的一种指标。
