小麦株高和旗叶相关性状的QTL定位
2019-07-24董中东
王 盈,赵 磊,董中东,任 妍,张 宁,陈 锋
(河南农业大学农学院/省部共建小麦玉米作物学国家重点实验室/河南粮食作物协同创新中心,河南郑州 450046)
小麦株型是指小麦植株地上部分的生长态势,包括株高、旗叶长宽、茎节比、分蘖数和分蘖夹角等[1-2],是诸多重要农艺性状的综合体现,直接影响小麦的适应性、产量和收获指数。张兰萍等[3]研究表明,理想的株型能改善植株和群体的受光态势,减少群体间的竞争力,提高光能利用效率和收获指数,增加籽粒同化物的积累,从而提高作物产量。株高是小麦最易观测的农艺性状,与小麦的抗倒伏能力密切相关,间接影响小麦产量;旗叶是小麦植株上最后长出来的一片叶子,影响着小麦后期的生殖生长,特别是对小麦籽粒形成起着很重要的作用,小麦籽粒成熟过程中积累的糖类约50%来自旗叶,因此旗叶性状也直接关乎小麦产量[4]。综上所述,株高和旗叶是与小麦生长发育相关的重要农艺性状,与小麦抗逆、产量密切相关,是小麦高产育种的重要目标性状。对株高和旗叶长宽等株型相关性状进行QTL遗传研究,不仅能加深对小麦株型遗传机理的认识,同时还可以为小麦株型改良育种提供重要的参考。
目前国内外已有许多学者利用不同遗传分离群体围绕株高和旗叶性状的遗传机制和QTL定位开展了大量工作,取得了一定进展。对株高而言,Cadalen等[5]利用中国春和Courtot为亲本构建的DH群体检测到9个控制株高的QTLs,其中两个RFLP标记(Xfba1-4B和Xfba211-4D)分别与矮秆基因Rht-B1b和Rht-D1b连锁,其余QTL可以分别解释11.9%~19.1% 的表型变异;张坤普等[6]利用DH群体也检测到9个控制株高的QTLs,其中两个(Qph4B和Qph4D)与Rht1(Rht-B1b)和Rht2(Rht-D1b)位置相同,其余QTL可以分别解释2.84%~20.22%的表型变异;刘冬成等[7]利用矮秆冬小麦品系ND3338和F390杂交得到的F2:3群体,在四个环境中共发现了7个影响株高的QTLs,单个QTL可解释5.2%~37.2%的表型变异,其中4B染色体上一个主效QTL与Rht-Blb位置一致;周淼平等[8]用望水白与墨西哥小麦品种Alondra杂交构建的重组自交系在三个环境下检测到4个影响小麦株高的QTLs,分别位于1D、2B、4A和4D染色体上,单个QTL能够解释10.3%~33.8%的表型变异,其中4D染色体上的主效QTL推测是Rht-D1b基因。前人研究结果中,能重复被检测到且效应较大的主效QTLs大多都指向已知的Rht基因,表明Rht基因为株高的主效调控基因,但它们并不能解释株高带来的所有变异,且目前仅有部分被克隆出,仍需进一步挖掘出更多的、稳定的株高调控位点来加深对株高遗传机理的认识。
与株高相比,目前对小麦旗叶性状的遗传研究相对较少,但也取得了一些进展。常 鑫等[9]以小偃81和西农1376构建的RIL群体为材料,在多个环境中检测到多个控制旗叶长、宽和面积的QTLs;闫 雪等[10]利用以旱选10号和鲁麦14构建的DH群体,在干旱胁迫和正常灌溉条件下检测到多个控制旗叶长、宽及面积的QTLs,其中部分表现为一因多效;连俊方等[11]以周8425B和小偃81构建的重组自交系为材料,结合90K 基因芯片技术,也在不同染色体上检测到了多个旗叶相关性状QTLs,并鉴定出3个QTL富集区段及一因多效QTL;吕学莲等[12]利用宁春4号和Drasdale构建的RIL群体,在正常灌溉和不同干旱胁迫共3种处理下,共检测到了22个控制旗叶大小的QTLs,并推测部分QTL可能具有一因多效;Liu等[13]利用由小麦品种ND3331和西藏半野生小麦Zang 1817构建的RIL群体为材料,同样定位到了多个控制旗叶不同性状的一因多效QTLs。分析先前研究结果发现,其中仅有很少的QTL定位结果一致,且效应值普遍不高,表明旗叶相关性状受微效多基因位点控制,且易受外界因素影响,虽然定位技术日渐完善,但目前仍未有相关基因图位克隆的报道,还需继续加强对旗叶相关性状调控位点的发掘。
小麦株型相关性状大多为复杂的数量性状,虽然目前针对株高和旗叶性状已经开展了大量的遗传研究工作,但广度和深度还远远不够,不能满足育种生产实践的需要。本研究以小麦品系SHA3/CBRD和Naxos杂交获得的F10代重组自交系为材料,调查其在2年3个环境下的株高、旗叶长和旗叶宽等株型相关性状的表型值,并进行QTL定位分析,以期进一步挖掘小麦株型相关性状的QTL,实现小麦株型相关QTLs的精细定位和定向改良,为培育株型合理、高产小麦新品种提供有价值的参考信息。
1 材料与方法
1.1 试验材料
本研究选用以Shanghai 3/CBRD和Naxos为亲本进行杂交、通过单籽传法创制的含有137个家系的F10代重组自交系群体为试验材料,该群体F6家系由挪威生命科学大学的Morten Lillemo教授提供,后经河南农业大学农学院小麦分子育种实验室繁育选择而成。该群体亲本间株高及旗叶性状差异显著,且群体家系间分离明显。参试材料于2015-2016年度种植于郑州(E1),2016-2017年度种植于郑州(E2)和原阳(E3)。两年种植均采用2行区,行长1.5 m,行距25 cm,株距5 cm。在整个生育期进行正常的田间管理。
待试验材料进入灌浆期且生长稳定后,测量株高、旗叶长和旗叶宽。调查时每个株系随机选取10株,对主茎穗进行测量,取平均值并保留两位小数点作为相应性状的表型数值(表1)。
1.2 试验方法
1.2.1 DNA提取及PCR扩增
采用十二烷基肌氨酸钠法(SLS法)[14]提取RIL群体双亲及137个家系的基因组DNA。选取952对SSR引物在双亲间进行筛选,最终筛选出373对能够覆盖小麦21条染色体的多态性引物,利用其对群体各株系进行基因型鉴定,引物信息来源于GrainGenes(https://wheat.pw.usda.gov/GG3/),由上海生工生物工程有限公司合成。PCR体系与程序参考2×Taq PCR MasterMix(天根,北京)说明书,其中循环数为35,退火温度根据具体引物设定,延伸时间为1 min。PCR扩增产物用6%变性聚丙烯酰胺凝胶电泳进行检测。
1.2.2 数据统计分析
利用Microsoft Excel 2010软件对亲本表型值进行描述性统计。利用SPSS 20.0软件对亲本及RIL群体各表型数值进行差异显著性分析。
1.2.3 遗传连锁图谱构建与QTL分析
通过PCR扩增及电泳检测,分析鉴定由Shanghai 3/CBRD和Naxos构建的F10重组自交系(RIL)每一个品系的基因型,利用QTL IciMapping 4.1.0.0软件,LOD阈值设定为2.5,进行遗传连锁分析,并构建遗传连锁图谱。结合表型数据,设置步移距离为1cM,PIN为0.001,采用完备区间作图法(ICIM-ADD)进行QTL定位分析,QTL的命名按照Mccouch等[15]的方法命名,即“Q+性状名称英文缩写+“-”+染色体编号”。
2 结果与分析
2.1 亲本及RIL群体株高和旗叶性状的表型变异
对参试RIL群体表型数据进行分析,结果表明,RIL群体的双亲SHA3/CBRD和Naxos在株高、旗叶长和旗叶宽上均存在显著性差异(表1)。同时,所考察性状的表型值在RIL群体中的变异系数均大于10%,表明所考察性状的表型在该群体中的变异较丰富,变异范围较广;同时根据所考察性状表型的频率分布和偏度、峰度检验结果可以看出,不同环境下各考察性状表型频率分布均呈现正态或近似正态的连续分布(表2,图1),适合进行QTL检测。

表1 Shanghai 3/CRBD和Naxos的表型差异Table 1 Phenotypic variation of Shanghai 3/CBRD and Naxos
表中同列数字后大、小写字母不同分别表示在0.01和0.05水平上差异显著。
The small and capital letters following data indicate significant difference at 0.05 and 0.01 level, respectively.
2.2 QTL定位
2.2.1 株高的QTL定位
利用完备区间作图法,在3个环境中共检测到1个株高相关QTL,位于6A染色体上,将其命名为Qph-6A;此QTL在3个环境中均可被检测到,表现稳定一致,所在标记区间为XwPt2153~XwPt0832,标记间遗传距离为5.11 cM,在3个环境下能够解释的表型贡献率分别为 13.93%、8.33%和8.35%(表3,图2);该QTL在3个环境中的加性效应值分别为-5.53、-4.18和 -3.97(表3),均为负值,表明其增效等位基因来自低值亲本Shanghai 3/CBRD。
2.2.2 旗叶性状的QTL定位
在3个环境中共检测到1个旗叶长的QTL,位于6A染色体上,将其命名为Qfll-6A;该QTL在2个环境中(E1和E2)可被检测到,所在标记区间为Xgwm169~Xwpt6829,标记间距离为17.2 cM,加性效应值均为1.02,对表型的贡献率分别为8.10%和8.18%,平均贡献率为8.14%(表3,图2)。
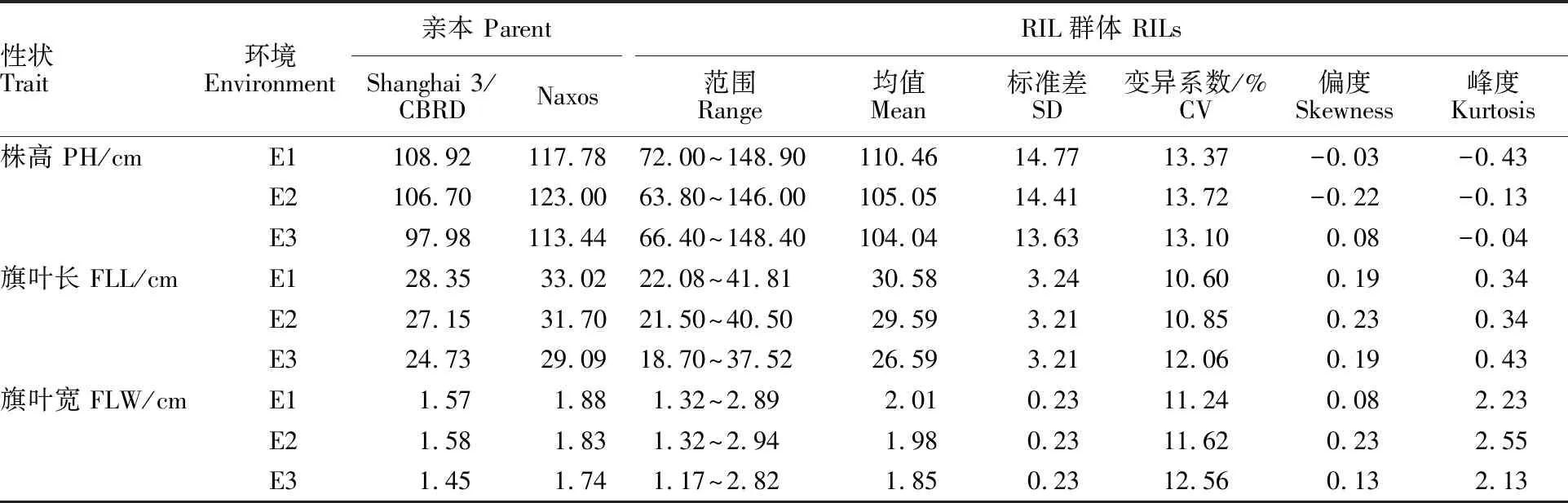
表2 RIL群体在不同环境下株高和旗叶性状的变异分析Table 2 Variance analysis of plant height and flag leaf traits in RILs in different environments
PH:Plant height;FLL:Flag leaf length;FLW:Flag leaf width.The same below.

ZZ:郑州;YY:原阳。下同。
ZZ:Zhengzhou; YY:Yuanyang.The same below.
图1 不同环境下小麦RIL群体株型相关性状的频率分布
Fig.1 Frequency of plant architecture related traits in wheat RILs under different environments
在3个环境中共检测到2个旗叶宽的QTL,分别命名为Qflw-2B.1和Qflw-2B.2,所在标记区间分别为Xbarc159~XwPt5017和XwPt8284~Xbarc159,对表型的贡献率分别为9.14%和9.46%,其加性效应值均为0.07(表3,图2);同时,这2个QTL的定位区间含有一个相同标记,因此推测这2个QTL可能为同一个QTL,将其记为Qflw-2B,标记间距离为2.75 cM。
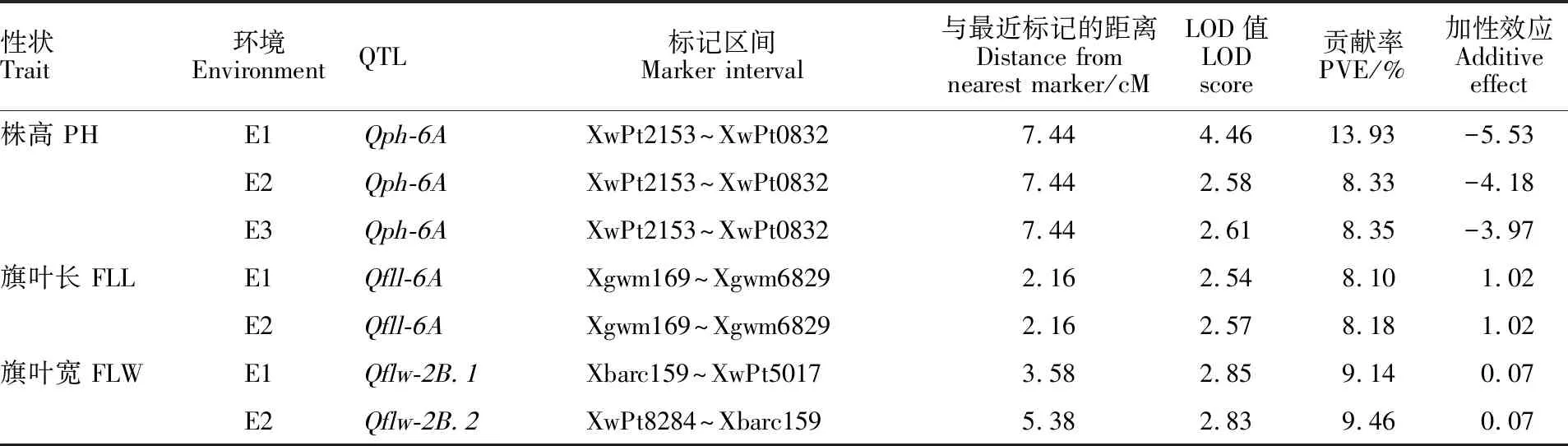
表3 株高和旗叶性状的QTL定位结果Table 3 QTL mapping results for plant height and flag leaf traits

图2 株高(PH)、旗叶长(FLL)、旗叶宽(FLW)的QTL在染色体上的分布
3 讨 论
小麦株高与旗叶相关性状均属于典型的数量性状,受多个遗传位点调控,且受环境影响较大。即使利用相同的遗传群体在不同环境下检测出的QTL也存在较大差异,因而虽然株高和旗叶性状表型数据较易观察,但遗传研究却进展缓慢,对相关性状调控基因的克隆更是困难。目前,通过研究人员不懈努力,在株高上已有二十多个矮秆基因被陆续鉴定出来[16-19],其中拥有良好遗传特性的Rht-B1b和Rht-D1b自然突变基因,在小麦遗传育种进程中已被广泛应用并取得良好效果[5,20-22]。但分析大量前人研究结果发现,到目前为止,株高上可被重复检测的QTL位点仅限于Rht-B1b和Rht-D1b等少数几个主效位点,其余位点虽然获得大量QTLs,但稳定性较差,其可靠性仍需进一步检验,生产应用更是相距甚远。因此为了获得更多实际生产上可以利用的株高调控位点,还需对其遗传研究进一步加强。小麦旗叶性状遗传研究进度较株高而言更为滞后,到目前为止,虽然借助不同遗传群体和技术手段鉴定出一大批QTLs,但对相关基因的克隆仍鲜有报道,整体研究水平仍停留在QTL检测阶段,究其原因,可能是其调控位点较多且效应偏低,因此要克隆相关基因就愈加困难,前人的研究结果很好的反映了这一点。鉴于此,仍需进一步加大对旗叶相关性状遗传调控位点的挖掘,期待未来在量变的基础上取得突破。
作图群体亲本的选择直接影响遗传连锁图谱构建的准确性和适用性。本研究选用以Shanghai 3/CBRD和Naxos为亲本构建的重组自交系群体为试验材料,其中Naxos为来自于德国的春小麦品种,Shanghai 3/CBRD为由CIMMYT创制的一个小麦品系,血统来源为:Shanghai 3//Chuanmai 18/Bagula。所选用群体亲本亲缘关系较远,遗传背景差异较大,变异丰富,有助于发掘较多的潜在调控位点。同时本研究所用群体亲本在株高和旗叶性状上表现出明显差异,且在群体间分离明显,比较适合于QTL定位。
本研究利用一个高代遗传分离群体在3个环境下对株高和旗叶相关性状进行了QTL分析,共检测到了3个控制株高和旗叶长宽等株型相关性状的QTLs,分别位于6A与2B染色体,单个QTL在不同环境中对表型的贡献率均达到8%以上;且3个QTLs均可在2个及以上环境中被检测到,其中与株高相关的QTLQph-6A在三个环境下均可检测到,表明这些数量性状位点的遗传比较稳定;同时在个别环境中检测不到QTL,可能是受环境影响造成的。
对小麦株高性状QTL进行检测,挖掘出更多调控株高的基因位点,将进一步丰富小麦株高的遗传研究。本研究在6A染色体上、标记XwPt2153~XwPt0832之间检测到一个株高相关QTLQph-6A,对比前人研究结果,虽与刘冬成等[7]和王竹林等[23]所检测到的QTL位于同一染色体上,但是与其不在同一标记上或标记附近,推测其可能为新的位点,但是不排除与前人检测到的是同一QTL的可能性。旗叶在小麦生产中常被称作“功能叶”,对籽粒的形成亦即小麦的产量有着非常重要的作用[2],对旗叶性状进行QTL分析,能进一步加深对其调控方式与遗传机理的认识。近年来已有较多对旗叶性状的研究,包括旗叶姿态、旗叶长、旗叶宽、旗叶面积、旗叶周长等等。本研究检测到的旗叶长QTLQfll-6A和旗叶宽QTLQflw-2B,与前人对旗叶长和旗叶宽的研究所检测到的QTL位置均不相同,推测这两个QTL可能是新的调控旗叶性状的QTLs。在本研究中未能检测出与Rht-B1b和Rht-D1b等矮秆基因相一致的株高遗传位点以及前人所报道的调控旗叶性状的一因多效QTL,可能是受限于本试验所选用材料的遗传背景,及群体相对较小,也可能受不同环境以及测量误差的影响。如果能构建遗传变异较大的分离群体,利用高密度的标记,对相关性状进行定位分析,将更有利于获得更多稳定的QTL。本研究作为小麦株高和旗叶性状遗传位点发掘的有益尝试,可为相关基因的分离鉴定以及分子标记辅助育种提供有用的参考信息。
