蛇床子素纳米结构脂质载体的制备及其体内药动学行为
2019-07-23杨宁辉曹伶俐付国辉唐滋贵
杨宁辉, 曹伶俐, 付国辉, 唐滋贵
(1.河南医学高等专科学校,河南 新郑451191;2.黄河科技学院,河南 郑州450005)
蛇床子为伞形科植物蛇床Cnidiu mmonnieri(L.)Cusson 的成熟果实,其性味辛、苦,温,有小毒,主归肾经,外用燥湿杀虫止痒,内服温肾壮阳,祛寒燥湿。蛇床子素是蛇床子主要活性成分,具有抗病原微生物、抗炎、镇痛、抗变态反应活性,另外还具有抗心律失常、降低血压、降血脂、抗骨质疏松、抗肿瘤作用[1-5],但其水溶性很差,生物利用度不高[4]。
为了更好地发挥蛇床子的临床疗效,需要开发新型蛇床子素中药制剂[5]。纳米结构脂质载体是采用纳米技术制备的可负载中药活性成分的一种新剂型,具有缓释性和靶向性[6],可提高固体脂质纳米粒载药量和包封率,有助于延缓药物泄露等,而且所用载体在体内可生物降解,无毒副作用。本实验首次制备蛇床子素纳米结构脂质载体,考察其基本理化性质,并研究大鼠体内药动学行为,为进一步开发高效低毒、生物利用度高的相关新制剂提供参考[7-8],也为其他难溶性中药活性成分制剂研发提供新策略。
1 材料
1.1仪器Essentia LC-16 型高效液相色谱仪(日本岛津公司);JY92-Ⅱ型探头超声仪(上海净信实业发展有限公司);85-2 型磁力搅拌器(巩义市予华仪器有限责任公司);FA1004N 型电子天平(上海精密仪器仪表有限公司);RE-5205 型旋转蒸发器(上海隆拓仪器有限公司);DZF-6050 型真空干燥箱(上海跃进医疗器械厂);DW-45L80 型超低温冰箱 (杭州硕联仪器有限公司); Nano ZS90 型纳米粒度仪(英国Malvern 公司);XH-B型漩涡混合器(无锡沃信仪器有限公司);MD200-2 型氮气吹扫仪(杭州奥威仪器有限公司);S-108型超纯水仪(美国Millipore 公司)。
1.2 试药 蛇床子素原料药(批号SL20160814GC,陕西森郎生物化工有限责任公司);蛇床子素对照品(CAS 号484-12-8,华夏标准物质中心,含有量>98%);丹皮酚对照品(批号110708-201407,中国食品药品检定研究院,含有量99.2%);单硬脂酸甘油酯(西陇化学试剂有限公司);Miglyol®812(批号20161115S,上海特伯化学科技有限公司);泊洛沙姆188(F68,批号P151125,艾美捷科技有限公司);大豆卵磷脂(PC-98T,辅必成上海医药科技有限公司);超滤离心管(截留相对分子量10 000,美国Millipore 公司)。
1.3 动物 SD 大鼠,雌雄兼有,体质量约300 g,购自河南省实验动物中心,动物生产许可证号SCXK(豫)2016-0002。
2 方法与结果
2.1 纳米结构脂质载体制备 称取单硬脂酸甘油酯320 mg、Miglyol®812 80 mg,置于圆底烧瓶中水浴加热熔融,继续加入25 mg 蛇床子素混匀,作为油相;称取F68 0.33 g、大豆卵磷脂0.66 g,加入100 mL 蒸馏水,超声溶解后取20 mL,水浴加热至相同温度,作为水相。在1 200 r/min 搅拌速度下用注射器将水相缓慢加到油相中,继续搅拌1 h,得到初乳,超声10 min(600 W,间隔3 s)后置于-8 ℃冰箱中15 min 进行固化,0.22 μm 微孔滤膜过滤,即得,其混悬液中蛇床子素含有量为1.64 mg/mL。再同法制备空白纳米结构脂质载体。
2.2 蛇床子素含有量测定[7-8]
2.2.1 色谱条件 Waters-C18色谱柱(150 mm×4.6 mm,5 μm);流动相乙腈-水(55 ∶45);体积流量1.0 mL/min;柱温30 ℃;检测波长321 nm;进样量20 μL。
2.2.2 供试品溶液制备 精密量取纳米结构脂质载体混悬液1.0 mL,置于10 mL 量瓶中,加入8 mL乙腈超声15 min,静置30 min 后流动相定容,摇匀,12 000 r/min 离心10 min,精密量取上清液1.0 mL 置于10 mL 量瓶中,流动相定容,摇匀,即得。
2.2.3 线性关系考察 精密称取蛇床子素对照品10.0 mg,避光下置于10 mL 量瓶中,乙腈超声溶解后定容, 得到1.0 mg/mL 贮备液, 精密量取0.4 mL,乙腈定容至10 mL,得到40.0 μg/mL 对照品溶液, 同法稀释成20.0、10.0、1.0、0.4、0.04 μg/mL,在“2.2.1” 项色谱条件下进样测定。以峰面积(Y) 对溶液质量浓度(X) 进行回归,得方程为Y=1.302 6X-0.010 1(r=0.999 9),在0.04~40.0 μg/mL 范围内呈良好的线性关系。
2.2.4 方法学考察 取低、 中、 高质量浓度(0.04、20.0、40.0 μg/mL) 对照品溶液,同1 d内在“2.2.1” 项色谱条件下进样测定6 次,测得峰面积RSD 分别为0.87%、0.29%、0.11%,表明该方法日内精密度良好。取供试品溶液,于0、1、2、4、5 d 在“2.2.1” 项色谱条件下进样测定,测得峰面积RSD 为0.68%,表明溶液在5 d 内稳定性良好。精密吸取1.0 mg/mL 对照品溶液75、150、225 μL,补加空白纳米结构脂质载体75、150、225 μL,平行3 份,置于10 mL 量瓶中,加入8 mL 乙腈超声15 min,静置30 min 后流动相定容,摇匀,12 000 r/min 离心10 min,测得平均加样回收率为99.08%,RSD 小于1.79%。
2.3 纳米结构脂质载体基本性质考察
2.3.1 包封率、载药量 采用超滤离心法。精密量取1.0 mL 混悬液,置于超滤离心管内管中,高速离心30 min(12 000 r/min),取外管超滤液,乙腈定容至1.0 mL,HPLC 法测定游离蛇床子素含有量(W游离);再精密量取1.0 mL 混悬液, 加入2.0 mL乙腈超声5 min,室温下放置30 min 流动相定容 至5.0 mL, 0.45 μm 微 孔 滤 膜 过 滤, 在“2.2.1” 项色谱条件下测定蛇床子素总含有量(W总),计算公式分别为包封率= [(W总-W游离) /W总] ×100%、载药量= [(W总-W游离)/(W脂质总量+W总-W游离)] ×100% (W脂质总量为固态、液态脂质总含有量)。结果,3 批纳米结构脂质载体的平均包封率为88.17%,载药量为5.06%。
2.3.2 粒径、Zeta 电位 取纳米结构脂质载体1.0 mL,加入2.0 mL 蒸馏水稀释,测定其粒径、Zeta 电位,结果见图1 ~2。由图可知,粒径介于100 ~500 nm 之间, 平均为226.25 nm, PDI 为0.204,Zeta 电位为-15.17 mV。

图1 纳米结构脂质载体粒径分布Fig.1 Size distribution of nanostructured lipid carriers

图2 纳米结构脂质载体的Zeta 电位Fig.2 Zeta potential of nanostructured lipid carriers
2.3.3 体外释药行为 取1.0 mg/mL 蛇床子素、纳米结构脂质载体 (以蛇床子素计含有量为2.0 mg) 混悬液,分别加入蒸馏水配制成2 mL,置于透析袋中(相对分子质量8 000 ~14 000),放入500 mL 0.5%SDS 溶液中,于37 ℃、100 r/min恒温振荡器中实验,在不同时间点各取样2 mL,保持溶出介质体积不变,测定蛇床子素含有量,计算累积释放率,绘制释放曲线,结果见图3。由图可知,纳米结构脂质载体具有明显缓释特征,24 h内累积释放度为77.12%,远高于蛇床子素。
2.4 体内药动学行为
2.4.1 对照品、内标溶液制备 取“2.2.3” 项下贮 备 液, 稀 释 成10.0、 25.0、 50.0、 100.0、200.0、400.0 ng/mL 对照品溶液。精密称取丹皮酚10.0 mg, 加 入 约9.0 mL 乙 腈 超 声, 静 置30 min后定容,即得10.0 μg/mL 内标溶液,精密量取1.0 mL 于10.0 mL 量瓶中, 乙腈稀释至1.0 μg/mL,置于冰箱中保存。
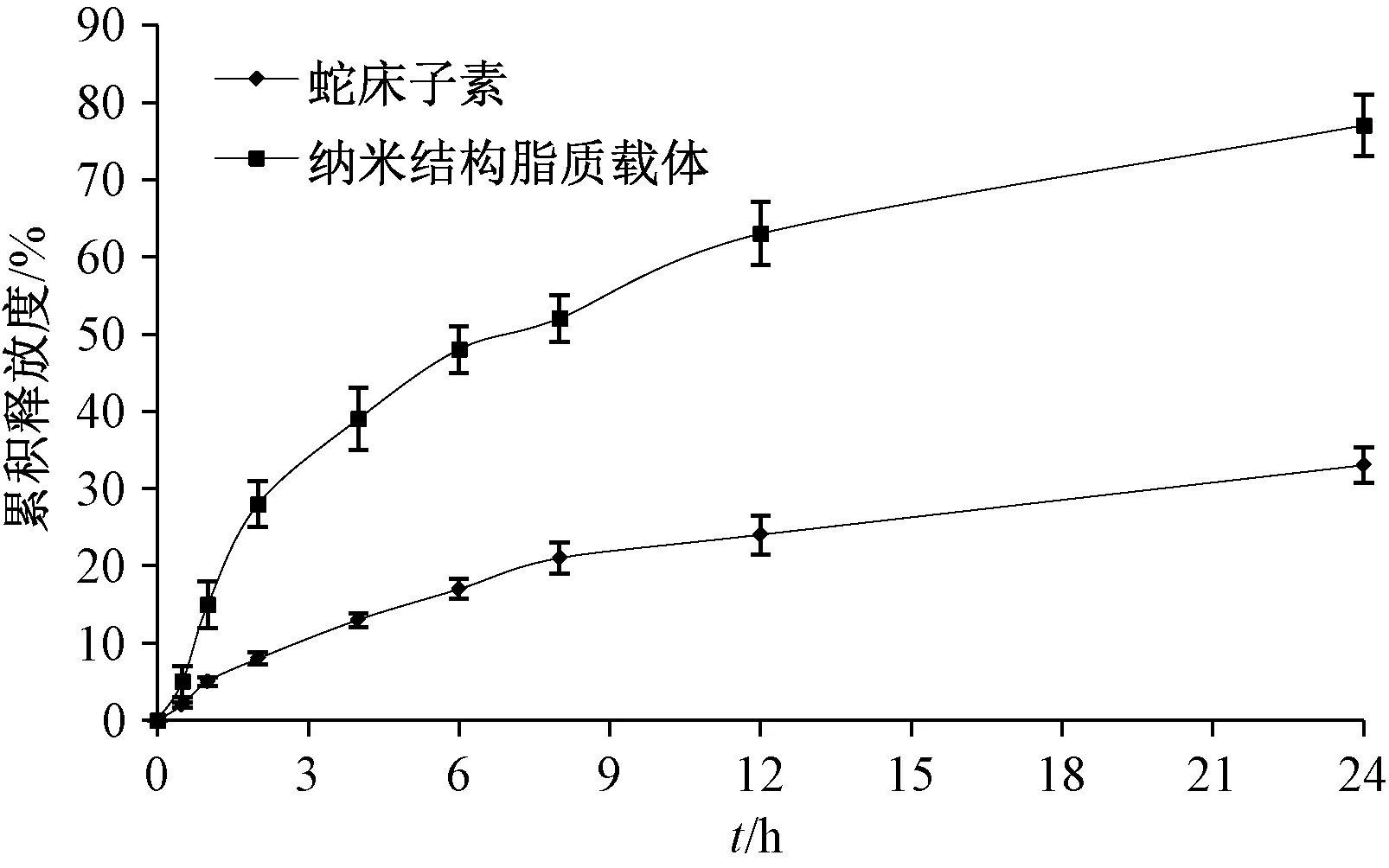
图3 样品体外释放曲线Fig.3 In vitro release curves for samples
2.4.2 血浆样品处理[8]将血浆样品于室温下避光放置一段时间解冻,精密吸取200 μL 于5 mL 离心管中,依次加入内标溶液50 μL、乙腈3.5 mL,涡旋混匀,沉淀蛋白,6 000 r/min、-5 ℃下高速离心8 min,转移上层有机相至离心管中,调整氮气体积流量,45 ℃氮气缓慢吹去有机溶剂,残留物用200 μL 流动相复溶,4 500 r/min 下离心5 min后进样20 μL 测定。
2.4.3 线性关系考察 取“2.4.1” 项下不同质量浓度对照品溶液各200 μL,45 ℃氮气缓慢吹干,依次加入空白大鼠血浆200 μL、内标溶液50 μL,按“2.4.2” 项下方法处理,在“2.2.1” 项色谱条件下进样测定。以蛇床子素、内标峰面积的比值为横坐标(X),溶液质量浓度为纵坐标(Y) 进行回归,得方程为Y=193.57X+2.86(R2=0.990 8),在10.0~400.0 ng/mL 范围内线性关系良好。
2.4.4 方 法 学 考 察 取 低、 中、 高 (10.0、200.0、400.0 ng/mL) 质量浓度对照品溶液,按“2.4.2” 项下方法处理,在“2.2.1” 项色谱条件下进样测定, 测得平均加样回收率分别为92.18%、 93.66%、 90.99%, RSD 小 于6.83%。取3 种质量浓度血浆样品,在“2.2.1” 项色谱条件下进样测定,每天1 次,连续5 d,测得日间精密度RSD 分别为9.15%、6.83%、7.44%;同一份样品于同1 d 内连续进样测定5 次,测得得日内精密度RSD 分别为5.08%、3.71%、4.63%,表明该方法精密度良好。血浆样品室温下于0、4、8、12、24、48 h 在“2.2.1” 项色谱条件下进样测定,测得峰面积RSD 为7.28%,表明样品在室温下48 h 内稳定性良好。
2.4.5 灌胃液制备 取蛇床子素混悬液(5.0 mg/mL),蒸馏水配制成3 mL,每只大鼠灌胃给药15 mg/kg;取纳米结构脂质载体混悬液,加入5%海藻糖作为冻干保护剂,置于-70 ℃超低温冰箱中24 h,将预冻样品迅速置于真空冻干机中36 h,即得冻干粉末, 其中蛇床子素含有量为3.08%。取冻干粉末0.487 g,加入3 mL 蒸馏水振荡,即得,灌胃剂量同原料药。
2.4.6 行为考察 12 只大鼠随机分为蛇床子素组和纳米结构脂质载体组,先于实验室环境中空腹适应24 h,再于预定时间点眼眶取血各约0.3 mL,玻璃毛细管引流至涂有肝素的离心管中,高速离心5 min(2 500 r/min),血浆按“2.4.2” 项下方法处理后在“2.2.1” 项色谱条件下进样测定,计算血药浓度,Tmax、Cmax取实测值,梯形法计算时间-曲线下面积(AUC),结果见图4、表1。由表可知,纳米结构脂质载体组Cmax、AUC0~t显著高于蛇床子素组(P<0.05,P<0.01),而且Tmax显著延后(P<0.05),T1/2显著延长(P<0.01),相对生物利用度提高了3.31 倍。
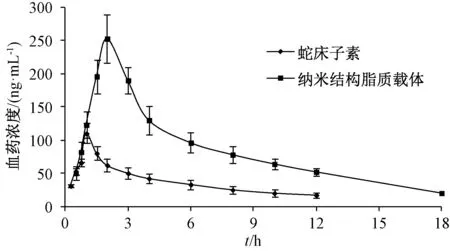
图4 样品血药浓度-时间曲线Fig.4 Plasma concentration-time curves for samples
表1 主要药动学参数(±s,n=6)Tab.1 Main pharmacokinetic parameters(x ±s,n=6)

表1 主要药动学参数(±s,n=6)Tab.1 Main pharmacokinetic parameters(x ±s,n=6)
注:与蛇床子素组比较,∗P<0.05,∗∗P<0.01
参数 单位 蛇床子素组 纳米结构脂质载体组Tmax h 1.12±0.25 2.64±0.51∗TCAA 1mUU/a2CC x 00~~∞t nn ngg··g·mm m hLL L--11-·· 1 hh 145 151 2311....6825 7653±±±±0167.962 8...4746 532 11 246 591 5336....9315 2625±±±±1322.103 2.37 74..753∗∗79∗∗∗∗∗∗
3 讨论
本实验采用固态脂质单硬脂酸甘油酯和液态脂质作为载体,制备了蛇床子素纳米结构脂质载体,包封率达88.17%,而陈娇婷等[9]对蛇床子素固体脂质纳米粒制备工艺进行研究,发现其包封率仅为59.78%,这一方面可能是蛇床子素在液态脂质Miglyol®812 中的溶解度较高,有助于促进药物包裹进入纳米结构脂质载体中;另一方面液态脂质的加入增加了纳米载体的晶体混乱程度,有利于提高包封率及载药量[10-15]。
药动学研究结果显示,蛇床子素纳米结构脂质载体的吸收速率与蛇床子素原料药明显不同,其原因可能是蛇床子素混悬液进入胃肠道后被迅速吸收进入体循环,达峰时间较快;纳米结构脂质载体粒径较小,口服进入胃肠道后被吸附在胃肠道壁上,甚至进入绒毛间隙,增加在胃肠道黏膜上的滞留时间[10]而导致Tmax延后。文献[11-14] 报道,纳米制剂可经消化道上皮细胞直接进入血液循环,也可经上皮细胞或派伊尔结进入淋巴循环,并以淋巴循环为主[10],其生物利用度的提高可能与纳米结构脂质载体改变了蛇床子素吸收途径有关,可有助于避免肝脏首过效应[16],提高药物吸收程度。综上所述,纳米结构脂质载体可促进蛇床子素顺利吸收,有助于其药理活性充分发挥[17-18],也为进一步研发相关制剂提供参依据。
