不同收获指数甘蓝型油菜β-淀粉酶活性及其基因家族成员的表达分析
2019-07-23靳舒荣王艳玫王月华李加纳
靳舒荣 王艳玫 常 悦 王月华 李加纳 倪 郁,*
不同收获指数甘蓝型油菜β-淀粉酶活性及其基因家族成员的表达分析
靳舒荣1,2, **王艳玫1,2,**常 悦1,2王月华1,2李加纳1,2倪 郁1,2,*
1西南大学农学与生物科技学院, 重庆 400715;2西南大学农业科学研究院, 重庆 400715
油菜“源”器官中光合产物向籽粒转移的效率是提高油菜收获指数的关键环节, 而“源”器官中淀粉酶活性影响同化物向籽粒的运输强度。β-淀粉酶(β-amylase, BAM)及其基因家族成员与油菜高收获指数形成之间的关系还不清楚。本研究选择高产高收获指数型、高产低收获指数型、低产低收获指数型3类油菜品种, 在终花期后5、10、15、20、25 d分别取茎杆、叶片、角果皮与种子, 分析β-淀粉酶活性及其基因家族成员的表达水平。结果表明, β-淀粉酶活性在所检测“源”器官中酶活性总体随发育时期增加。高收获指数型油菜叶片、角果皮中的β-淀粉酶活性显著高于低收获指数型油菜。β-淀粉酶基因家族中,、与在油菜茎、叶及角果皮中的表达量总体随发育时期增加。花后25 d时,与在高收获指数油菜叶片、角果皮中的表达量显著高于低收获指数油菜。与在高收获指数油菜角果皮中的表达量分别于花后15 d与20 d开始显著高于低收获指数油菜。综合分析认为,和可能通过促进叶片与角果皮淀粉分解而加强光合产物向籽粒的运输强度;与可能主要通过作用于角果皮淀粉分解而调控光合产物向籽粒的运输。与也可能参与了油菜种子中淀粉的调控。
甘蓝型油菜; 收获指数; β-淀粉酶; 基因表达
油菜是我国主要的油料作物。随着我国食用植物油的进口依存度日益增大, 提高油菜产量在很长一段时间内将是油菜育种的主要目标。作物生物产量主要来自光合产物积累, 其决定因素是光合效率, 而包括油菜在内的以种子为收获物的作物经济产量不但决定于光合效率, 还决定于光合产物的运输与分配。收获指数是指作物收获时经济产量与生物产量的比值, 反映了光合产物的有效分配程度。植物绿色组织内光合产物的主要暂贮形式是淀粉, 而蔗糖及其衍生物是光合产物向籽实等库器官运输的主要形式。与其他作物相比, 油菜的生物产量不低, 但收获指数却显著偏低[1], 因此, 如何调控油菜体内淀粉与蔗糖的合成, 促进光合产物向籽粒转移是提高油菜收获指数、实现油菜高产的有效途径。
甘蓝型油菜角果皮内淀粉酶活性的增高能促进淀粉向可溶性糖转变, 提高光合产物向籽粒的运输强度, 从而有助于提高油菜的收获指数[2-3]。淀粉酶根据淀粉水解产物异头碳的构型可被分为α-淀粉酶与β-淀粉酶。这2种酶在油菜高收获指数形成中各自的贡献还没有报道。a-淀粉酶是一种内水解酶, 可降解葡聚糖以产生各种线性和分支的麦芽低聚糖, 包括a-麦芽糖。拟南芥3种α-淀粉酶基因的突变均不影响正常生长条件下淀粉的分解[4], 暗示了a-淀粉酶途径不可能是淀粉分解的主要途径。β-淀粉酶(β-amylase, BAM)是一种外水解酶, 它作用于a-1,4-连接的葡聚糖链的非还原端, 以产生β-麦芽糖。目前的实验证据表明, 在淀粉分解过程中, β-淀粉酶途径是淀粉分解产生麦芽糖的主要途径[5]。马铃薯叶绿体靶向β-淀粉酶基因沉默时, 叶片淀粉水平升高[6]。β-淀粉酶是多基因家族, 其基因成员在植物淀粉降解和基因调控中发挥着重要作用[7]。BAM以及各基因成员在油菜高收获指数形成中的作用还不清楚。本研究选择3种不同类型油菜品种, 调查终花期至青角中期主要“源”器官和种子中β-淀粉酶活性以及各基因家族成员的转录水平, 探究β-淀粉酶对油菜高收获指数的贡献, 挖掘与高收获指数相关的BAM基因, 为进一步通过分子育种提高油菜收获指数提供基因资源。
1 材料与方法
1.1 材料
从前期鉴定的收获指数极端差异材料中选择生育期和营养体相似、收获指数高和低差异明显的纯合自交系3份, 分别为高产高收获指数型(HH)、高产低收获指数型(HL)、低产低收获指数型(LL)[8]。材料由重庆市油菜工程技术研究中心提供。
1.2 实验设计与取样
于2015年9月至2016年5月在重庆北碚, 采用育苗移栽方式, 按随机区组3次重复试验种植3种不同收获指数型材料, 每个材料40株(10株×4行), 行距40 cm, 株距25 cm。按当地油菜高产栽培方式施肥及管理。终花期开始至青角中期, 每隔5 d从每小区选择生长正常、长势一致的3个植株混合取样, 分别取其茎、叶片、角果皮、种子冻于液氮中, 取样5次, 存储于-80℃, 用于基因表达分析与酶活性测定。
1.3 甘蓝型油菜收获指数的确定
油菜成熟后从每小区选择生长正常、长势一致的10个植株, 将每株子叶节以上全部晒干后称重, 作为单株生物产量; 将每株所有角果脱粒, 种子晒干后获得单株经济产量; 收获指数(HI)为经济产量占生物产量的百分数。
1.4 基因表达分析
采用TransZol RNA提取试剂盒(TaKaRa)提取总RNA。用DNase I (TaKaRa)消化去除基因组DNA。按照TransScript First-Strand cDNA Synthesis SuperMix反转录试剂盒(北京全式金生物技术有限公司)进行样品cDNA的合成。
根据拟南芥、甘蓝型油菜β-淀粉酶基因家族成员保守序列设计荧光定量PCR引物(表1)。按照ChamQ SYBR qPCR Master Mix试剂盒(Vazyme)说明, 反应体系含2×ChamQ SYBR qPCR Master Mix 10.0 μL、10 μmol L–1上下游引物各0.4 μL、cDNA 2.0 μL、ddH2O 7.2 μL。在qTOWER2.2荧光定量PCR仪(德国耶拿)上进行PCR扩增, 扩增程序为95℃ 30 s; 95℃5 s, 56℃ 30 s, 40个循环。为内参基因。设置3个生物学重复, 2个技术重复。
1.5 β-淀粉酶活性测定
从每小区选择长势一致的3个植株混合取样, 分别称取其茎、叶片、角果皮、种子各0.1 g, 液氮下研磨成粉末, 加入9 mL pH 7.2的磷酸缓冲液混匀, 全部转移至离心管中, 于4℃、3000 ×离心15 min, 取上清液为待测样品酶液。采用酶联免疫分析测定β-淀粉酶活性。用纯化的植物β-淀粉酶抗体包被微孔板, 制成固相抗体, 往包被单抗的微孔中依次加入标准品和待测样品酶液, 再与HRP标记的β-淀粉酶抗体结合, 形成抗体-抗原-酶标抗体复合物, 经过彻底洗涤后加底物TMB显色。按植物β-淀粉酶酶联免疫分析试剂盒(酶联生物)说明书, 用酶标仪在450 nm波长下测定吸光度, 通过标准曲线计算样品中β-淀粉酶活性浓度(U mL-1)。以每克植物组织中所具有的酶活力单位作为酶活性单位。
1.6 数据分析
采用单因素方差分析比较不同油菜品种的产量与收获指数差异(SPSS 15.0), 显著水平为<0.05; 利用SigmaPlot 10.0绘制相关图表。

表1 qPCR相关引物
2 结果与分析
2.1 不同甘蓝型油菜品种的收获指数
由图1可知, 3个油菜品种(HH、HL、LL)的生物产量和收获指数存在显著差异。HH型的单株生物产量与收获指数都是最高的, HL型次之, LL型最低。
2.2 不同收获指数甘蓝型油菜β-淀粉酶活性的动态变化
采用酶联免疫法分析了3种不同收获指数型甘蓝型油菜终花期后茎、叶、角果皮以及种子中β-淀粉酶活性的动态变化。由图2可知, β-淀粉酶活性在所检测“源”器官中随发育时期呈上升趋势。HH型油菜叶片、角果皮中的β-淀粉酶活性显著高于其他2个品种。茎中的β-淀粉酶活性在品种间的差异与叶片、角果皮不同, LL型油菜茎中的β-淀粉酶活性显著高于其他2个品种。种子中, 3个材料均表现出下降–升高–下降的趋势, 其中HL型油菜在花后20 d、25 d时酶活性显著减少。
2.3 β-淀粉酶基因家族成员在不同收获指数甘蓝型油菜茎、叶、角果皮及种子中的表达分析
2.3.1 在茎中的表达分析 油菜终花期后5、10、15、20、25 d分别取HH、HL与LL型油菜的茎提取RNA, 对BAM基因家族成员的表达水平进行分析。由图3可知,与在3种不同类型油菜茎中的表达量总体随发育时期呈上升趋势,在品种间无显著差异,在LL型油菜花后20 d时的表达量显著高于其他2个品种。在HL与LL茎中表达量总体随发育时期也呈现上升的趋势, 但在LL油菜中的表达量显著高于HL。基因在HL和LL油菜中的表达量在花后10 d达到最高, 之后恢复至初始水平。与HL和LL相比,与在HH型油菜花后不同发育时期茎中低水平表达, 随发育时期无明显变化。
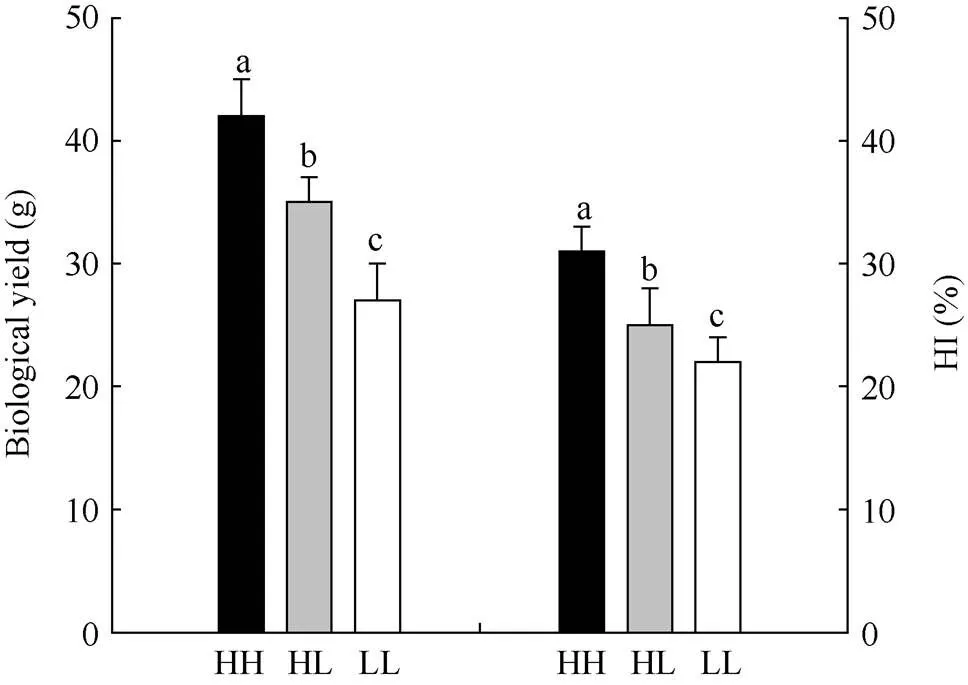
图1 不同油菜品种的产量与收获指数
HH: 高产高收获指数型油菜; HL: 高产低收获指数型油菜; LL: 低产低收获指数型油菜; HI: 收获指数。图中柱形图上方不同小写字母表示品种间差异显著(< 0.05)。
HH: high-yield and high-harvest index rapeseed; HL: high-yield and low-harvest index rapeseed; LL: low-yield and low-harvest index rapeseed; HI: harvest index. Different letters above the column indicate significant difference at< 0.05 among varieties.

图2 甘蓝型油菜不同发育时期不同组织器官β-淀粉酶活性的动态变化
缩写同图1。Abbreviations are the same as those given in Fig. 1.
2.3.2 在叶片中的表达分析 油菜终花期后不同时期分别取HH、HL与LL型油菜的叶片提取RNA, 对BAM基因家族成员的表达水平进行分析。由图4可知,、和在3种不同类型油菜叶片中的表达量随发育时期总体呈上升趋势, 其中在HH型油菜花后25 d的表达量显著高于HL与LL。在HH、HL油菜花后20 d叶片中的表达量大幅增加, 25 d时显著高于其他基因在各组织器官、各个时期的表达量。
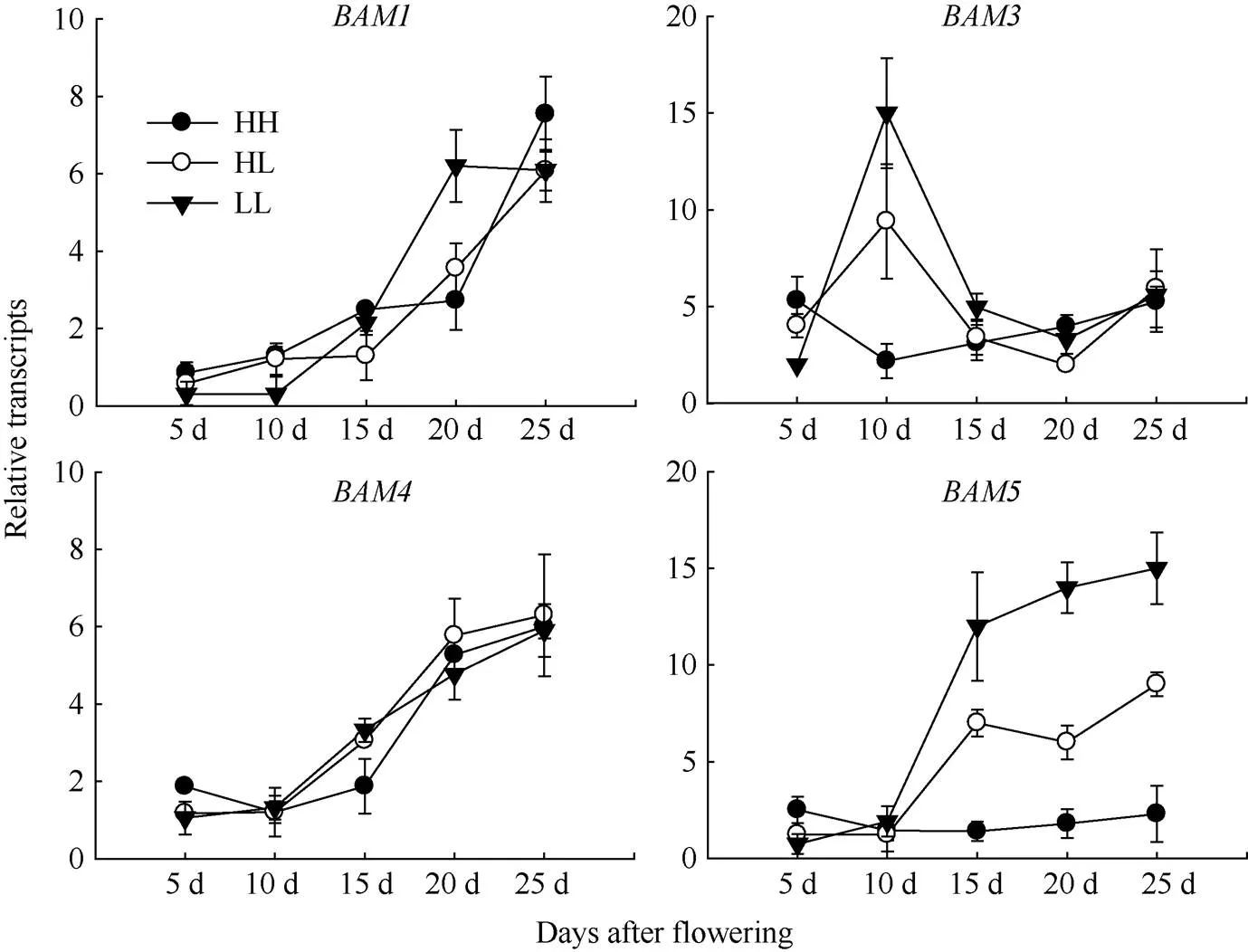
图3 甘蓝型油菜不同发育时期茎内β-淀粉酶基因家族成员的表达
缩写同图1。Abbreviations are the same as those given in Fig. 1.

图4 甘蓝型油菜不同发育时期叶片β-淀粉酶基因家族成员的表达
缩写同图1。Abbreviations are the same as those given in Fig. 1.
2.3.3 在角果皮中的表达分析 由图5可知,、和在3种不同类型油菜角果皮中的表达量总体随发育时期呈上升趋势; 花后20 d、25 d时,、、和基因在HH型油菜中的表达量均显著高于HL与LL型油菜。
2.3.4 在种子中的表达分析 利用qPCR对β-淀粉酶基因家族成员在不同收获指数型甘蓝型油菜种子中的表达情况进行分析。由图6可知,和在3种不同类型油菜种子中总体低水平表达。HL型油菜中与在花后15 d时表达量显著高于其他2个品种, 之后表达量下降。

图5 甘蓝型油菜不同发育时期角果皮β-淀粉酶基因家族成员的表达
缩写同图1。Abbreviations are the same as those given in Fig. 1.
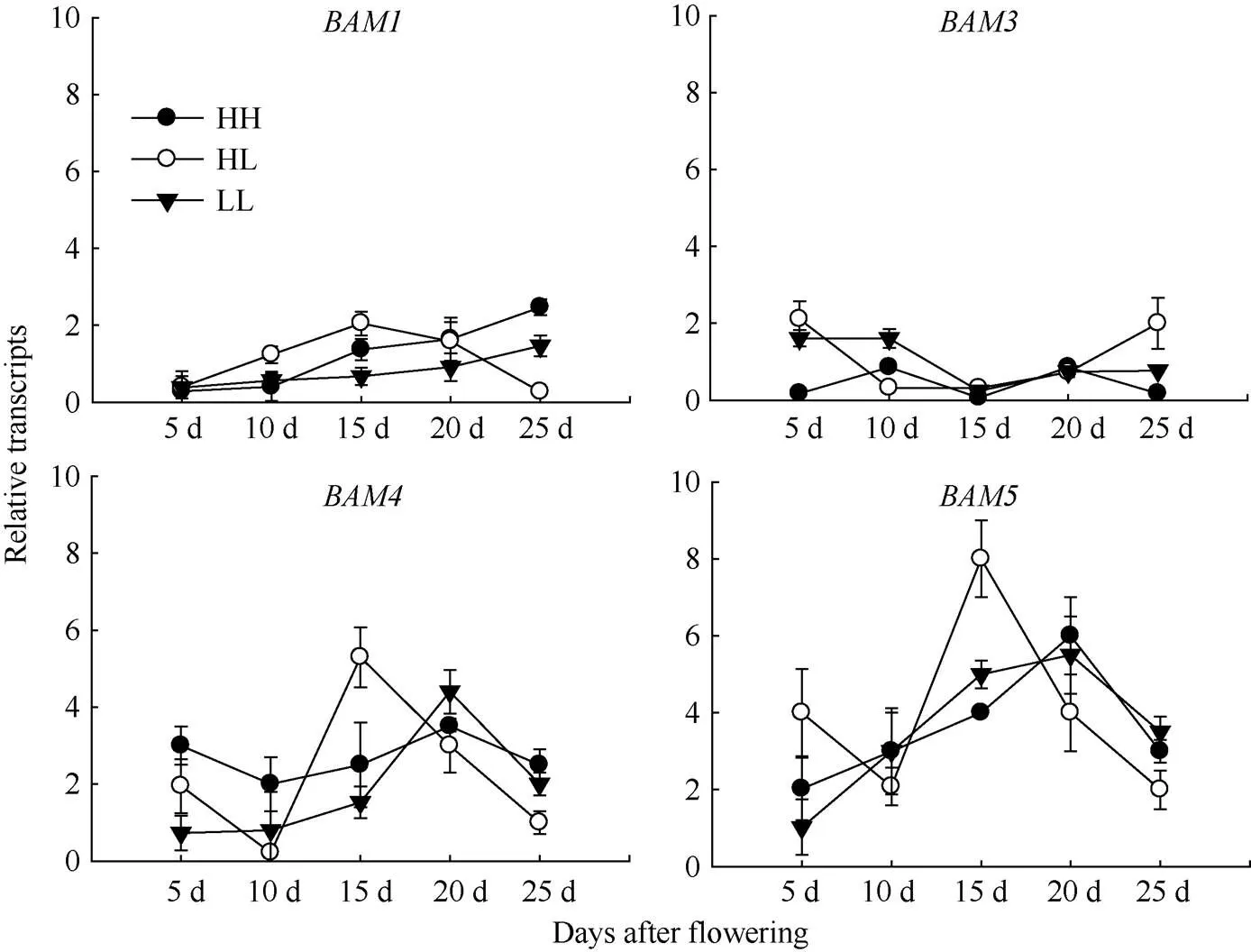
图6 甘蓝型油菜不同发育时期种子β-淀粉酶基因家族成员的表达
缩写同图1。Abbreviations are the same as those given in Fig. 1.
3 讨论
“源”充足、“流”畅通、“库”容大是作物高收获指数形成的三大要素。油菜具有充足的“源”和“库”, 但收获指数与其他作物相比却偏低, 其主要受限因子在“流”[9]。如何有效促进光合产物向籽粒运输与分配是提高油菜收获指数、实现油菜高产的有效途径。袁婺洲等[2-3]研究报道油菜角果皮内的淀粉酶活性调控淀粉向可溶性糖的转变, 并进而影响光合产物向籽粒的运输强度, 其酶活性与收获指数呈显著正相关。李加纳等[8]报道收获指数高的油菜角果皮的蔗糖合酶、蔗糖磷酸合酶、酸性转化酶以及淀粉酶活性较高, 有利于淀粉降解为蔗糖, 为籽粒提供营养物质。植物体内的a-淀粉酶和β-淀粉酶都通过催化支链淀粉和直链淀粉水解产生麦芽糖。有实验证据表明, β-淀粉酶及其基因家族成员在植物淀粉降解和基因调控中发挥重要作用[5-6]。油菜β-淀粉酶途径与高收获指数的关系还不清楚。茎、叶片以及角果是油菜在不同发育时期光合产物的主要来源[10-11]。在生殖生长早期, 叶片中产生的光合产物被运输到花和角果中[12]。在籽粒灌浆过程中, 叶片的贡献随着衰老而逐渐减小, 转而由角果提供的光合产物来充实种子[10,13]。本研究表明, β-淀粉酶活性在所检测“源”器官中随发育时期总体呈增加趋势, 高收获指数油菜叶片与角果皮中的β-淀粉酶活性从花后15 d开始显著高于低收获指数油菜。叶片与角果皮中较高的β-淀粉酶活性, 有利于淀粉降解并向籽粒运输营养物质, 从而贡献了高收获指数。
β-淀粉酶是多基因家族, 拟南芥β-淀粉酶基因家族(β-amylase, BAM)成员有9个[14-15], 根据氨基酸序列同源性分为亚家族I (和)、亚家族II (和)、亚家族III (和)和亚家族IV (、和)[16]。根据这些基因在淀粉分解中的作用, 本研究选择、、、, 分析了它们在不同收获指数油菜中的转录水平。结果表明,在油菜茎、叶及角果皮中的表达量总体随发育时期增加, 花后25 d时,在高收获指数油菜各“源”器官中的表达量均显著高于低收获指数油菜。在高收获指数油菜叶片、角果皮中的表达量在花后25 d时显著高于低收获指数油菜, 且在高收获指数油菜花后25 d叶片中的表达量显著高于其他基因在各组织器官、各个时期的表达量。已有证据表明,和在拟南芥质体淀粉降解中起重要作用[16-17]。其中在保卫细胞中起主要作用, 在白天通过降解淀粉促进气孔开放[18-19], 而在叶肉细胞淀粉降解中起主导作用[17,20-21]。本研究中,和基因在高收获指数油菜籽实充实期叶片与角果中高表达, 暗示和基因可能通过促进叶片与角果皮淀粉分解而加强光合产物向籽粒的运输强度, 从而提高油菜的收获指数。β-淀粉酶活性测定结果也支持这一观点。
可能以独立于和途径的方式调控拟南芥淀粉降解[16]。定位于细胞质的BAM5蛋白对淀粉的亲和力远高于其他定位于质体的BAMs[22], 拟南芥叶片中90%的β-淀粉酶活性是由基因座编码的[23]。本研究中,与在油菜茎、叶及角果皮中的表达量总体随发育时期增加, 在高收获指数油菜角果皮中的表达量分别于花后15 d与20 d开始显著高于低收获指数油菜。这表明, 油菜中与基因可能主要通过上调角果皮表达量而调控淀粉分解与光合产物向籽粒的运输。
不同收获指数油菜茎中的β-淀粉酶活性及其基因表达与叶片、角果表现不同, 低产低收获指数型油菜茎中表现出较高的β-淀粉酶活性及其基因表达水平(、)。这种β-淀粉酶与收获指数的不一致可能与低生物产量背景有关。前人研究认为, 油菜的经济产量首先受生物产量的影响, 其次才受收获指数的影响, 只有在高生物产量背景下提高收获指数才有意义[24]。β-淀粉酶活性在3个不同收获指数油菜种子中均表现出下降-升高-再下降的趋势。高收获指数油菜β-淀粉酶活性在后期高于低收获指数, 其中显著高于低产低收获指数油菜。和在种子中总体低水平表达,与可能主要参与油菜种子中淀粉的调控。
[1] Hay R K M. Harvest index: a review of its use in plant breeding and crop physiology., 1995, 126: 197–216.
[2] 袁婺洲, 官春云. 油菜角果内的淀粉酶活性与有关同化物转运的调控. 湖南师范大学自然科学学报, 1995, 18(3): 74–79. Yuan W Z, Guan C Y. Regulation of assimilates transportation by amylase activity in rapeseed pods., 1995, 18(3): 74–79 (in Chinese with English abstract).
[3] 袁婺洲, 官春云. 影响油菜收获指数的几个生理因子. 作物学报, 1997, 23: 580–586. Yuan W Z, Guan C Y. Harvest index in rapeseed affected by a few physiological factors., 1997, 23: 580–586 (in Chinese with English abstract).
[4] Yu T S, Zeeman S C, Thorneycroft D, Fulton D C, Dunstan H, Lue W L, Hegemann B, Tung S Y, Umemoto T, Chapple A, Tsai D L, Wang S M, Smith A M, Chen J, Smith S M. alpha-Amylase is not required for breakdown of transitory starch in Arabidopsis leaves., 2005, 280: 9773–9779.
[5] Weise S E, Kim K S, Stewart R P, Sharkey T D. β-Maltose is the metabolically active anomer of maltose during transitory starch degradation., 2005, 137: 756–761.
[6] Scheidig A, Fröhlich A, Schulze S, Lloyd J R, Kossmann J. Down regulation of a chloroplast-targeted β-amylase leads to a starch-excess phenotype in leaves., 2002, 30: 581–591.
[7] Streb S, Zeeman S C. Starch metabolism in Arabidopsis., 2012, 10: e0160.
[8] 申鸽子. 不同生境下油菜高收获指数的激素平衡与调控. 西南大学硕士学位论文, 重庆, 2016. Shen G Z. Balance and Regulation of Hormones of High Harvest Index Rapeseed (L.) in Different Environments. MS Thesis of Southwest University, Chongqing, China, 2016 (in Chinese with English abstract).
[9] 李加纳, 卢坤, 荐红举, 梁颖, 陆军花, 彭柳, 申鸽子, 张烨, 张超, 杨博, 张莉. 油菜收获指数研究进展. 中国油料作物学报, 2018, 40: 640–648. Li J N, Lu K, Jian H J, Liang Y, Lu J H, Peng L, Shen G Z, Zhang Y, Zhang C, Yang B, Zhang L. Research advances on harvest index ofL., 2018, 40: 640–648 (in Chinese with English abstract).
[10] Allen E J, Morgan D G, Ridgman W I. A physiological analysis of the growth of oilseed rape., 1971, 77: 339–341.
[11] Chapman J F, Daniels R W, Scarisbrick D H. Field studies on14C assimilate fixation and movement in oil-seed rape ()., 1984, 102: 23–31.
[12] Pechan P A, Morgan D G. Defoliation and its effects on pod and seed development in oil seed rape (L.)., 1985, 36: 458–468.
[13] Tayo T O, Morgan D G. Factors influencing flower and pod development in oil-seed rape (L.)., 1979, 92: 363–373.
[14] Smith S M, Fulton D C, Chia T, Thorneycroft D, Chapple A, Dunstan H, Hylton C, Zeeman S C, Smith A M. Diurnal changes in the transcriptome encoding enzymes of starch metabolism provide evidence for both transcriptional and posttranscriptional regulation of starch metabolism in Arabidopsis leaves., 2004, 136: 2687–2699.
[15] Monroe J D, Storm A R. The Arabidopsis β-amylase (BAM) gene family: Diversity of form and function., 2018, 276: 163–170.
[16] Fulton D C, Stettler M, Mettler T, Vaughan C K, Li J, Francisco P, Gil M, Reinhold H, Eicke S, Messerli G, Dorken G, Halliday K, Smith A M, Smith S M, Zeeman S C. β-amylase 4, a noncatalytic protein required for starch breakdown, acts upstream of three active beta-amylases in Arabidopsis chloroplasts., 2008, 20: 1040–1058.
[17] Lao N T, Schoneveld O, Mould R M, Hibberd J M, Gray J C, Kavanagh T A. An Arabidopsis gene encoding a chloroplast- targeted β-amylase., 1999, 20: 519–527.
[18] Valerio C, Costa A, Marri L, Issakidis-Bourguet E, Pupillo P, Trost P, Sparla F. Thioredoxin-regulated β-amylase (BAM1) triggers diurnal starch degradation in guard cells, and in mesophyll cells under osmotic stress., 2011, 62: 545–555.
[19] Horrer D, Flütsch S, Pazmino D, Matthews J S, Thalmann M, Nigro A, Leonhardt N, Lawson T, Santelia D. Blue light induces a distinct starch degradation pathway in guard cells for stomatal opening., 2016, 26: 362–370.
[20] Kaplan F, Guy C L. RNA interference of Arabidopsis beta- amylase 8 prevents maltose accumulation upon cold shock and increases sensitivity of PSII photochemical efficiency to freezing stress., 2005, 44: 730–743.
[21] Monroe J D, Storm A R, Badley E M, Lehman M D, Platt S M, Saunders L K, Schmitz J M, Torres C E. β-amylase 1 and β-amylase3 are plastidic starch hydrolases in Arabidopsis that seem to be adapted for different thermal, pH, and stress conditions., 2014, 166: 1748–1763.
[22] Monroe J D, Breault J S, Pope L E, Torres C E, Gebrejesus T B, Berndsen C E, Storm A R. Arabidopsis β-amylase 2 is a K+-requiring, catalytic tetramer with sigmoidal kinetics., 2017, 175: 1125–1135.
[23] Laby R J, Kim D, Gibson S I. Themutant of Arabidopsis exhibits severely decreased β-amylase activity., 2001, 127: 1798–1807.
[24] 黄露, 陶诗顺, 张敏, 姜磊, 彭雅利. 甘蓝型杂交油菜收获指数及其品种间差异性研究. 江苏农业科学, 2011, (1): 95–97.Huang L, Tao S S, Zhang M, Jiang L, Peng Y L. Differences analysis of harvest and varieties ofL., 2011, (1): 95–97 (in Chinese with English abstract).
Activity and gene family expression of β-amylase indiffering in harvest index
JIN Shu-Rong1,2,**, WANG Yan-Mei1,2,**, CHANG Yue1,2, WANG Yue-Hua1,2, LI Jia-Na1,2, and NI Yu1,2,*
1College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, China;2Academy of Agricultural Sciences, Southwest University, Chongqing 400715, China
The transferring efficiency of photosynthate from source organs to grains is the key process to increase the harvest index inandamylase activity in source organs affects the transport intensity of assimilates to grains. The relationship between β-amylase (BAM) and the formation of high harvest index in rapeseed had not been clear. In this study, three different inbred lines, high-yield and high-harvest index rapeseed, high-yield and low-harvest index rapeseed, and low-yield and low-harvest index rapeseed were selected, and stem, leaf, silique pericarp and seed were sampled at 5, 10, 15, 20, and 25 d after the final flowering to analyze the activity of β-amylase and the expression level of its gene family members. The activity of β-amylase increased with the development of source organs. The activity of β-amylase in leaves and silique pericarps of high-harvest index rapeseed was significantly higher than that of low-harvest index rapeseed. In the β-amylase gene family, the expression of,, andin the stem, leaf and silique pericarp of rapeseed increased with the development of organs. At 25 d after the final flowering, the expression ofandin leaves and silique pericarps of high-harvest index rapeseed was significantly higher than that of low harvest index rapeseed. The expression ofandin the silique pericarps of rapeseed with high harvest index was significantly higher than that of rapeseed with low harvest index at 15 d and 20 d after the final flowering. Taken together,andmay enhance the transport intensity of photosynthate to grains by promoting starch degradation in leaves and silique pericarps in rapeseed with high harvest index, andandmay regulate the transport of photosynthate to grains mainly by acting on starch degradation in silique pericarps.andmay also be involved in the regulation of starch in rapeseed seeds.
; harvest index; β-amylase; gene expression
2019-01-01;
2019-04-15;
2019-05-08.
10.3724/SP.J.1006.2019.94001
倪郁, E-mail: nmniyu@126.com
**同等贡献(Contributed equally to this work)
靳舒荣, E-mail: 1509512475@ qq.com; 王艳玫, E-mail:18113560032 @163.com
本研究由国家自然科学基金项目(31771694), 重庆市基础研究与前沿探索项目(cstc2018jcyjAX0263, cstc2016jcyjA0170), 中央高校基本科研业务费专项资金(XDJK2017B028)和国家现代产业技术体系建设专项(CARS-12)资助。
This study was supported by the National Natural Science Foundation of China (31771694), the Chongqing Basic and Advanced Research Project (cstc2018jcyjAX0263, cstc2016jcyjA0170), the Fundamental Research Funds for the Central Universities (XDJK2017B028), and the China Agriculture Research System (CARS-12).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20190505.1413.006.html
