MS-222在草鱼、花鲈、鲫鱼组织中的富集与消除
2019-07-23陈永平韩现芹李春青孙晓旺李宝华付志茹
陈永平,韩现芹,陈 建,李春青,孙晓旺,李 彤,李宝华,付志茹
( 农业农村部渔业环境及水产品质量监督检验测试中心(天津),天津 300221 )
随着人们生活水平的提高,对水产品的消费由温饱向质量转变,人们更关注水产品的质量安全和新鲜度[1-2]。水产品质量安全的挑战主要集中在生产和流通运输环节。在鲜活水产品长距离运输过程中因密度大、中途晃动产生应激反应,降低了经济价值[3]。为避免损伤和死亡,麻醉剂被广泛应用于水产品的保活运输中[4-7]。目前渔用麻醉剂已有10余种,其中间氨基苯甲酸乙酯甲磺酸盐(MS-222)的麻醉效果最好,对水产品安全无害[8],但会在水产品中残留,在人体内富集,损害人体生理机能[9-10]。因此使用MS-222后,水产品必须经过一段时间的休药期才能保证安全。为了保证水产品的食用安全性,国际上对MS-222在水产品中的使用进行了严格规定。如美国食品药品监督管理局规定,以MS-222麻醉的食用鱼必须经21 d休药期才可在市场上销售[11-12],加拿大规定的MS-222休药期为5 d[13-14]。我国对麻醉剂在水产品中的使用并没有制定相关的限量标准或政策法规,这给MS-222等的使用及监管带来不便。MS-222对大菱鲆(Scophthalmusmaximus)[8]、半滑舌鳎(Cynoglossussemilaevis)[15]麻醉效果的研究表明,不同水产动物的有效麻醉剂量差别较大[16],但MS-222在草鱼(Ctenopharyngodonidellus)、花鲈(Lateolabraxmaculatus)、鲫鱼(Carassiusauratus)、鲤鱼(Cyprinuscarpio)体内的残留及消除规律的研究尚未见报道。笔者研究了在水温(22±2) ℃下,草鱼、花鲈、鲫鱼在MS-222药浴10 h后各组织中的残留和消除特点,以确定合理的用药方案和休药期,为药物残留标准的限量提供基础数据,为监控MS-222残留和水产品安全提供参考。
1 材料与方法
1.1 材料
健康草鱼、花鲈、鲫鱼取自天津海升水产养殖有限公司,平均体质量分别为(100±20) g、(110±20) g和(90±20) g,试验前暂养7 d。试验在1.5 m×1.2 m×1.0 m的养殖水箱中进行,注入充分曝气的自来水体积200 L。水温保持在(22±2) ℃,每种鱼各3水箱,每箱60尾。非药浴期间,每日8:00和18:00投喂,药浴期间不换水、不投喂。
MS-222标准品(纯度>98%,购自美国Sigma-Aldrich公司);甲醇(Merck公司,色谱纯),甲酸(Merck公司,色谱纯),冰乙酸(国产分析纯),乙酸钠(国产分析纯);Agela C18固相萃取小柱(6 mL,500 mg,Agela 公司)。
仪器设备:AB 5500 Qtrap 三重四极杆质谱(AB Sciex 公司);电子天平(Sartorius公司);高速冷冻离心机(Sigma公司);高速组织匀浆机(飞利浦公司,转速10 000 r/min);MS1 Mini-shaker涡轮振荡器(IKA公司);MiLLi-Q纯水器(MiLLipore公司);氮吹仪(Organomation Associates公司);旋转蒸发仪(BUCHI公司);移液器(10、20、100、200、1000 μL,Eppendorf 公司)。
1.2 方法
1.2.1 MS-222在草鱼、花鲈、鲫鱼体内的富集试验
参考文献[13,17],试验水箱注入充分曝气的自来水200 L,MS-222质量浓度为50 mg/L,水温保持在(22±2) ℃,分别于药浴0.5、1、2、3、7 h和10 h时,随机取出草鱼、花鲈、鲫鱼各3尾。采样时,用清洁淡水将鱼表面的MS-222药液冲洗干净。取2 mL一次性注射器,自胸鳍基部插入心脏取血,放入含有0.3 mL 1%肝素钠的离心管中,混合均匀后离心,取上层血浆,置于-18 ℃保存。取出肝(胰)脏和鱼肉,分别进行均质处理,置于-18 ℃保存。
1.2.2 MS-222在草鱼、花鲈、鲫鱼体内的消除试验
试验进行10 h后,将草鱼、花鲈、鲫鱼转入清洁淡水中进行消除试验,每种鱼3个网箱,每个网箱60尾,试验过程保持充气,溶解氧>5 mg/L。在0.5、1、2、4、6、8、16、32、96、120、192、264、336、432、528、624、720 h时,每个水箱随机选取 3 尾,用清洁淡水将鱼体表面的 MS-222药液冲洗干净。按1.2.1方法采集血液、肌肉、肝(胰)脏样品,置于-18 ℃保存。
1.3 MS-222测定方法
采集样品处理:取均质好的肌肉、肝(胰)脏各2 g,血液2 mL于50 mL离心管中,各加入10 mL 0.2 mol/mL的乙酸—乙酸钠缓冲液(pH 4.2)和50%甲醇溶液,均质。用5 mL乙酸—乙酸钠缓冲液和5 mL 50%甲醇溶液清洗刀头,合并提取液,8000 r/min离心10 min。将上清液全部转移至50 mL梨形瓶中,于40 ℃水浴中减压旋转蒸发除去甲醇。离心管中剩余残渣中加入15 mL乙酸—乙酸钠缓冲液,涡旋1 min,8000 r/min离心5 min,重复1次。将上清液与旋蒸后的溶液合并。将待净化液转移至依次用3 mL甲醇与3 mL乙酸—乙酸钠缓冲液活化的固相萃取柱中,用2 mL 7.5%的甲醇溶液淋洗,抽至近干后用2 mL甲醇和1%乙酸溶液的混合液(体积比1∶1)进行洗脱。洗脱液收集于10 mL离心管中,过0.2 μm微孔滤膜后,待测。
MS-222标准溶液的配制和标准曲线的制备:称取10.0 mg的MS-222标准品,用甲醇配制成1.0 mg/mL的标准储备液。再用甲醇逐级稀释至2、10、50、100、200、500、1000 ng/mL的混合标准工作液。配制的MS-222标准溶液进行液相色谱—质谱/质谱分析。以目标物选择离子色谱峰面积为纵坐标,以相应的质量浓度为横坐标,绘制标准曲线,计算回归方程和相关系数。
MS-222测定回收率和检出限:取空白样品添加一定量的MS-222标准溶液,充分混匀,静置30 min,每组3个平行,再按照样品处理方法处理后进样,根据测定值计算组织中MS-222的含量。空白样品添加量分别为2、10、100 μg/kg,以MS-222的3倍信噪比(S/N)作为方法检出限。
色谱—质谱条件:色谱柱Shim-pack XR-ODS (2.2 μm,75 mm×2.1 mm);进样量:10 μL;柱温:40 ℃;流动相: A-0.1%甲酸,B-乙腈(55∶45,V∶V等梯度洗脱);流速:0.25 mL/min。电喷雾电离源正离子模式,喷雾电压4500 V,GS1:60,GS2:40,DP:65,EP:10,CXP:10,扫描模式选择反应监测。选择反应监测母离子、子离子和碰撞能量(表1)。

表1 目标化合物质谱条件
注:*为定量碎片离子.
1.4 数据处理
用Microsoft Excel 2010计算标准曲线、消除方程及休药期和绘制。消除方程为:
C=C0e-kt
式中,C表示药物含量,C0为残留消除对数曲线的截距(μg/kg或ng/mL),k表示消除速率常数,t代表消除时间(h)。
2 结 果
2.1 标准曲线与相关系数、方法检测限及回收率
在1~1000 ng/mL内MS-222质量浓度的线性关系良好,其线性方程分别为y=1.28×104x-2.84×104,r=0.9999。在本试验条件下,组织中MS-222检出限为1.0 μg/kg,MS-222检出限色谱见图1,定量限为2.0 μg/kg。各组织中低、中、高3个质量浓度加标水平的MS-222平均回收率为71.4%~91.2%,表明分析方法满足要求。
2.2 MS-222在3种鱼组织中的富集
药浴0~3 h时,草鱼、花鲈、鲫鱼血液、肌肉中MS-222残留量呈上升趋势,0~1 h时,上升快速,1~3 h,上升平缓,此阶段MS-222的吸收速率略大于代谢速率,但吸收和代谢趋于平衡,药浴3 h时MS-222含量达到峰值,药浴3 h后,呈轻微下降趋势;0~7 h,3种鱼肝(胰)脏中MS-222残留量总体呈上升趋势,0~2 h,上升趋势快速,2~7 h,上升趋缓,麻醉剂的吸收和代谢趋于平衡,药浴7 h时MS-222含量达到峰值,药浴7 h后,肝(胰)脏中MS-222残留量轻微下降;3种鱼组织中MS-222的残留量为C血液>C肝(胰)脏>C肌肉;肝(胰)脏中MS-222残留量达到峰值的时间均比血液和肌肉中延迟了1 h,3种鱼组织中MS-222富集残留量为C鲫鱼血液>C草鱼血液>C花鲈血液,C草鱼肌肉>C花鲈肌肉>C鲫鱼肌肉,C鲫鱼肝胰脏>C花鲈肝脏>C草鱼肝胰脏(表2)。
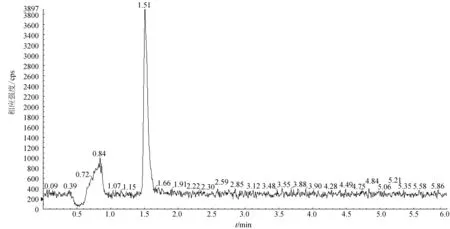
图1 鱼样检出限加标色谱图
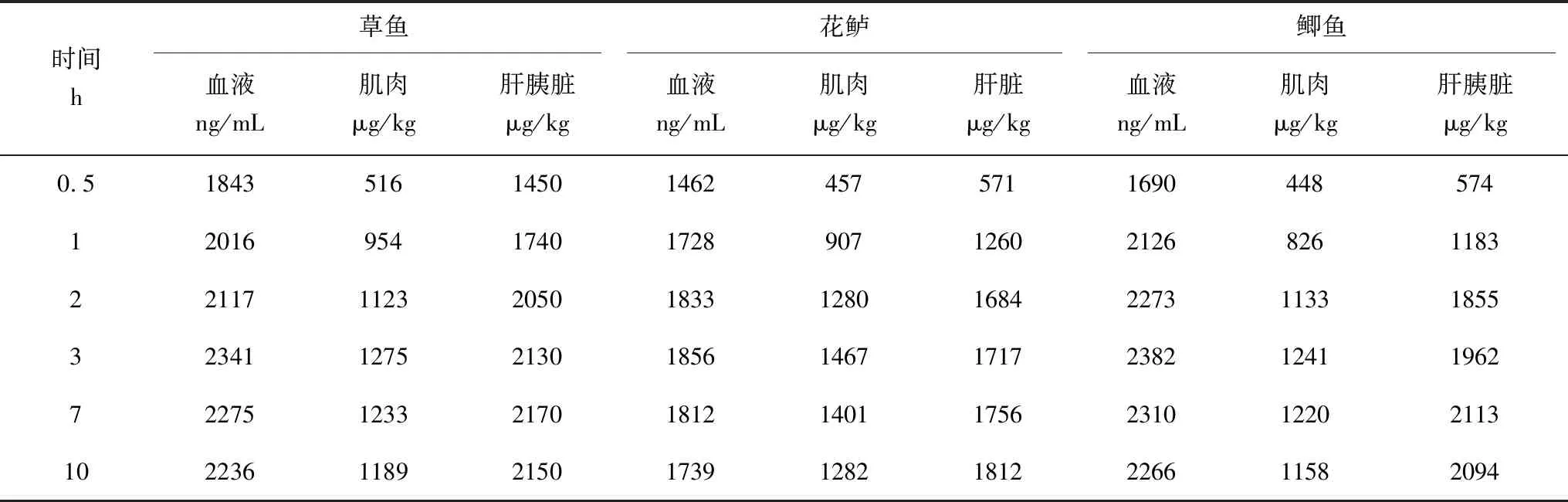
表2 水温(22±2) ℃时草鱼、花鲈、鲫鱼体内MS-222富集残留量
2.3 MS-222在草鱼、花鲈、鲫鱼组织中的消除
在0~720 h内,随时间的递增,3种鱼各组织中MS-222残留量逐渐降低,在0~8 h内MS-222残留量降低速率尤为明显,在8~528 h内降低速率趋于平缓,624 h后在3种鱼血液、肌肉组织中未检出MS-222残留,草鱼、花鲈、鲫鱼肝(胰)脏组织中残留量分别为3.6、4.8、4.5 μg/kg,在代谢720 h后,3种鱼各组织中均未检出MS-222(表3)。血液和肌肉组织中MS-222代谢速率无明显差异,肝(胰)脏代谢速率较前两种组织慢;花鲈富集MS-222残留较草鱼、鲫鱼小,草鱼、鲫鱼组织富集MS-222残留无明显差异,MS-222残留在草鱼、花鲈、鲫鱼中的消除速率无明显差异,所有组织中MS-222残留可以在30 d后代谢完全(表4~表6),建议在水温为(22±2) ℃时,MS-222在草鱼、花鲈、鲫鱼体内的休药期应为30 d以上。
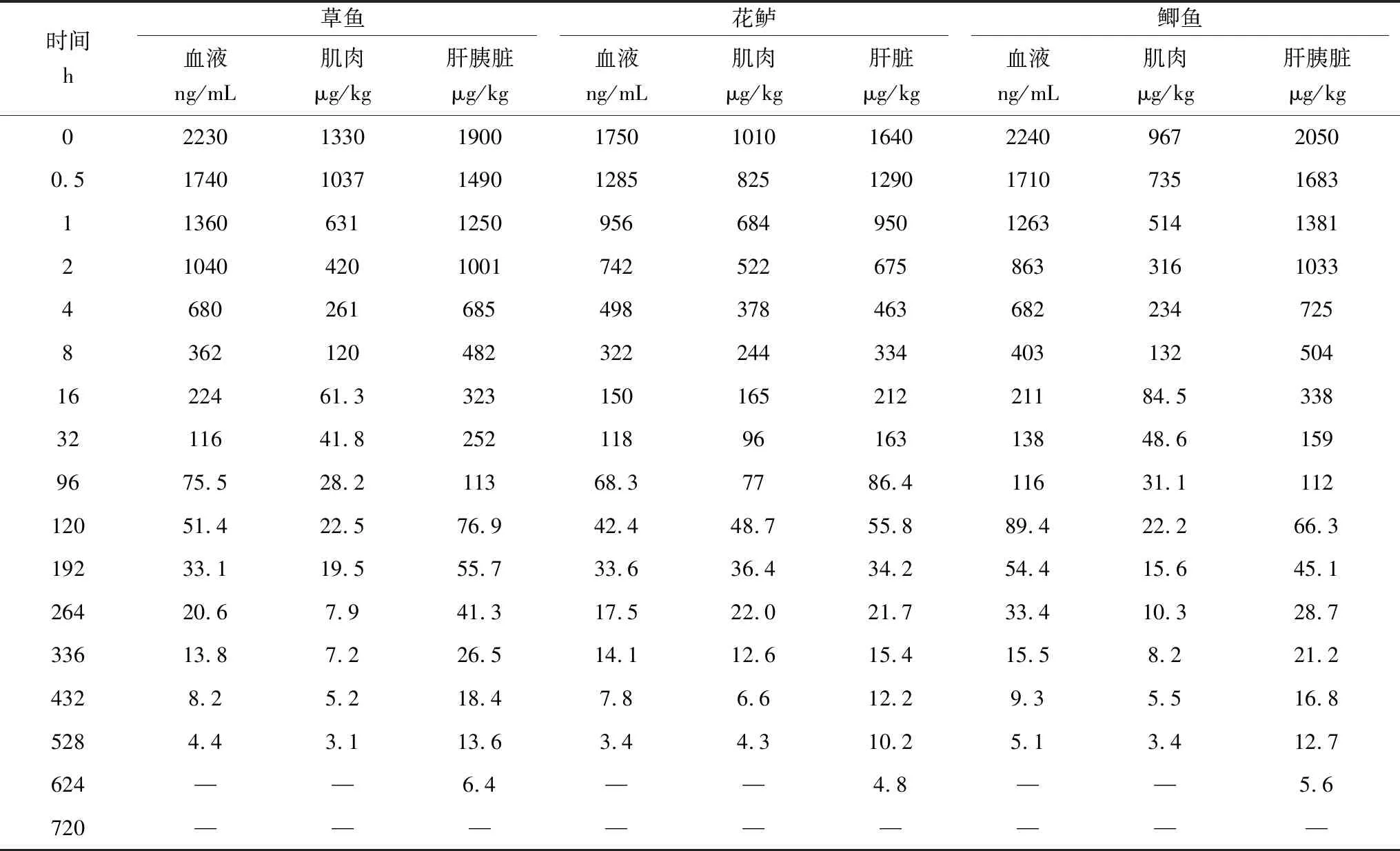
表3 水温(22±2) ℃时草鱼、花鲈、鲫鱼体内的MS-222消除残留量
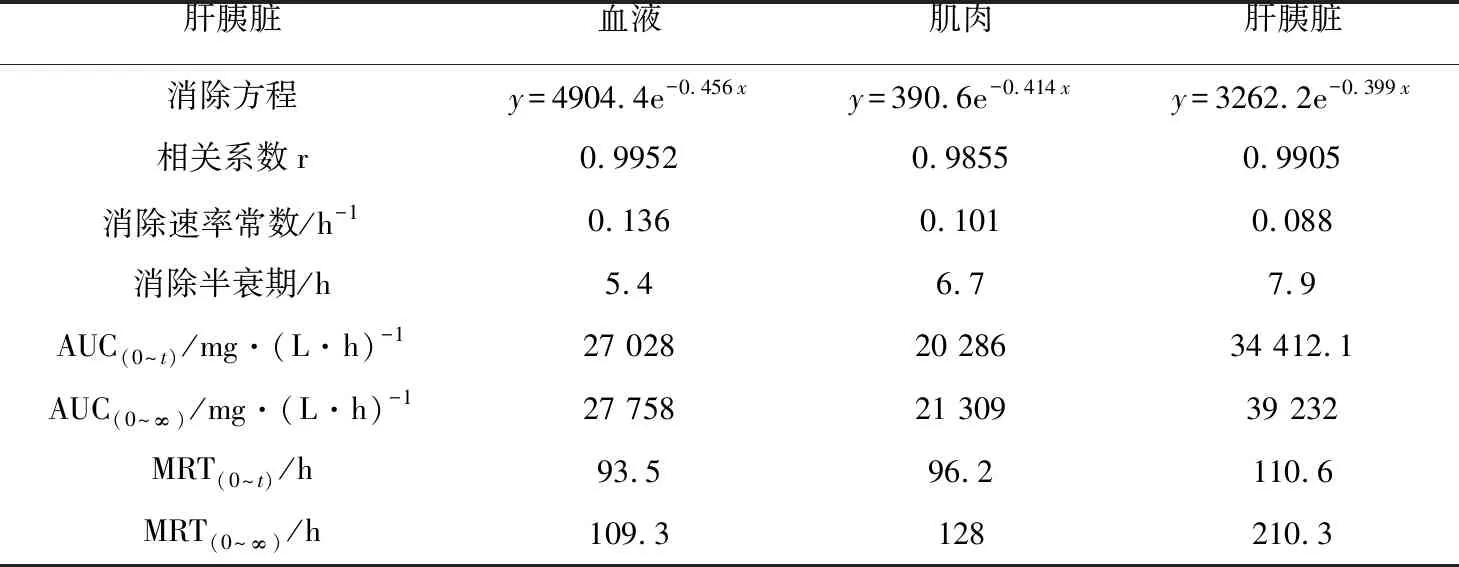
表4 MS-222在草鱼组织中的药代动力学参数
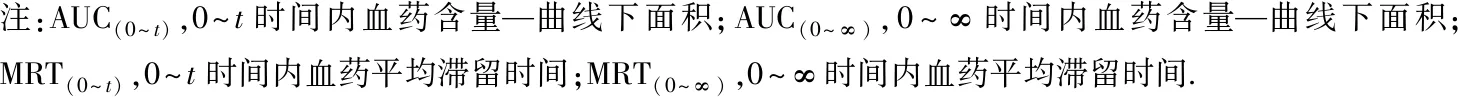
注:AUC(0~t),0~t时间内血药含量—曲线下面积;AUC(0~∞),0~∞时间内血药含量—曲线下面积;MRT(0~t),0~t时间内血药平均滞留时间;MRT(0~∞),0~∞时间内血药平均滞留时间.
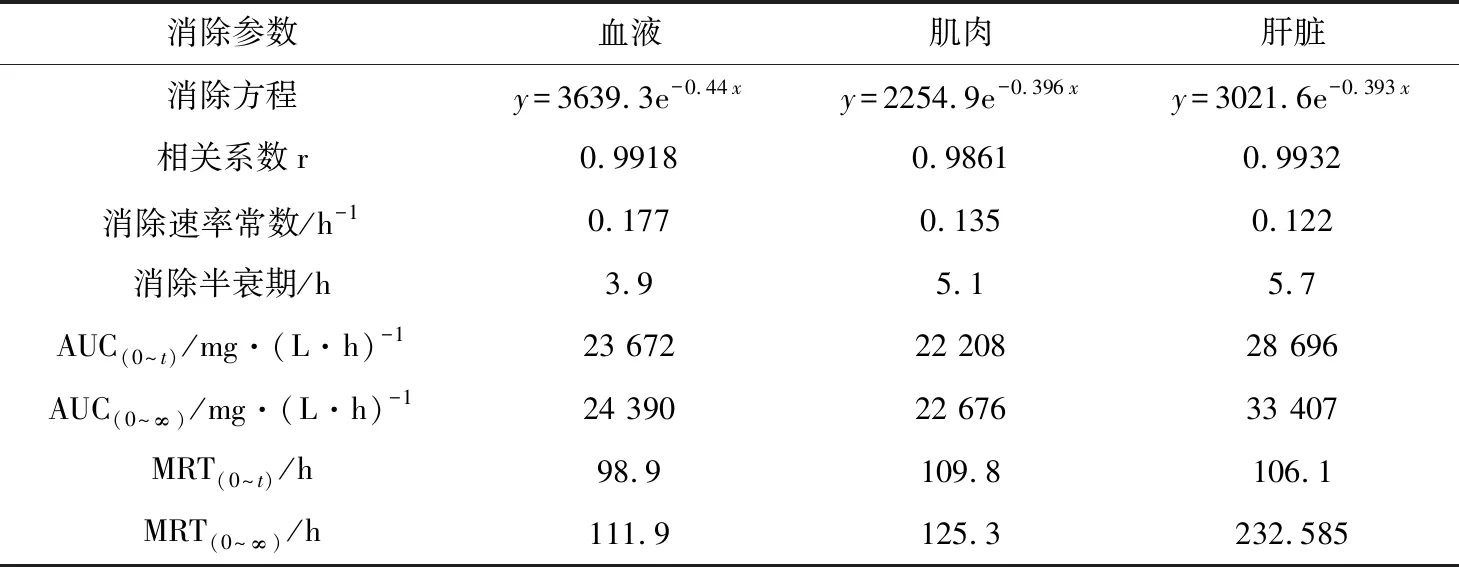
表5 MS-222在花鲈组织中的药代动力学参数
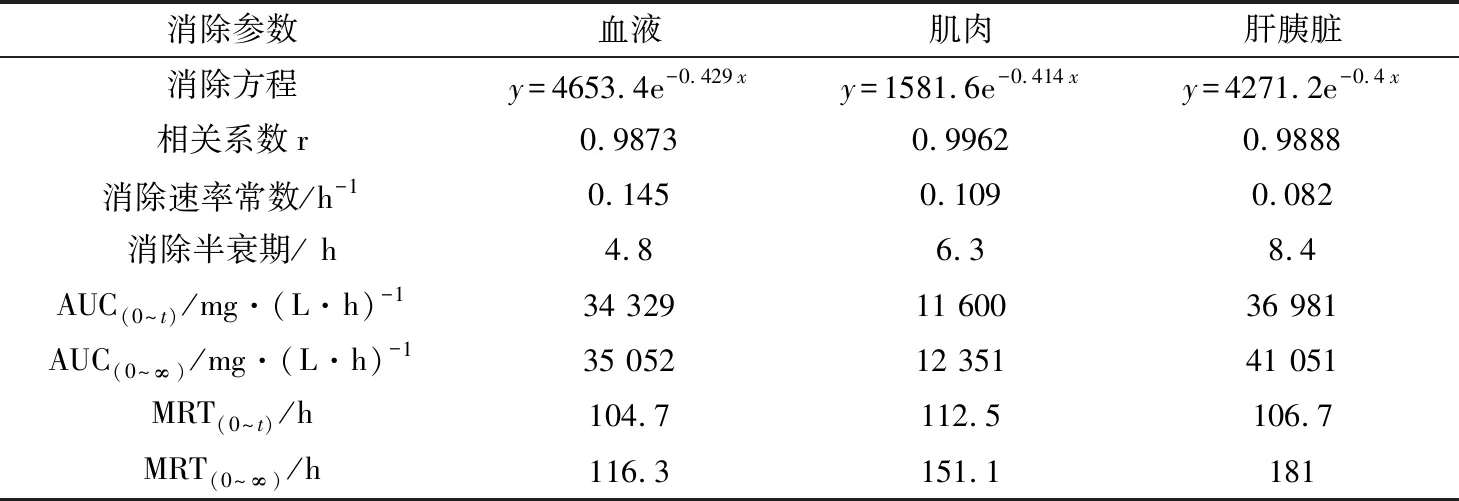
表6 MS-222在鲫鱼组织中的药代动力学参数
3 讨 论
3.1 MS-222在草鱼、花鲈、鲫鱼不同组织中的富集
药浴会使MS-222富集到草鱼、花鲈、鲫鱼的不同组织中,血液中MS-222的残留量较肝(胰)脏和肌肉高,肝(胰)脏中的残留量高于肌肉。有研究表明,水产鱼类脑组织和血液中MS-222的富集程度低于肌肉和肝脏,且消除速度更快[18]。但是,MS-222在鱼体的富集和消除规律也可能与鱼体的环境条件、种类以及药物含量等因素有关。这与MS-222在大菱鲆体内的富集消除规律基本一致[5]。血液、肌肉、肝脏中的MS-222富集残留量分别在药浴3、3、7 h后达到峰值,随后草鱼、花鲈、鲫鱼的血液、肌肉、肝(胰)脏的残留量分别比峰值下降了4.5%、6.7%、0.9%,6.3%、7.6%、2.6%,4.9%、6.7%、0.9%。10 h内血液、肌肉、肝(胰)脏的富集残留草鱼和鲫鱼较为接近,分别为2236、2266 ng/mL(血液),1189、1158 μg/kg(肌肉),2150、2094 μg/kg(肝胰脏),草鱼和鲫鱼组织中MS-222富集残留量均大于花鲈(1739 ng/mL、1282 μg/kg、1812 μg/kg)。
3.2 MS-222在草鱼、花鲈、鲫鱼不同组织中残留量的消除规律
消除半衰期和药物平均滞留时间是体现药物在动物体内消除特征的两个重要参数(表4)。MS-222在草鱼血浆、肌肉、肝胰脏组织中的消除半衰期分别为5.4、6.7、7.9 h;在花鲈血浆、肌肉、肝脏组织中的消除半衰期分别为3.9、5.1、5.7 h;在鲫鱼血浆、肌肉、肝胰脏组织中的消除半衰期分别为4.8、6.3、8.4 h。MS-222在草鱼血浆、肌肉、肝胰脏组织中平均滞留时间分别为93.5、96.2、110.6 h;在花鲈血浆、肌肉、肝脏组织中平均滞留时间分别为96.8、96.2、103.1 h;在鲫鱼血浆、肌肉、肝胰脏组织中平均滞留时间分别为104.7、112.8、110.5 h。MS-222在各组织中的消除速率为V肝(胰)脏
3.3 MS-222休药期的确定
MS-222在草鱼、花鲈、鲫鱼组织中的富集和消除代谢规律为制定MS-222在水产品中的休药期提供了科学依据。本试验结果表明,在水温(22±2) ℃下,草鱼、花鲈、鲫鱼组织中的MS-222残留消除至检出限以下需要30 d以上,因此,建议在(22±2) ℃时,MS-222在草鱼、花鲈、鲫鱼体内的休药期应为30 d以上。
