罗非鱼无乳链球菌拮抗株的筛选及特性研究
2019-07-23付维来易敢峰
王 蕊,付维来,陈 思,陈 晶,易敢峰
( 1.福建大北农水产科技有限公司,福建 漳州 363500;2.北京大北农科技集团股份有限公司,饲用微生物工程国家重点实验室,北京 100080 )
2016年全国罗非鱼(Oreochromis)养殖量为1.866×106t,比2015年提高了4.88%,稳居世界首位。罗非鱼生长快、产量高、抗病力强,是淡水养殖优秀品种。但是近年来,全球性罗非鱼链球菌病的暴发给罗非鱼养殖业造成了巨大的经济损失[1-2]。抗生素[3]一直是防控该病的首选,但是抗生素的残留及病原菌耐药性等问题突显,威胁养殖环境和人类的健康。
益生菌以安全、有效的特性受到广泛的研究与应用。据已有研究报道,对罗非鱼链球菌有抑制作用的菌株涉及枯草芽孢杆菌(Bacillussubtilis)、地衣芽孢杆菌(B.licheniformis)、苏云金芽孢杆菌(B.thuringiensis)、解淀粉芽孢杆菌(B.amyloliquefaciens)、蜡样芽孢杆菌(B.cereus)、凝结芽孢杆菌(B.coagulans)、诺卡氏菌(Nocardiasp.)及植物乳杆菌(Lactobacillusplantarum)等[4-8]。诸多研究表明,芽孢杆菌具有拮抗致病菌、净化池塘水质、提高水产动物生长性能的效果[9-11]。因此,芽孢杆菌以其适应性强、耐加工、生长快、分布广,且具有较多的生物学特性,如分泌多种生物酶、降解亚硝酸盐和氨态氮、产生抑制有害菌生长的代谢产物等,被广泛用于饲料添加剂及水质改良中。
笔者在点种法和牛津杯法的基础上进行拮抗株筛选方法的改进,从吉富罗非鱼(O.niloticusGIFT)肠道中分离筛选出一株安全、显著抑制无乳链球菌(Streptococcusagalactiae)的土著芽孢杆菌,进行亚硝酸盐降解能力、产酶能力、药敏性等生物学特性检测以及最佳抑菌活性与发酵时间的关系研究,旨在为当地罗非鱼链球菌病防治提供良好的菌种资源及该菌株的发酵生产提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种
指示菌为本实验室分离的无乳链球菌S-2,来自福建链球菌发病症状典型的濒死罗非鱼鱼体。待分离样品来自福建漳州,主要针对第1年罗非鱼链球菌病高发,第2年仍然养殖罗非鱼品种的养殖池塘。共采集6口池塘的底泥、水样及健康罗非鱼肠道样品共计18份,采集地点为漳州市区、漳浦县、云霄县、长泰县、南靖县。
1.1.2 培养基
LB培养基、新鲜一次性兔血琼脂平板、蛋白酶检测培养基、纤维素酶检测培养基、淀粉酶检测培养基[12]、发酵培养基。
发酵培养基:玉米面5 g/L,蛋白胨10 g/L,蔗糖4 g/L,磷酸二氢钾1 g/L,七水合硫酸亚铁0.25 g/L,七水合硫酸镁0.5 g/L,一水合硫酸锰0.25 g/L,碳酸钙1 g/L,消泡剂0.5 mL/L;pH 7.0~7.5。
1.2 方法
1.2.1 菌株的分离
(1)底泥样:取约1 g池塘泥样溶解在10 mL无菌水中振荡均匀,85 ℃水浴加热15 min。
(2)水样:取20 mL池塘水样,85 ℃水浴加热15 min。
(3)罗非鱼肠道样品:用镊子将生理盐水中的罗非鱼肠道取出至10 mL无菌水中充分研磨,85 ℃水浴加热15 min。
各样品均梯度稀释后涂平板,37 ℃培养箱倒置培养。将平板生长的菌株分离纯化作为供试菌株。
1.2.2 溶血性检测
溶血试验是检测供试菌株是否对动物红细胞产生溶解反应,是益生菌安全性评价的一部分。将供试菌株接种到新鲜的兔血琼脂平板上,放于37 ℃培养箱倒置培养,筛选无溶血性的菌株进行下一步检测。
1.2.3 拮抗株的筛选
(1)指示菌涂布平板法:无乳链球菌接种于LB液体培养基中。37 ℃,180 r/min摇床培养24 h,取100 μL无乳链球菌菌液按10-2稀释度稀释并涂板,将供试菌株点于平板上,37 ℃培养箱倒置培养。观察抑菌圈,初步筛选出有抑菌效果的菌株。
(2)指示菌倒平板法:将无乳链球菌及初步筛选的菌株分别接种于LB液体培养基,37 ℃,180 r/min摇床培养24 h。为了找到无乳链球菌菌液最适接种密度及培养基最适浇注量,设置接种密度为106、107cfu/mL和108cfu/mL,接种量均为50 μL,分别加入到还未凝固的LB固体培养基中(20、25 mL和30 mL),摇匀,倾倒至已放有牛津杯的平板中,待培养基凝固取出牛津杯。向孔中加入过滤除菌的发酵上清液100 μL,37 ℃培养箱培养24 h观察抑菌圈大小。
(3)拮抗株抑菌物质的抑菌活性对温度的耐受性:取发酵液10 mL,过滤除菌保留上清液,分别于60、80、100、120 ℃处理30 min,自然冷却后指示菌倒平板法测抑菌活性。以37 ℃培养不做任何处理的发酵上清液做对照。
1.2.4 菌种鉴定
1.2.4.1 菌体形态观察
革兰氏染色法观察菌体形态。
1.2.4.2 生理生化鉴定
方法参照伯杰氏细菌鉴定手册[13]进行。
1.2.4.3 16S rRNA 基因测序
利用细菌通用引物27F/1492R进行靶基因的扩增,16S rRNA基因PCR引物:正向引物27F,5′-AGAGTTTGATCCTGGCTCAG-3′,对应于大肠杆菌(Escherichiacoli)第8~27碱基位置;反向引物P6,5′-GGTTACCTTGTTACGACTT-3′,对应于大肠杆菌第1492~1510碱基位置。目的条带为1.5 kb,0.8%琼脂糖凝胶电泳检测PCR产物并测序,在美国国立生物技术信息中心数据库对序列进行比对,得到未知菌与基因库中已知菌的相似度,用邻接法进化树分析该菌的系统发育地位。
1.2.5 最佳抑菌活性与发酵时间关系的测定
将待测菌株进行30 L发酵罐发酵培养,每隔4 h取发酵液镜检芽孢产生情况并检测抑菌活性,分析发酵时间与抑菌活性的关系。
1.2.5.1 种子液制备
一级种子液:挑取菌株单菌落接种于5 mL LB液体培养基,37 ℃,180 r/min摇床培养24 h。
二级种子液:吸取1 mL一级种子液于100 mL LB液体培养基,37 ℃,180 r/min培养24 h。
1.2.5.2 发酵罐发酵
将上述制备的二级种子液以1%的接入量接入发酵罐进行发酵,发酵温度37 ℃,转速70~100 r/min,灌压0.5 Mpa,通风比1∶0.6~1∶0.4,pH5.5~7.5,发酵时间16~20 h。
1.2.6 生物酶检测
将待测菌点种于蛋白酶检测平板上,以透明圈大小显示该菌株产蛋白酶活力。
将待测菌点种于纤维素酶检测平板上,培养24 h后,在培养基中倒入刚果红溶液(1 mg/mL)染色10~15 min,倒掉刚果红溶液,加入1 mol/L的NaCl溶液,15 min后倒掉NaCl溶液。根据透明圈大小判断纤维素酶活力。
将待测菌点种于淀粉酶检测平板上,培养24 h后固体碘熏蒸着色。具体方法:取1 g固体碘均匀平铺在白纸上,将培养好的平皿倒置在固体碘上熏蒸30 s,并均匀转动。淀粉遇碘变为蓝色,根据透明圈大小判断淀粉酶活力大小。
1.2.7 亚硝酸盐降解试验
1.2.7.1 亚硝酸盐标准曲线
配制不同质量浓度的亚硝酸盐溶液(0~4 mg/L),置于酶标仪下测量550 nm处吸光值(OD550),作亚硝酸盐质量浓度与OD550的对应性标准曲线。
1.2.7.2 亚硝酸盐检测培养基
蒸馏水50 mL,鱼料0.05 g,2.5 mg/L的亚硝酸钠溶液50 μL。121 ℃,高压蒸汽灭菌20 min。试验组接种50 μL菌液(终密度为105cfu/mL),对照组加50 μL生理盐水,每组3个平行置于37 ℃,180 r/min摇床培养,格里斯试剂法测定OD550,用标准曲线计算对应亚硝酸盐质量浓度。
1.2.8 药敏试验及安全性试验
1.2.8.1 药敏试验
采用纸片扩散法对待测菌株进行药物敏感性测定。待测菌株接种于LB液体培养基,37 ℃,180 r/min培养24 h,菌液密度约108cfu/mL,取10-2稀释度100 μL菌液涂布平板,取药敏片均匀放于平板中,37 ℃培养16~18 h,观察抑菌圈。
1.2.8.2 安全性检测
参考文献[14],采用背部肌肉注射法进行菌种安全性检测。设对照组和试验组,每组3个平行。每个平行组10尾罗非鱼,平均质量为(8.3±1.4) g。试验组每尾罗非鱼分别注射1×109、1×108、1×107cfu/mL的菌液200 μL,对照组注射同等量的生理盐水,正常饲喂7 d,观察罗非鱼的死亡情况。
1.2.9 菌株LT3-1对无乳链球菌的影响
试验用鱼为吉富罗非鱼,采用循环水养殖,规格一致的罗非鱼120尾,分成对照组和试验组,每组3个平行,每组平行20尾,初始体质量(46.91±0.17) g。对照组只饲喂饲料,试验组饲喂添加菌株LT3-1的饲料,菌粉活菌含量1010cfu/g,添加量0.05%。养殖4周后采取攻毒试验,腹腔注射密度为1×108cfu/mL的无乳链球菌S-2菌液0.2 mL,每日观察并统计试验鱼的发病情况,记录攻毒后14 d内的死亡率。
2 结果与分析
2.1 菌株分离结果
经过分离纯化18份样品,初步得到77株芽孢菌。池水、底泥及健康罗非鱼肠道中各得到20、29、28株芽孢菌(表1)。
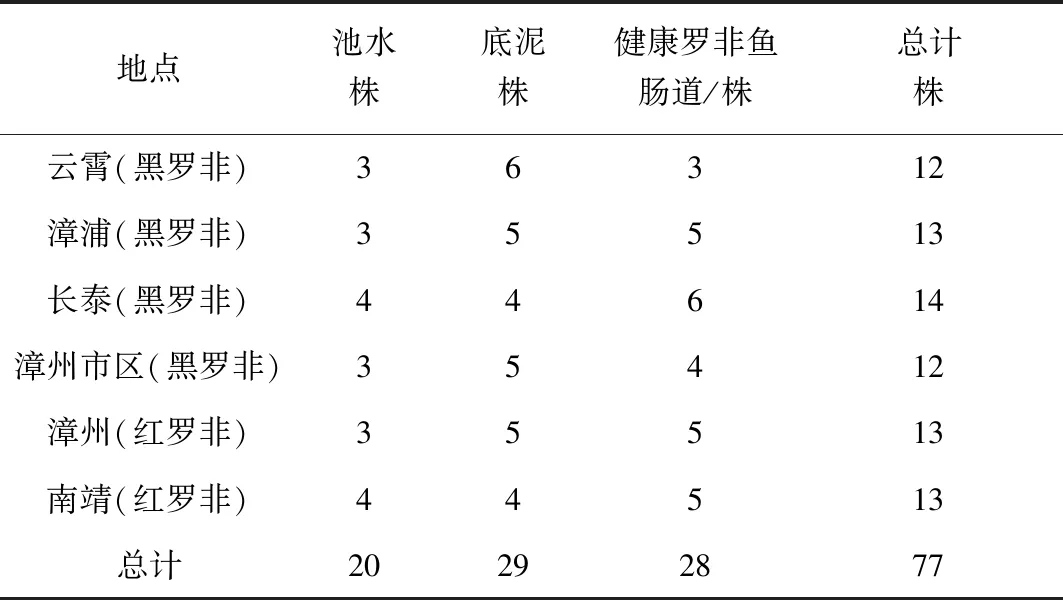
表1 样品的菌株分离数量
2.2 溶血性检测
经过血琼脂板培养,共筛选到30株无溶血性芽孢菌,并用于抑菌能力检测。
2.3 拮抗菌株筛选
试验发现,指示菌的接种密度以及平板培养基的薄厚影响抑菌圈的大小。因此本试验进行了指示菌的接种密度及平板培养基浇注量(20、25、30 mL)的探索。最终确定25 mL培养基与1×107cfu/mL指示菌50 μL混匀制板,得到的抑菌圈最清晰。经筛选,5株芽孢菌具有抑制无乳链球菌的能力,其中菌株LT3-1抑菌效果最强且稳定,抑菌圈平均直径可达(25.30±0.57) mm(图1),因此,对菌株LT3-1进行进一步研究。试验发现,菌株LT3-1抑菌物质活性随着温度的升高(60、80、100、120 ℃)逐渐减弱,与不做任何处理的发酵上清液对照比较,抑菌圈直径自26.65 mm降至10.10 mm,但依然存在抑菌活性(图2)。说明菌株LT3-1抑菌物质在一定程度上可以耐受较高的温度,此特点使该菌在发酵液后处理工艺上具有明显优势。
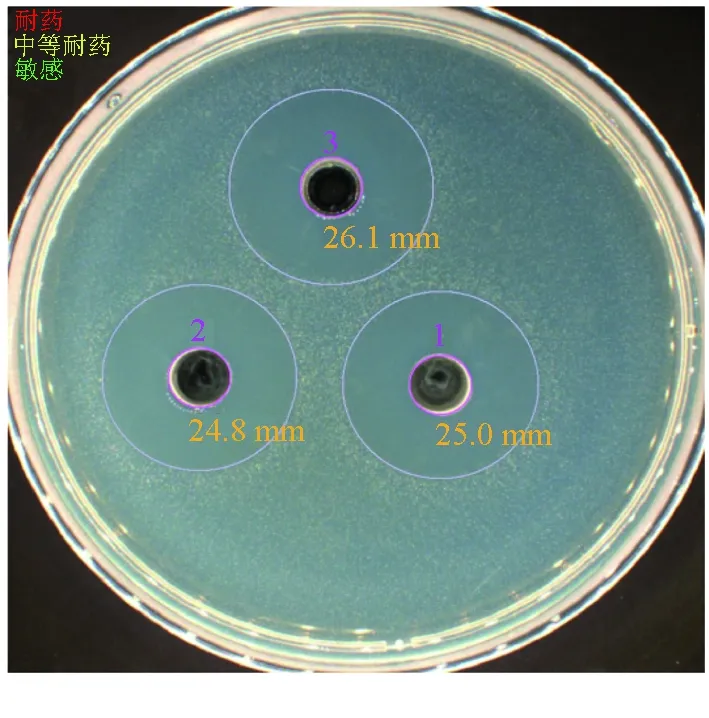
图1 菌株LT3-1发酵上清液抑菌活性使用SCAN 1200,6.1.3.0版分析的样品.
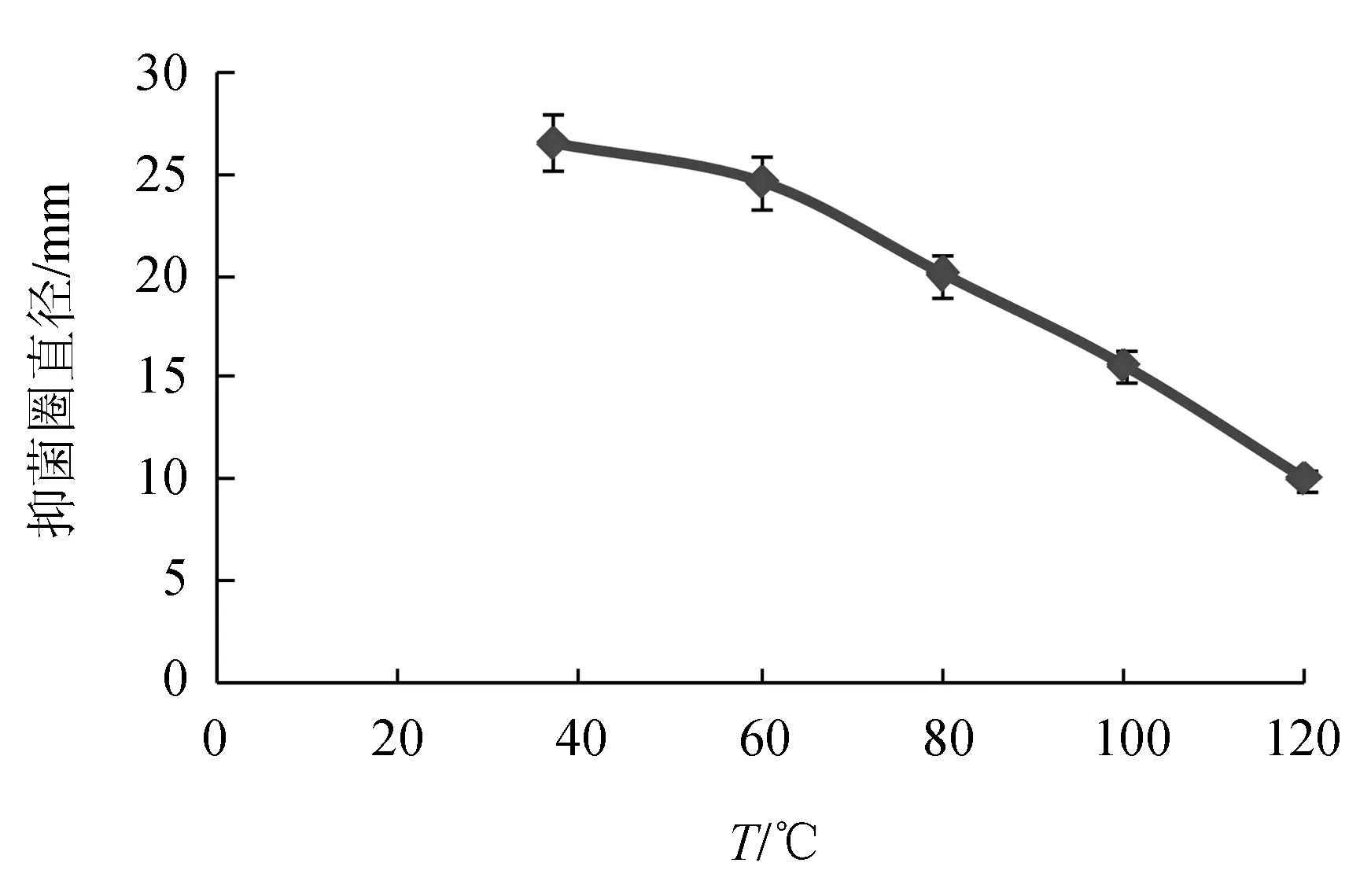
图2 温度对菌株LT3-1抑菌物质活性的影响
2.4 菌株鉴定
2.4.1 形态观察
菌株LT3-1在37 ℃,LB平板上生长为扁平、边缘不整齐的白色菌落。革兰氏染色阳性,长杆状(图3a)。芽孢形态见图3b,菌体膨大,中间呈现空心状。
2.4.2 生理生化测定及16S rRNA基因序列鉴定
菌株LT3-1与枯草芽孢杆菌模式菌株DSM10T[13]的生理生化指标测定结果见表2。由表2可见,菌株LT3-1与枯草芽孢杆菌模式菌株DSM10T的测定结果相同。
菌株LT3-1 16S rRNA基因测序后,得到的序列长度为1420 bp,比对结果表明,该菌与枯草芽孢杆菌BGSC 3A28最近,相似性为99%。采用Mega 4.0软件邻接法构建16S rRNA基因系统发育树(图4),菌株LT3-1与枯草芽孢杆菌模式种DSM10T聚在同一分支,结合生理生化结果,菌株LT3-1鉴定为枯草芽孢杆菌,16S rRNA基因GenBank序列号为MG719524。

表2 菌株LT3-1生理生化特征
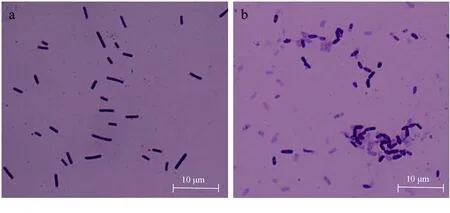
图3 菌株LT3-1镜下形态示意a.普通状态下的菌体; b.产生芽孢的菌体.
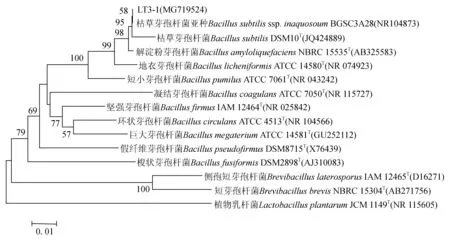
图4 16S rRNA基因系统发育分析
2.5 最佳抑菌活性与发酵时间的关系
枯草芽孢杆菌LT3-1随着发酵时间的增加抑菌活性增加,发酵4 h后,上清液出现较弱抑菌活性(图5)。16~20 h时抑菌活性较强,虽有上升,但是上升程度较小,基本保持稳定。经显微镜观察,枯草芽孢杆菌LT3-1发酵16 h出孢完全,因此,出孢率与抑菌活性存在一定的正相关性。
2.6 生物酶检测
试验表明,枯草芽孢杆菌LT3-1可以水解酪蛋白,形成直径为9 mm的透明圈(图6a),说明该菌具有分泌蛋白酶的能力;淀粉平板遇碘显蓝色,而菌落周围出现直径9 mm透明圈(图6b),说明该菌具有分泌淀粉酶的能力;纤维素酶平板经刚果红染色,菌落周围形成直径12 mm的透明圈(图6c),说明该菌具有水解羧甲基纤维素钠(CMC-Na)的能力,可以分泌纤维素酶。
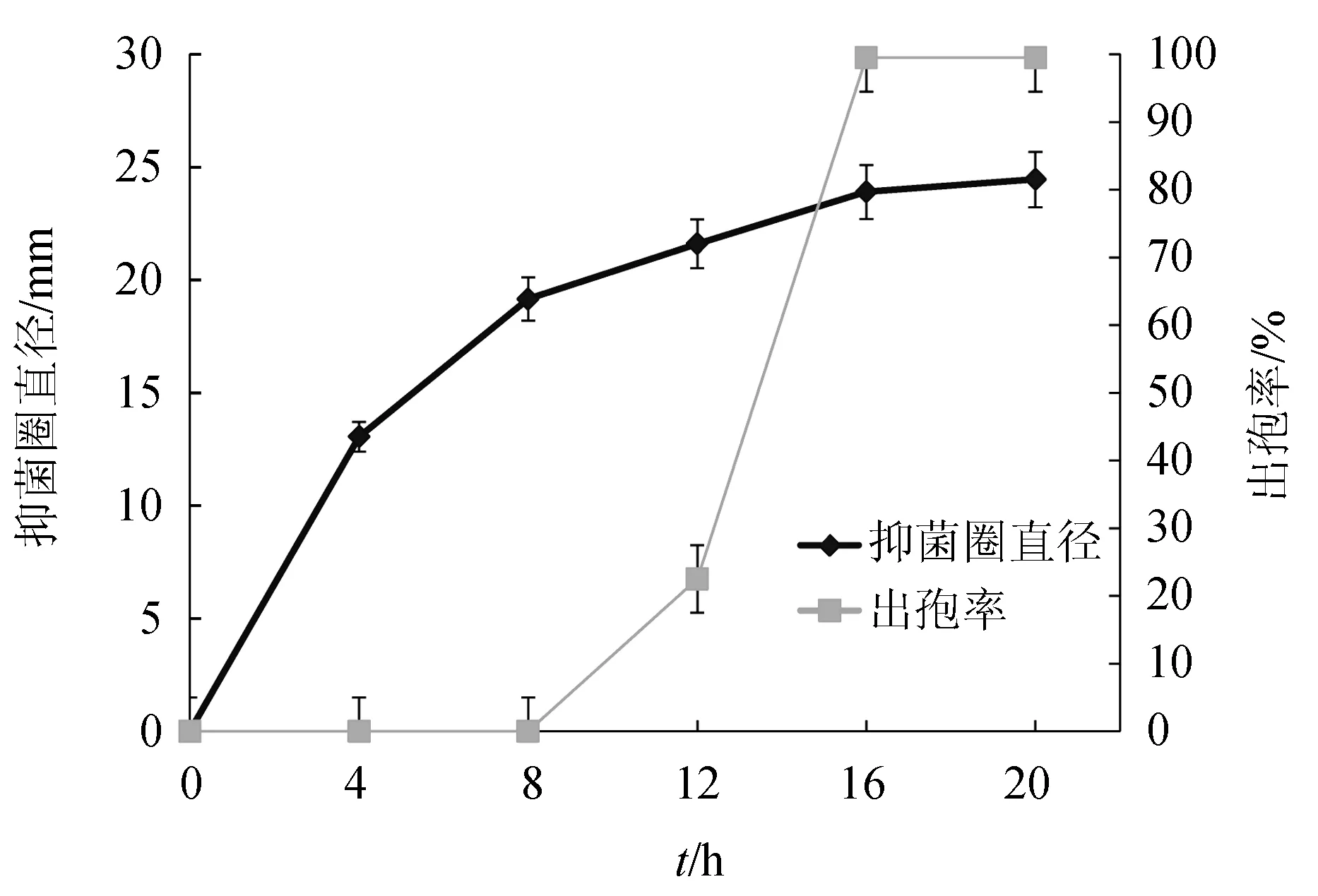
图5 枯草芽孢杆菌LT3-1抑菌活性及出孢率随发酵时间的变化

图6 枯草芽孢杆菌LT3-1水解酪蛋白(a)、淀粉(b)及羧甲基纤维素钠(CMC-Na)(c)结果
2.7 亚硝酸盐降解试验
经检测,密度为105 cfu/mL的枯草芽孢杆菌LT3-1可以显著降低亚硝酸盐水平,6 h即可将亚硝酸盐质量浓度由2.5 mg/L降至0.03 mg/L(图7),亚硝酸盐降解率可以达98.8%,净水效果显著(P<0.05)。
2.8 药敏试验及安全性试验
2.8.1 药敏试验
试验检测了枯草芽孢杆菌LT3-1对7个类型9种抗生素的敏感性。检测结果表明,枯草芽孢杆菌LT3-1对所检测的9种抗生素红霉素、青霉素、氨苄西林、头孢噻肟、四环素、氧氟沙星、万古霉素、氯霉素、利福平均表现为敏感(表3)。
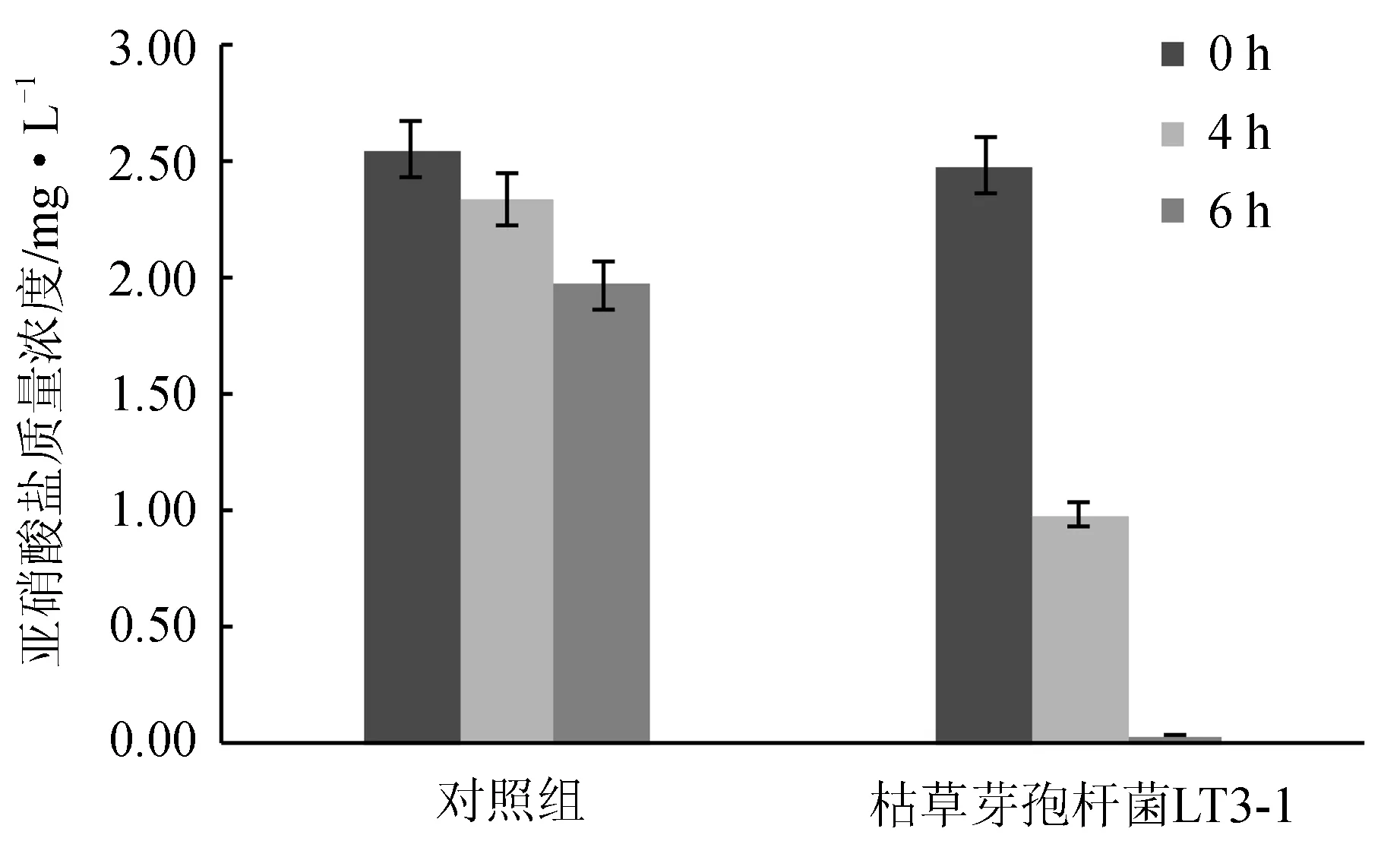
图7 枯草芽孢杆菌LT3-1对亚硝酸盐的降解效果
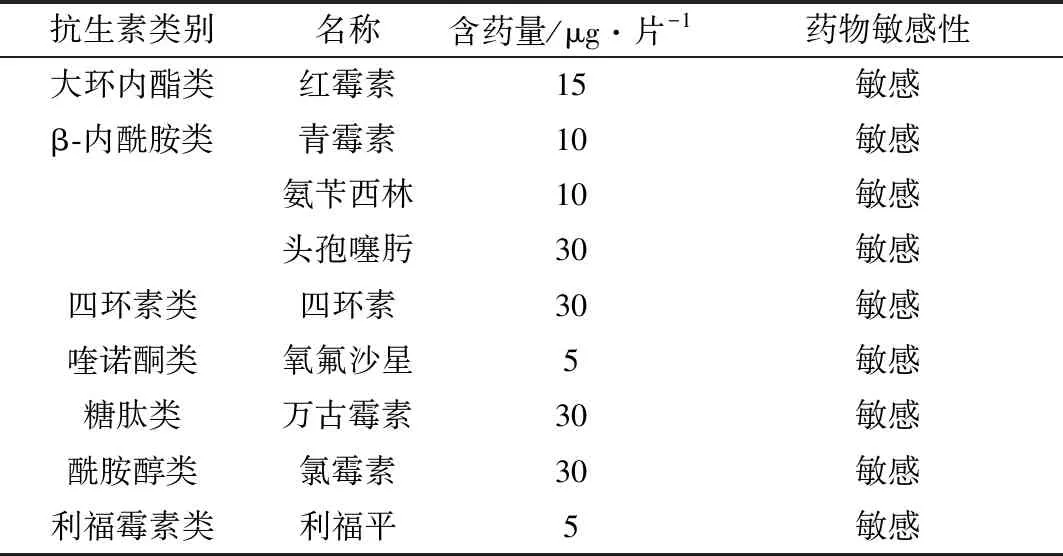
表3 枯草芽孢杆菌LT3-1药物敏感试验结果
2.8.2 安全性试验
经过1周的安全性试验,结果表明,肌肉注射密度为1×107cfu/mL的枯草芽孢杆菌LT3-1菌液后,罗非鱼可以正常存活,无异常现象。
2.9 枯草芽孢杆菌LT3-1对无乳链球菌感染的影响
攻毒试验第6 d后出现死亡情况,死亡高峰期出现在攻毒后的第7~9 d(图8)。对照组的成活率为(73.33±6.67)%,显著低于试验组(93.33±3.33)%,(P<0.05)。表明枯草芽孢杆菌LT3-1对无乳链球菌感染吉富罗非鱼的拮抗效果显著。
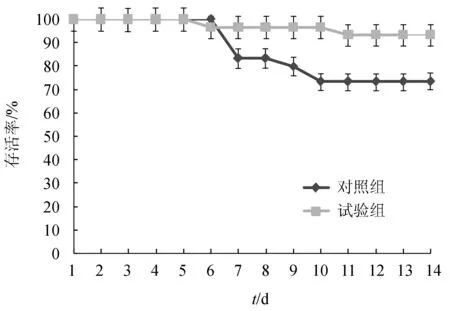
图8 攻毒14 d内试验鱼的存活率
3讨 论
罗非鱼链球菌病病原主要为海豚链球菌(S.iniae)和无乳链球菌,2009年后主要流行病原为无乳链球菌,有新的株型和克隆系出现[15-17],但并未发现有菌种变化。因此本研究以罗非鱼无乳链球菌为指示菌株进行拮抗菌的筛选。
刘观斌等[9]筛选出1株拮抗菌——蜡样芽孢杆菌NY5,对无乳链球菌的抑制圈直径达26.67 mm,对50 mg/L的亚硝酸盐氮12 h去除效率达到100%。李仕成[5]筛选到1株解淀粉芽孢杆菌J4,对无乳链球菌的抑制圈直径达16 mm,并且发现,饲料中添加107cfu/g和108cfu/g的解淀粉芽孢杆菌J4,可显著降低饵料系数,提高罗非鱼的质量增加率、生长性能、非特异性免疫力及抗氧化能力。由此可见,芽孢杆菌可同时具备拮抗无乳链球菌和净水、促生长、提高免疫力的功能。本研究通过体内和体外两种方式对筛选到的枯草芽孢杆菌LT3-1的拮抗无乳链球菌效果进行了分析,体外抑菌圈直径达(25.30±0.57) mm;体内动物试验表明,添加枯草芽孢杆菌LT3-1的试验组罗非鱼攻毒后存活率达93.33%,显著高于对照组(73.33%)(P<0.05)。枯草芽孢杆菌LT3-1具备快速降解水体亚硝酸盐的能力,2.5 mg/L的亚硝酸盐氮6 h降解率达98.8%,高于枯草芽孢杆菌HAINUP40[18]的降亚硝酸盐能力(12 h亚硝酸盐去除率94.12%)。枯草芽孢杆菌LT3-1对水产动物的生长性能、免疫力及抗氧化能力方面的研究还有待开展。
益生菌对病原菌的拮抗作用方式并不相同。乳酸菌可通过分泌有机酸降低周围环境pH或分泌过氧化氢、双乙酰、细菌素等代谢产物达到抑制病原菌的效果[19-20]。有些芽孢杆菌也可以通过分泌有机酸抑制病原菌如凝结芽孢杆菌。但是大多数芽孢杆菌一般通过分泌脂肽类、聚酮类、蛋白类抑菌物质发挥对病原菌的抑菌作用。连燕萍[21]研究表明,解淀粉芽孢杆菌MG-3的抑菌物质L-1为脂肽类抗生素IturinA。分离自海参肠道的枯草芽孢杆菌HS-A38分泌的抑菌物质为直链抗菌脂肽,主要组分为杆菌霉素Bacillomycin D[22-24]。陈辉[7]发现1株诺卡氏菌可以显著抑制海豚链球菌的生长,其抑菌物质耐高温,对蛋白酶敏感,具有酸碱稳定性,硫酸铵沉淀试验证明为蛋白质类物质。本研究中筛选得到的枯草芽孢杆菌LT3-1的抑菌物质可以耐受较高温度。其过滤除菌后的发酵上清液具有显著的抑菌活性,说明枯草芽孢杆菌LT3-1对无乳链球菌的抑制作用并不是通过营养竞争而是通过分泌抑菌物质实现的,其抑菌物质的主要组分需进一步研究。其次,该菌发酵0~4 h时,发酵上清液抑菌活性虽然有提高但是处于较弱的水平,发酵4~16 h为对数期,其上清液抑菌活性明显增强,在发酵16 h时芽孢产生完全,达到稳定期,其抑菌活性也达到最大,推测该菌的抑菌物质可能为次级代谢产物,可进行发酵生产获取代谢产物,建议发酵终点为16 h。
溶血是致病菌的致病机理之一,与动物安全性共同被认为是益生菌安全性评价的重要方面[25-27]。诸多学者把溶血性、常见抗生素敏感性及对宿主的安全性纳为安全性评估指标中。王晓琳等[28]研究表明,芽孢杆菌BZ5株和溶藻弧菌(Vibrioalginolyticus)VZ5株均未表现出溶血特征,且对多数常见抗生素敏感或中度敏感。在106cfu/mL菌液密度下,两株菌未对凡纳滨对虾(Litopenaeusvannamei)表现出明显的毒害作用。本研究筛选到的枯草芽孢杆菌LT3-1亦无溶血现象,对检测的9种抗生素均敏感,在107cfu/mL菌液注射密度下对罗非鱼安全。因此,该菌株可以应用在水产养殖中。
4 结 论
综上所述,筛选自吉富罗非鱼肠道的枯草芽孢杆菌LT3-1对无乳链球菌的抑菌圈直径达(25.30±0.57) mm,攻毒后,饲喂含枯草芽孢杆菌LT3-1饲料的罗非鱼存活率显著高于对照组(P<0.05)。该菌发酵16 h抑菌活性最强,其抑菌物质可以耐受较高温度。枯草芽孢杆菌LT3-1具有分泌蛋白酶、淀粉酶、纤维素酶的能力,可以在提高饵料利用率、维护肠道消化健康方面发挥作用;该菌具有快速降低水体亚硝酸盐水平的能力;该菌分离自健康罗非鱼肠道,无溶血,对罗非鱼安全可靠,可以作为当地罗非鱼无乳链球菌防控及净化水质方面的良好材料。
