5种类型鲤鱼线粒体DNA D-loop及邻近区段的遗传多样性分析
2019-07-23张兴华金万昆高永平杨建新
白 云,王 妍,胡 莹,张兴华,金万昆,高永平,杨建新,董 仕
( 1.天津师范大学 生命科学学院,天津市动植物抗性重点实验室,天津 300387;2.国家级天津市换新水产良种场,天津 301500 )
鲤鱼(Cyprinuscarpio)是我国重要的淡水经济鱼类。我国的鲤鱼可分为4个亚种:西鲤(C.carpiocarpio),分布于我国的新疆以及欧洲;鲤(C.carpiohaematopterus),分布于北到黑龙江,南到长江、闽江以及台湾;华南鲤(C.carpiorubrofuscus),也叫海鲤、元江鲤、团鲤,分布于西江、云南元江以及海南岛;杞麓鲤(C.carpiochilia),分布于云南湖泊中[1]。自20世纪70年代开始,我国开展了多方面的鲤鱼遗传育种研究工作,培育出很多新品种用于养殖生产或作为杂交用亲本,产生了巨大的经济效益。如兴国红鲤(C.carpiosinguonensis)、荷包红鲤(C.carpiowuyuanensis)、丰鲤(C.carpiosinguonensis♀×C.carpiovar.mirrorsplittered♂)、建鲤(C.carpiovar.jian)、德国镜鲤(C.carpioL mirror)、散鳞镜鲤(C.carpio)、乌克兰鳞鲤(C.carpio)、津新鲤(C.carpiojinxin)等[2]。
线粒体DNA是核外遗传物质,为共价闭合的环状超螺旋结构,具有分子量小、遵循母性遗传、进化速度快等特点,成为研究群体间亲缘关系的重要遗传标记,线粒体DNA的D-loop区段也称控制区,具有高突变、进化快等特点,是近年来线粒体DNA的研究热点[3-7]。郑文娟等[8]对舟山小黄鱼(Pseudosciaenapolyactis)进行了线粒体DNA D-loop区段序列变异的遗传多样性分析,袁振兴等[9]对都柳江鲤鱼、鲫鱼(Carassiusauratus)和草鱼(Ctenopharyngodonidellus)线粒体DNA的控制区进行了遗传多样性分析,董新培等[10]对不同地理群体乌鳢(Channaargus)进行了线粒体DNA控制区结构及遗传多样性分析。
乌克兰鳞鲤于1998年由天津市水产技术推广站通过农业部引种中心引进,2002年天津市技术推广站将亲本转至天津市换新水产良种场,2005年通过全国水产原种和良种审定委员会审定[11]。德国镜鲤原产于德国巴伐利亚,由农业部于1984年自德国引进[12-14]。框鳞镜鲤(C.carpiovar.specularis)简称框鲤,由德国镜鲤经选育而来[15-16]。红镜鲤(C.carpioL mirror)是国家级天津市换新水产良种场在德国镜鲤中发现的红色个体。州河鲤(C.carpioheamatopterus)是天津市蓟州区于桥水库中的一种地方野鲤[17-19]。本研究以乌克兰鳞鲤、德国镜鲤、框鳞镜鲤、红镜鲤和州河鲤为材料,进行了线粒体DNA D-loop区段的遗传多样性检测分析,以期为鲤鱼的遗传育种提供资料。
1 材料与方法
1.1 材料
5种类型鲤鱼的采样时间、地点、样本含量以及体长、体质量见表1,其中德国镜鲤和红镜鲤剪取鳍条作为研究材料。
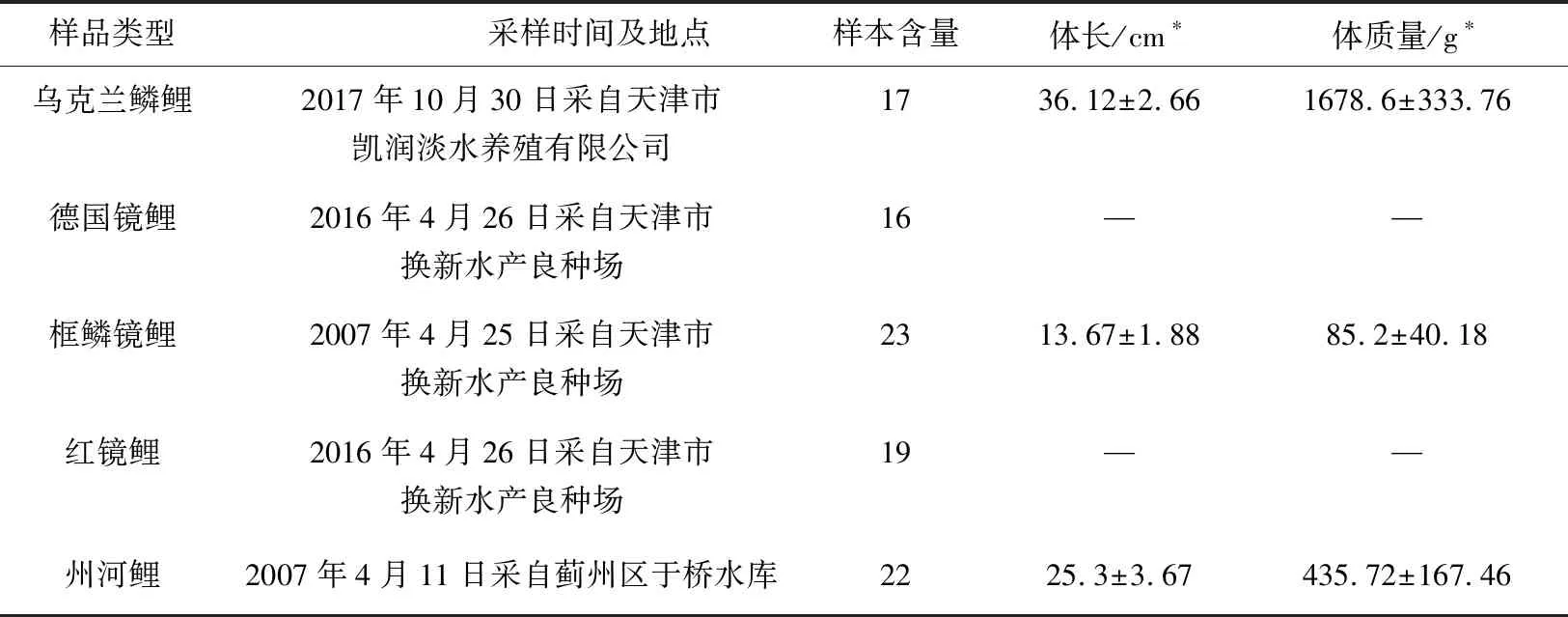
表1 5种类型鲤鱼的采样时间、地点、样本含量及体长、体质量
注:*,德国镜鲤及红镜鲤采集了鳍条.
1.2 总DNA的提取
剪取约1.0 cm×0.5 cm的鳍条,采用苯酚—氯仿抽提法提取总DNA,4 ℃保存备用[20]。
1.3 线粒体DNA D-loop及其邻近区段的扩增
使用位于线粒体DNA D-loop区段两侧的引物进行PCR扩增,引物序列为,L15923: 5′-TTA AAG CAT CGG TCT TGT AA-3′[21],H1067: 5′-ATA GTG GGG TAT CTA ATC CCA GTT-3′[22],结合位点分别位于tRNAPro和12S rRNA两个编码区上,PCR反应体系参照文献[23]的方法。获得的PCR产物经电泳检测后,委托华大基因公司进行测序,得到测序结果后,再将序列与峰图进行比对。
1.4 数据处理
使用Bioxm软件将序列转为Fast格式,经Seqverter进行整合,用ClustalX 1.83将序列进行分析,与峰图比对后获得排列清晰的序列,再用Mega 6.0软件得出碱基差异、碱基频率,基于Kimura′s 2-Parameter计算组内和组间遗传距离,并构建邻接系统树。
2 结 果
2.1 线粒体DNA D-loop及其邻近区段的PCR扩增
5种类型鲤鱼线粒体DNA D-loop及邻近区段PCR扩增均获得了约1.6 kb的DNA片段。部分
1.3.6 PPCI术后3月,患者复查超声心动图,了解心功能情况,记录左室射血分数(left ventricle ejection fration,LVEF);观察LVEF>50%的发生率。
个体的PCR产物电泳结果见图1。
2.2 PCR产物序列分析
PCR扩增产物测序后,与峰图比对,获得碱基排列顺序清晰的DNA片段长度为1342~1344 bp,经与GenBank中的KU050703比对,序列中包括tRNAPro区段13 bp,D-loop区段928、930 bp或931 bp,tRNAPhe区段69 bp以及12S rRNA区段329、331 bp或332 bp。97尾个体中共有8种单倍型,其中6种单倍型的序列提交GenBank,获得序列号为MG786481~MG786483,MG786485~MG786487,另外两种与郝君等[5]得到的序列一致,序列号为KC292935、KC292936。
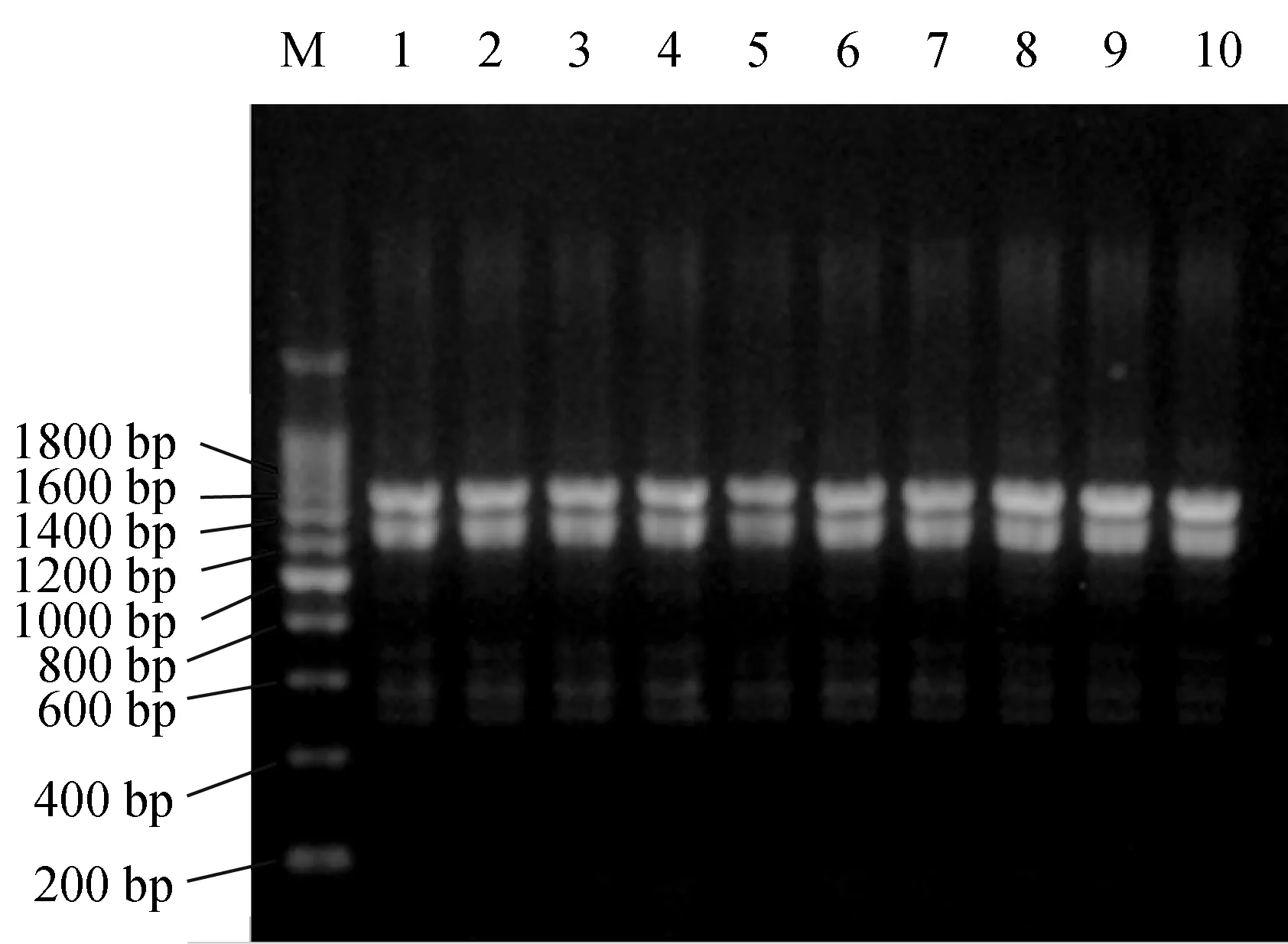
图1 5种类型鲤鱼部分个体的线粒体DNA D-loop及其邻近区段的PCR扩增结果1、2:乌克兰鳞鲤;3、4:德国镜鲤;5、6:框鳞镜鲤;7、8:红镜鲤;9、10:州河鲤.
2.3 5种类型鲤鱼的碱基差异和碱基组成
2.3.1 碱基差异
5种类型鲤鱼8种单倍型间共有28个位点存在碱基差异(表2)。每种单倍型中包含不同类型鲤鱼的个体数(表3)。每种类型鲤鱼在单倍型中有一定倾向性,可以将8种单倍型分为2组。单倍型Ⅰ~Ⅳ为第1组,包含乌克兰鳞鲤、德国镜鲤、红镜鲤的全部个体以及框鳞镜鲤中近70%的个体,其中单倍型Ⅰ和Ⅱ包含了乌克兰鳞鲤的94.1%、德国镜鲤的93.75%、框鳞镜鲤的69.57%、红镜鲤的68.42%,占这4种类型鲤鱼的80%。单倍型Ⅵ~Ⅷ为第2组,包含州河鲤的90.91%。

表2 鲤鱼8种单倍型的碱基差异
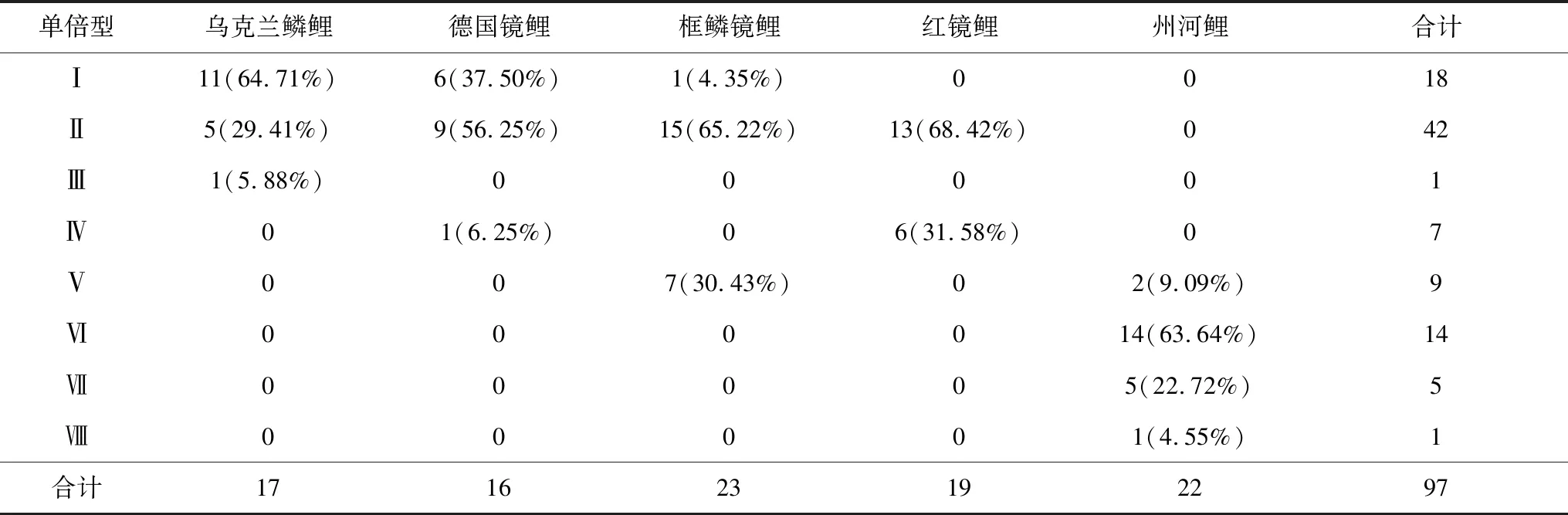
表3 5种类型鲤鱼在不同单倍型中的分布
2.3.2 碱基组成
使用Mega 6.0软件分别得出5种类型鲤鱼的线粒体DNA D-loop区段、线粒体DNA D-loop及邻近区段的碱基频率(表4)。A+T的含量明显高于G+C的含量,这与鱼类线粒体DNA的蛋白质编码基因的特点[24-25]一致。
2.4 5种类型鲤鱼的遗传距离和系统发育树
2.4.1 单倍型间的遗传距离和系统发育树
2.4.1.1 D-loop及邻近区段的遗传距离和系统发育树
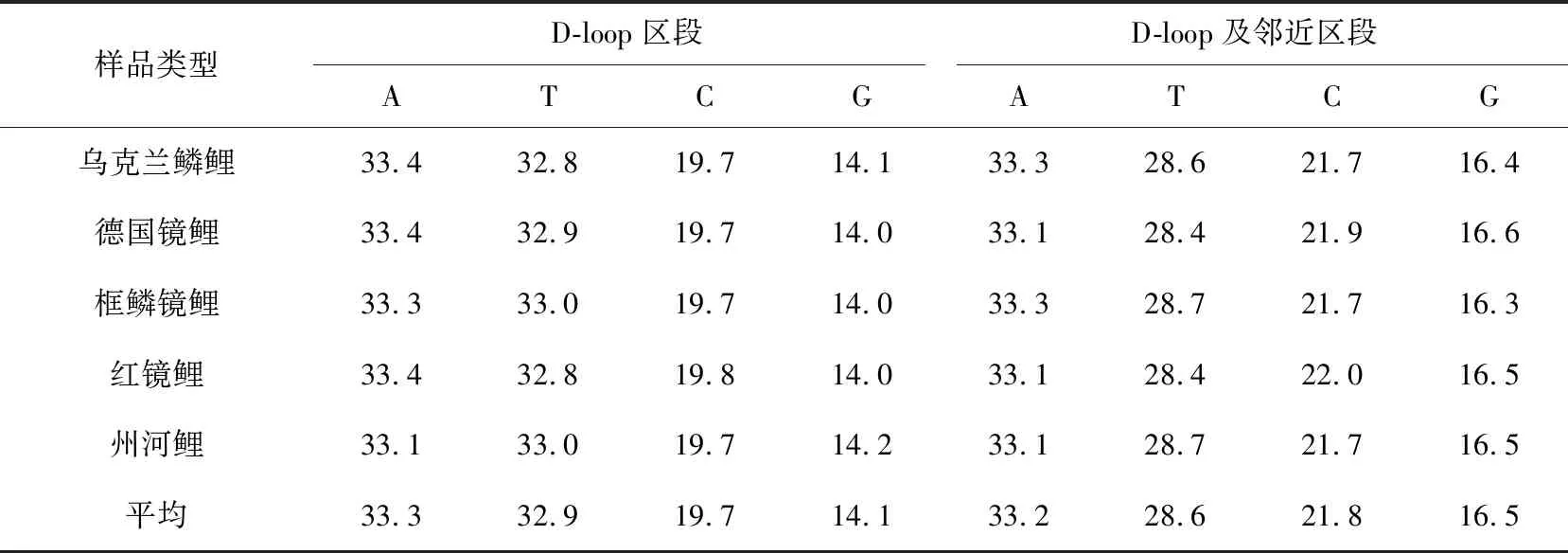
表4 5种类型鲤鱼D-loop及邻近区段的碱基频率 %

表5 鲤鱼8种单倍型的D-loop及邻近区段间的遗传距离
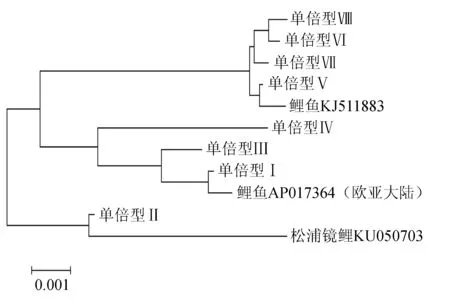
图2 8种单倍型D-loop及邻近区段的邻接系统树
2.4.1.2 D-loop区段的遗传距离和系统发育树
将8种单倍型与以上3个GenBank序列以及鲤鱼AY345336、AB307063比对,经ClustalX软件比对后获得926~929 bp的D-loop区段,单倍型间遗传距离见表6,构建的系统树见图3。由表6可见,鲤鱼AP017364与单倍型Ⅰ遗传距离为0,松浦镜鲤KU050703、鲤鱼AY345336与单倍型Ⅱ的遗传距离为0,鲤鱼KJ511883、鲤鱼AB307063与单倍型Ⅴ的遗传距离为0,5种类型鲤鱼8种单倍型间的遗传距离与表5中数据相比均有不同程度的增大。由图3可见,第1组与鲤鱼AP017364、AY345336(具有俄罗斯血统的镜鲤[28-29])、松浦镜鲤KU050703聚在一起;第2组与鲤鱼KJ511883、 AB307063聚在一起,两组差异明显。
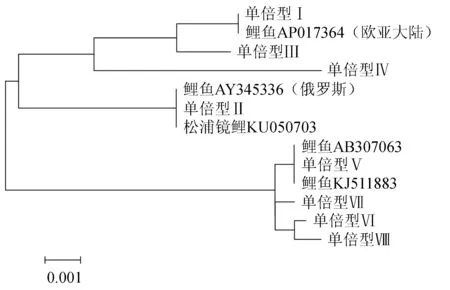
图3 8种单倍型D-loop区段的邻接系统树
2.4.2 不同类型鲤鱼间的遗传距离及系统树
2.4.2.1 D-loop及邻近区段的遗传距离和系统发育树
用Mega 6.0软件得出D-loop及邻近区段间的组间及组内遗传距离(表7)并构建系统树(图4),由表7可见,德国镜鲤和框鳞镜鲤的组内遗传距离分别为0.00462和0.00451,遗传多样性最高,乌克兰鳞鲤和红镜鲤的遗传多样性稍低于德国镜鲤和框鳞镜鲤,州河鲤组内遗传距离为0.00065,遗传多样性最低。德国镜鲤、框鳞镜鲤与红镜鲤距离较小,为0.00458~0.00544;乌克兰鳞鲤与框鳞镜鲤、红镜鲤距离稍大,为0.00624~0.00684。州河鲤与乌克兰鳞鲤、德国镜鲤、红镜鲤的遗传距离均约为0.01,与框鳞镜鲤的遗传距离稍低,为0.00676;由图4可见,乌克兰鳞鲤与鲤鱼AP017364,红镜鲤与松浦镜鲤,州河鲤与鲤鱼KJ511883聚在一起。
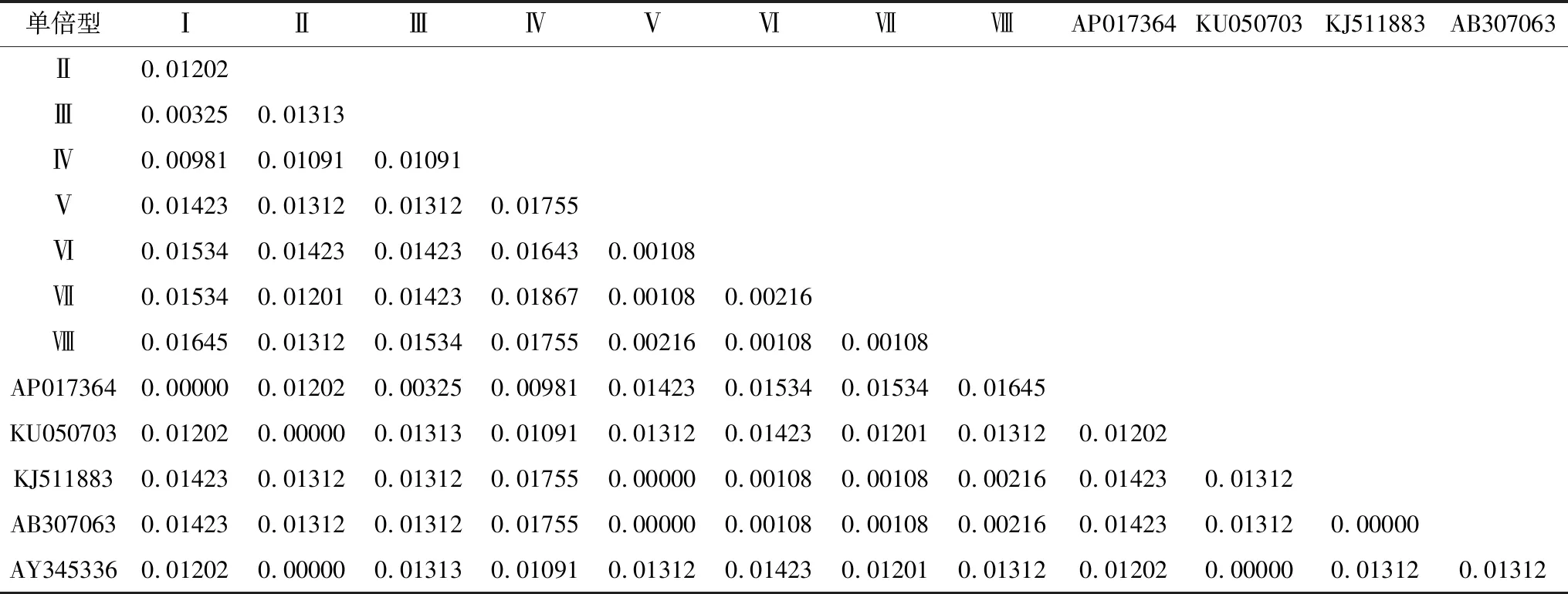
表6 鲤鱼8种单倍型的D-loop区段间的遗传距离
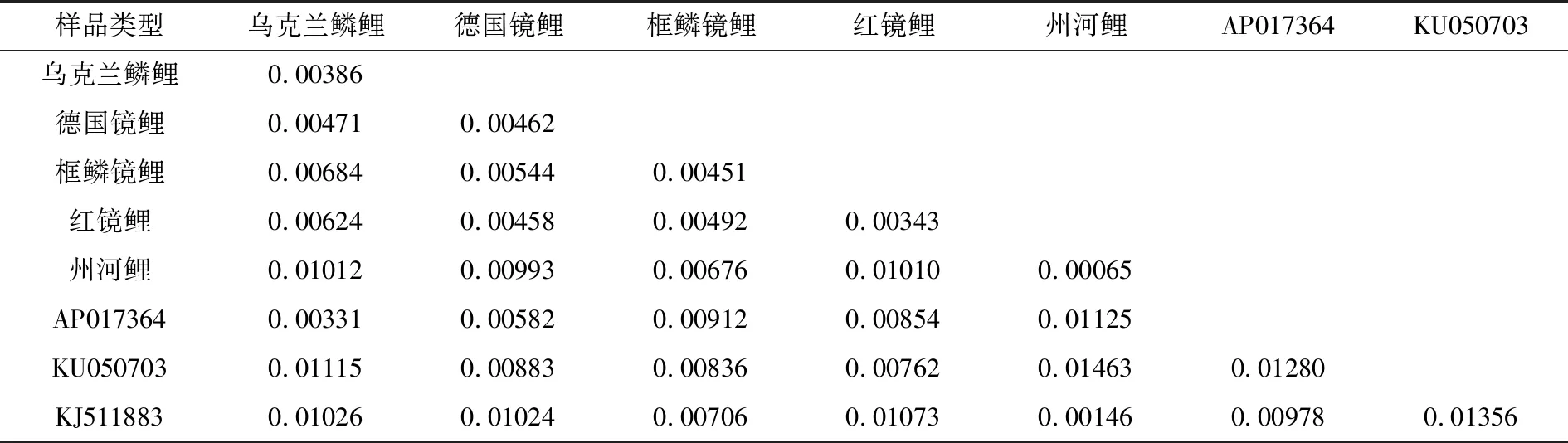
表7 5种类型鲤鱼的D-loop及邻近区段间的遗传距离
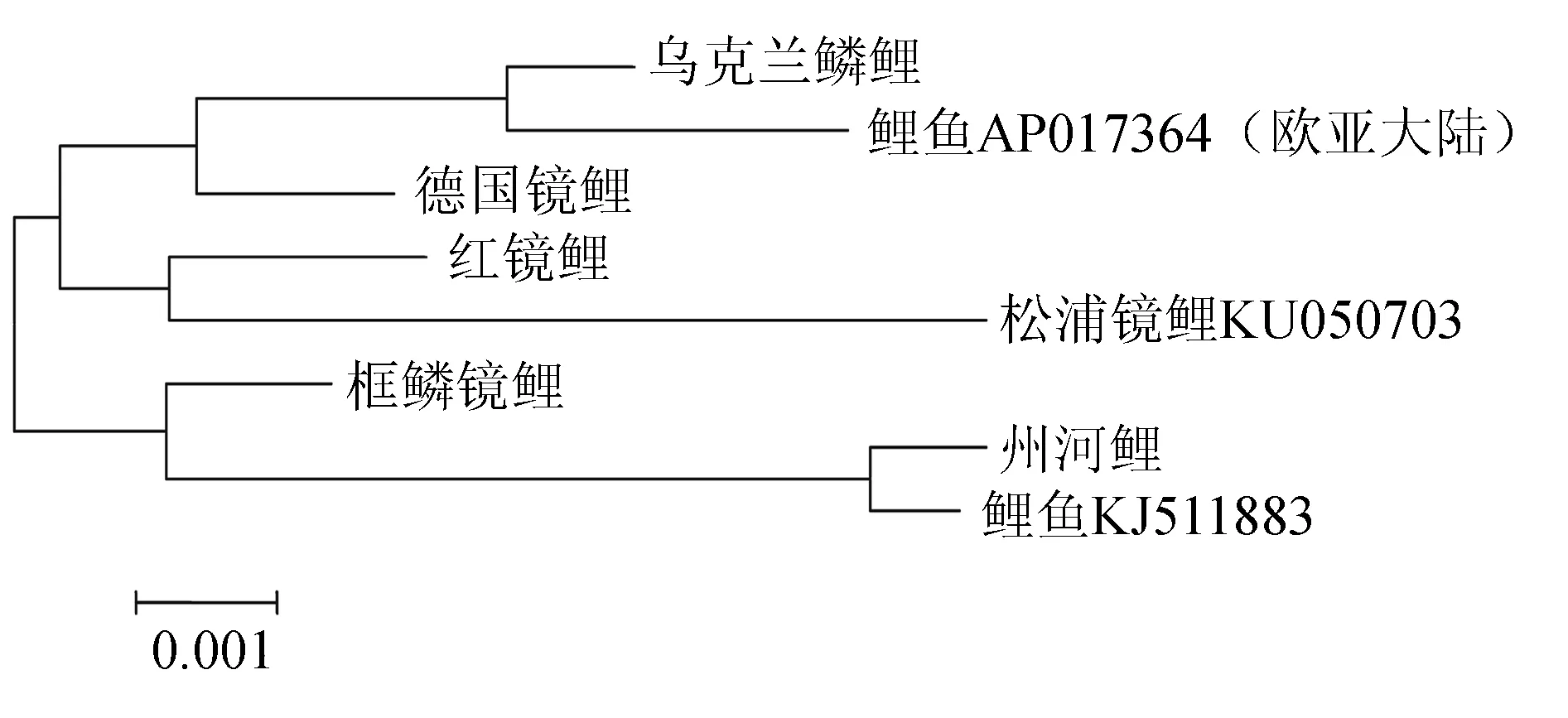
图4 5种类型鲤鱼D-loop及临近区段的邻接系统树
2.4.2.2 D-loop区段的遗传距离和系统发育树
D-loop区段的遗传距离见表8,构建的系统树见图5。由图5可见,鲤鱼AP017364与乌克兰鳞鲤、德国镜鲤聚在一起,松浦镜鲤KU050703、鲤鱼AY345336与红镜鲤聚在一起。州河鲤与其他4种类型鲤鱼的遗传距离均约为0.01(表8),鲤鱼KJ511883、AB307063与州河鲤聚在一起。
2.5 5种类型鲤鱼的遗传多样性指数
用DnaSp_v5软件计算出5种类型鲤鱼的单倍型多样性指数、核苷酸多样性指数及平均核苷酸差异性,结果见表9。由表9可见,5种类型鲤鱼的单倍型多样性指数差异较小;德国镜鲤和框鳞镜鲤的核苷酸多样性指数和平均核苷酸差异性稍大于乌克兰鳞鲤和红镜鲤,州河鲤明显小于其他4种类型鲤鱼。
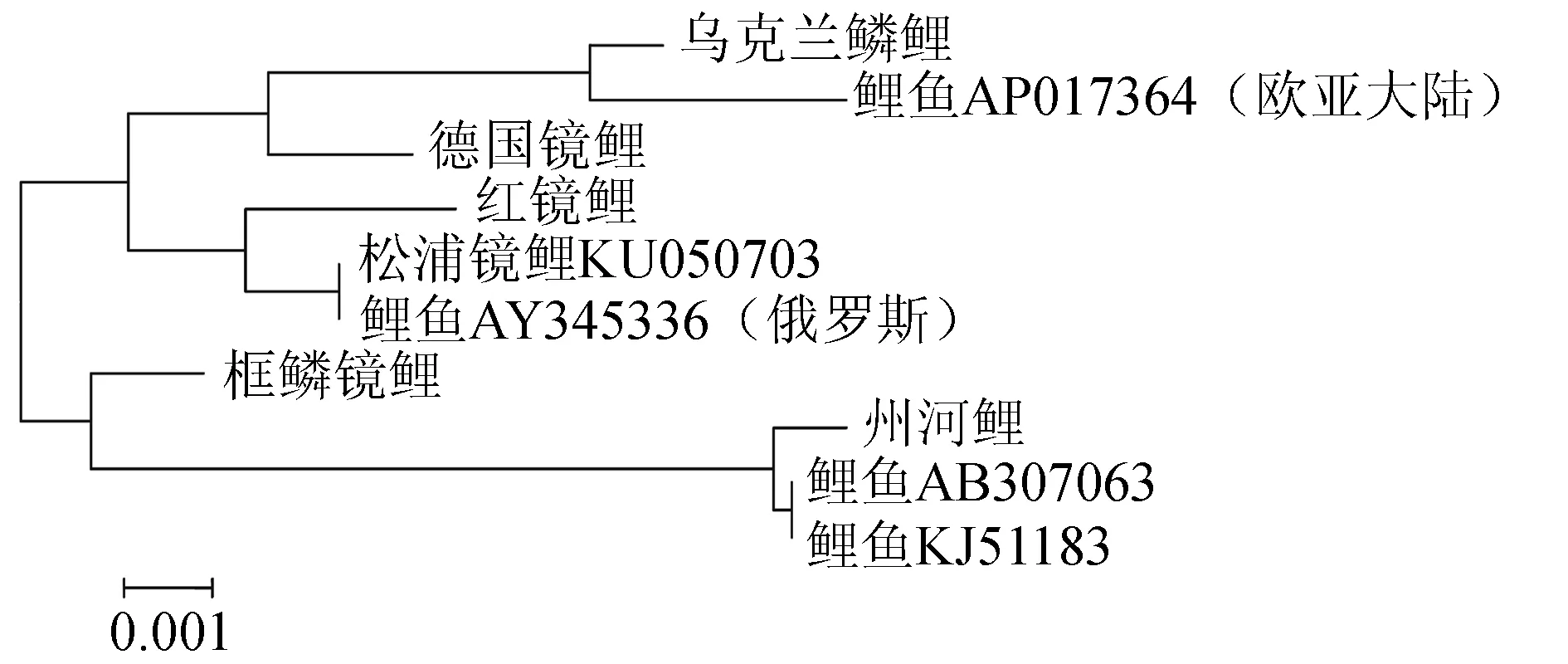
图5 5种类型鲤鱼D-loop区段的邻接系统树
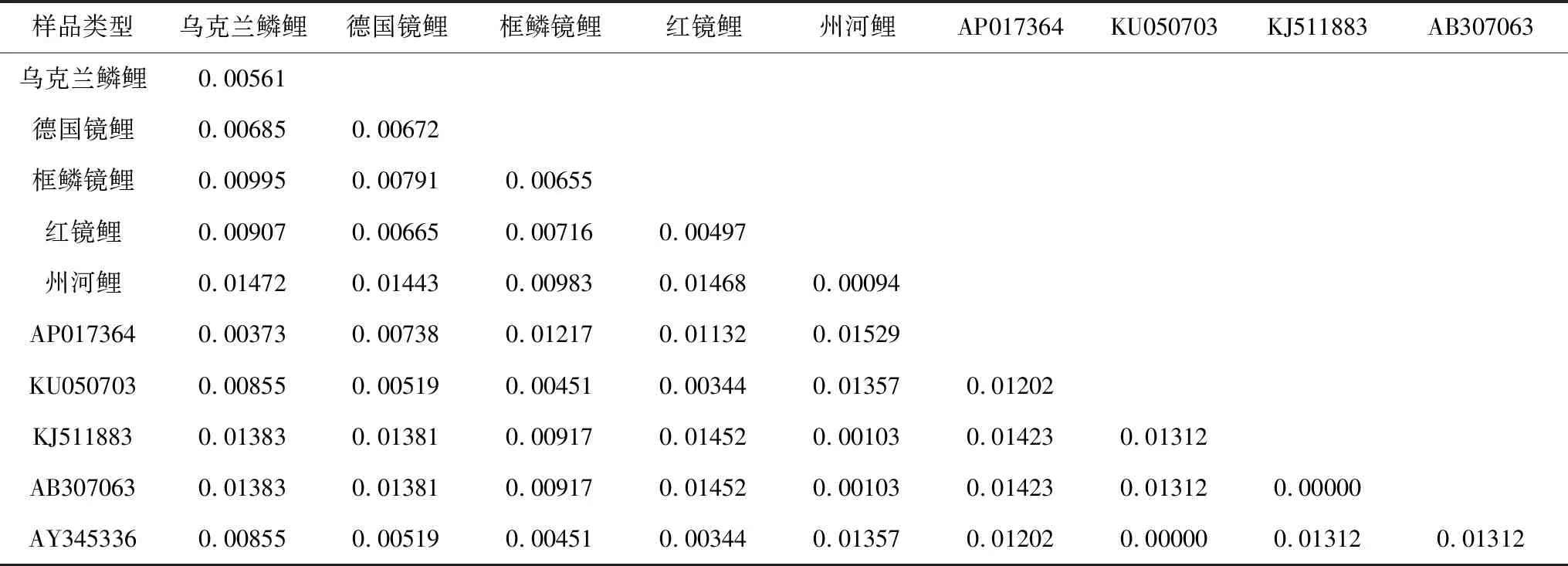
表8 5种类型鲤鱼的D-loop区段间的遗传距离
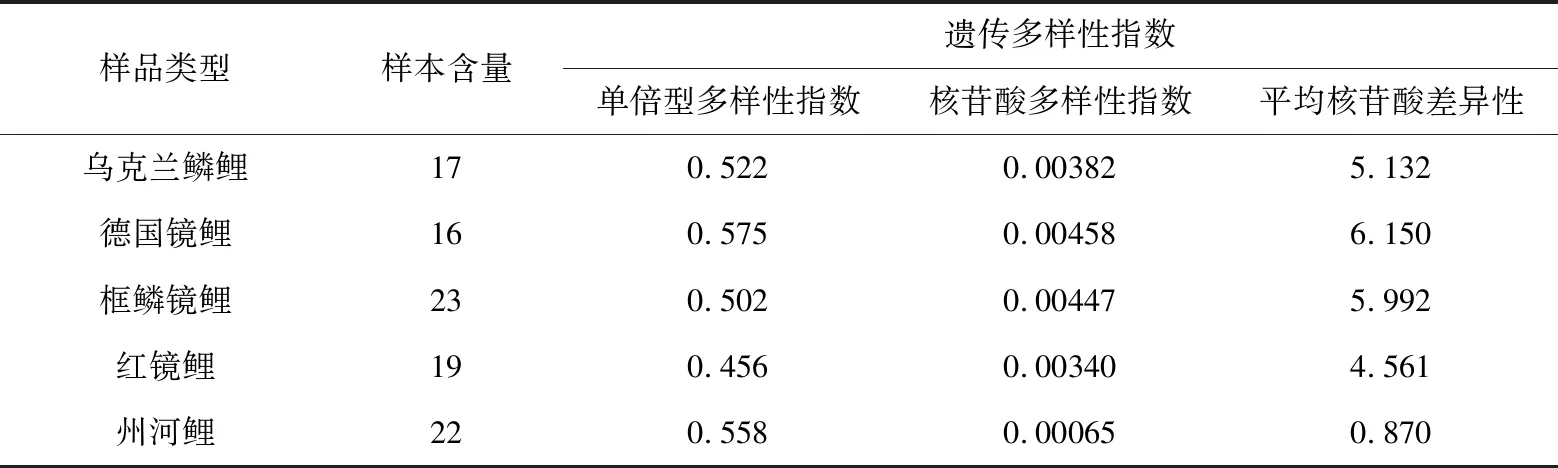
表9 5种类型鲤鱼的遗传多样性指数
3 讨 论
3.1 5种类型鲤鱼中单倍型可分为欧洲血统和亚洲血统
经对乌克兰鳞鲤、德国镜鲤、框鳞镜鲤、红镜鲤和州河鲤共5种类型鲤鱼的线粒体DNA D-loop及邻近区段和仅D-loop区段的序列分析,共检测出8种单倍型。单倍型Ⅰ~Ⅳ包含了乌克兰鳞鲤、德国镜鲤、框鳞镜鲤和红镜鲤中90.7%的个体,GenBank上的鲤鱼AP017364与单倍型ⅠD-loop区段,具有俄罗斯血统的镜鲤AY345336、松浦镜鲤KU050703与单倍型ⅡD-loop区段的碱基序列相同,遗传距离为0。单倍型Ⅰ和单倍型Ⅱ分别占到乌克兰鳞鲤、德国镜鲤、框鳞镜鲤和红镜鲤4种类型鲤鱼的24.0%和56.0%,两者达到4种类型鲤鱼的80%。单倍型Ⅲ、Ⅳ与单倍型Ⅰ、Ⅱ遗传关系较近。
单倍型Ⅴ~Ⅷ包含了州河鲤的全部个体、框鳞镜鲤的7个个体。州河鲤为天津市蓟州区于桥水库中的1种地方野鲤[17-19],并且单倍型Ⅴ~Ⅷ的组内平均遗传距离仅为0.00099。
因此,笔者认为单倍型Ⅰ~Ⅳ欧洲血统,单倍型Ⅴ~Ⅷ为亚洲血统。至于单倍型Ⅴ中含有框鳞镜鲤的原因有待进一步探讨。
3.2 单倍型间的遗传差异
欧洲血统的Ⅰ~Ⅳ单倍型间碱基差异位点数较多,为21个,其中4个缺失或插入,1个转换,16个颠换,单倍型间遗传距离为0.00224~0.00902,单倍型间遗传差异较大。亚洲血统的Ⅴ~Ⅷ单倍型间碱基差异位点数较少,为5个,其中3个缺失或插入,2个颠换,单倍型间遗传距离为0.00075~0.00149,单倍型间遗传差异较小。
欧洲血统的单倍型Ⅱ比较特殊,其与其他7种单倍型间的遗传距离比较相近。单倍型Ⅱ中含有乌克兰鳞鲤、德国镜鲤、框鳞镜鲤和红镜鲤中56.0%的个体,与具有俄罗斯血统的镜鲤AY345336[24-25]、松浦镜鲤KU050703的遗传距离为0,不含有州河鲤。据此,笔者认为单倍型Ⅱ属于欧洲血统。
3.3 5种类型鲤鱼遗传多样性
乌克兰鳞鲤、德国镜鲤、框鳞镜鲤、红镜鲤和州河鲤共5种类型鲤鱼中,德国镜鲤的组内遗传距离、遗传多样性指数最大,遗传多样性最高,与胡雪松等[13]对德国镜鲤的3个群体进行微卫星分析,得出德国镜鲤选育群体仍保持着较高遗传多样性的结论一致。红镜鲤与乌克兰鳞鲤、德国镜鲤和框鳞镜鲤相比,组内遗传距离、遗传多样性指数最小,遗传多样性最低。
州河鲤组内遗传距离、核苷酸多样性指数和平均核苷酸差异性明显小于其他4种类型鲤鱼,遗传多样性较低。州河鲤属于天津地方野鲤,为天津市蓟州区于桥水库所特有,其形态及品质和其他鲤鱼有很多不同之处[13,30]。可能由于长期生殖隔离,使得州河鲤在小群体的基础上繁殖,其遗传多样性相对较低。这与杨正玲等[30]应用线粒体DNA D-loop的RFLP方法分析得出的结论相同。
作为育种材料,不同类型鲤鱼在我国鱼类遗传育种研究以及生产应用中占有举足轻重的地位,至今已培育出很多鲤鱼或鲤鲫杂交新品种[2]。所以保护不同类型鲤鱼的种质资源、促进鲤鱼养殖业健康发展显得非常重要。
