腹股沟区肿瘤性骨软化症12例临床特征及手术治疗效果
2019-07-22周熹夏维波刘勇
周熹夏维波刘勇*
(中国医学科学院北京协和医学院北京协和医院1.骨科;2.内分泌科,北京100730)
肿瘤性骨软化症(tumor-induced osteomalacia,TIO)是一种临床上较为罕见的获得性代谢性骨病,主要由于磷酸盐尿性间叶组织肿瘤(phosphaturic mesenchymal tumor,PMT)分泌的成纤维生长因子-23(fibroblast growth factor-23,FGF-23)导致肾磷排出显著增加,进而引起血磷降低、骨矿化不全等[1-3]。临床常表现为持续低磷血症引起的乏力、疼痛,严重者可出现骨折、骨骼发育畸形、活动受限等,严重影响患者的生活质量[1-6]。实验室检查特点为低血磷、高尿磷、高碱性磷酸酶,血1,25(OH)2D3水平相对较低,血钙水平可正常,部分患者甲状旁腺激素(parathyroid hormone,PTH)水平升高。影像学表现为骨骼软化、骨密度降低,结合体格检查或影像学检查可发现占位性病变[4-6]。
TIO首次报道于1947年,迄今国内外报道病例尚不足500例,临床极为罕见,故临床医师对该疾病认识不足,加之TIO常起病缓慢,致病瘤体体积常很小,且部位隐匿,临床表现缺乏特异性,定位诊断十分困难,故极易造成漏诊或误诊[5,6]。本研究回顾性分析手术治疗的12例腹股沟区TIO患者的临床资料,以提高临床医师对本病的认识。
1 资料与方法
1.1 一般资料
纳入标准:①临床表现:骨痛呈进行性加重,多开始于负重关节部位;②实验室检查:低磷血症,尿磷水平相对增高,血钙水平正常或轻度降低,血清碱性磷酸酶(alkaline phosphatase,ALP)水平升高,血1,25(OH)2D3水平正常或下降,部分患者伴有继发性甲状旁腺功能亢进,患者常需要大剂量补充中性磷溶液和活性维生素D才能改善骨痛症状和维持血磷水平,切除肿瘤后骨痛症状和血磷水平常迅速得到改善;③影像学检查:通过MRI可以发现致病肿瘤所在位置,通常瘤体体积较小且部位隐匿;④病理学检查:证实为磷酸盐尿性间叶组织肿瘤。排除标准:①病理学未明确证实为磷酸盐尿性间叶组织肿瘤;②其他因素导致的骨软化症。
2015年1月至2019年1月共完成12例腹股沟区TIO患者的手术治疗,其中男8例,女4例;年龄26~65岁,平均46.5岁。12例患者的病程为1~9年,从首发症状到明确诊断所用时间为1~8年。12例患者均有不同部位、不同程度的骨痛症状,可累及关节,多表现在下肢、腰背部等负重部位,4例伴有明显的身高缩短,12例均有明显肌无力及活动障碍,10例坐起、行走困难。12例患者均无显著发热等其他特殊表现(表1)。
1.2 辅助检查
1.2.1 实验室检查:取患者的血样及尿样检测血磷、血钙、ALP、尿磷、尿钙、PTH、血1,25(OH)2D3及Ⅰ型胶原羧基端肽交联(β cross-linked C-telopeptide of type 1 collagen,β-CTX)水平。
1.2.2 影像学检查:12例患者均行X线、MRI、99Tcm-奥曲肽-SPECT、68Ga-DOTA-TATE PET/CT检查,必要时结合相应部位的超声和CT进行定性、定位诊断。
1.2.3 病理学诊断:取瘤体组织切片行HE染色,由病理科副教授以上医师诊断肿瘤性质及病理学特点。
1.3 治疗方法
入院后先给予非手术治疗,包括口服碳酸钙、骨化三醇、中性磷试剂等治疗,同时完善相关检查,以制定进一步的治疗方案。12例患者均接受腹股沟区手术治疗,就诊过程中进行肿瘤筛查,并经内分泌科、骨科、核医学科、放射科、病理科等多科会诊,再结合临床资料及文献报道最终确立诊断。
1.4 随访计划
术后随访血磷水平、症状变化和程度,以及利用影像学检查手段监测有无局部复发(国际上暂无公认的TIO随访及评价指标)。
2 结果
2.1 辅助检查结果
2.1.1 实验室检查:12例TIO患者的血、尿、粪便常规及肝肾功能检查均无明显异常,自身抗体系列、肿瘤指标均阴性。11例患者出现ALP水平升高,范围180~412 U/L(正常值为50~135 U/L);12例患者24 h尿磷水平相对升高(患者血磷<0.6 mmol/L时,24 h尿磷应基本为0);12例患者血钙水平基本正常或轻度降低,范围1.95~2.39 mmol/L(正常值为2.13~2.70 mmol/L);12例患者均出现不同程度的低磷血症,术前血磷范围为0.33~0.73 mmol/L(正常值为0.81~1.45 mmol/L);10例表现为血1,25(OH)2D3水平正常或下降,范围为5.82~50.40 ng/ml(正常值为19.60~54.30 ng/ml),详见表2。
2.1.2 影像学检查:12例患者均行X线、MRI、99Tcm-奥曲肽-SPECT、68Ga-DOTA-TATE PET/CT检查,必要时结合相应部位的超声和CT进行定性、定位诊断(表3)。X线结果均提示骨质密度欠规则、骨质破坏、异常。结合相应部位的超声、CT、MRI进行定性、定位分析。99Tcm-奥曲肽-SPECT诊断准确率为75%(8/12),68Ga-DOTA-TATE PET/CT诊断准确率为100%(12/12)。
2.1.3 病理学诊断:取瘤体组织切片,行HE染色,由病理科副教授以上医师诊断肿瘤性质及病理学特点,12例患者均为PMT。
2.2 随访结果
12例患者经手术治疗后,骨痛及乏力症状均有所改善,术后3 d以后血磷水平均显著升高,随访2个月至4年,血磷水平均处于正常范围(表4)。到目前为止,行手术治疗的12例TIO患者定期于骨科、内分泌科门诊随诊,病情相对平稳。

表1 12例TIO患者的一般资料和临床表现
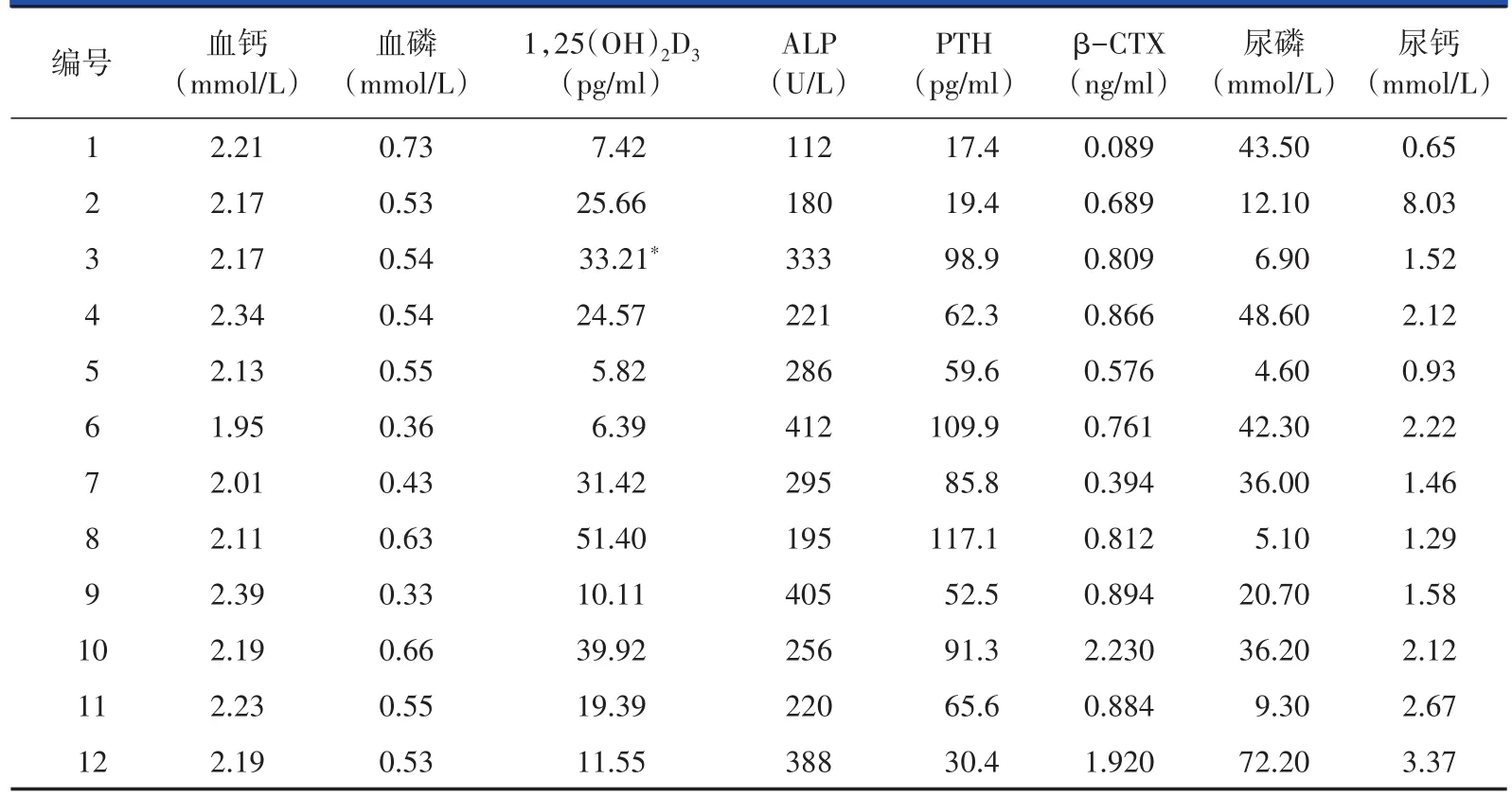
表2 12例腹股沟区TIO患者的实验室检查结果

表3 12例TIO患者的肿瘤部位及大小
3 讨论
TIO是由于肿瘤分泌调磷因子引起肾小管磷重吸收减少、肾排磷增加、血1,25(OH)2D3水平降低的获得性低血磷性骨软化症[1-3,7-9]。TIO的致病肿瘤多来源于间叶组织的良性肿瘤,常位于骨或软组织内,少数其他组织来源的癌或类癌也可出现低血磷及骨软化症的临床表现[1-3,10]。该类肿瘤生长缓慢,位置隐匿,体积较小,常规体格检查不易被发现。文献报道TIO瘤体位置多位于下肢(53.9%)、头部(29.2%)、上肢(6.7%)、胸腹部(5.6%)、骨盆(4.5%)[1-3,11-13]。临床诊断考虑TIO后,尚需借助影像学手段寻找肿瘤原发部位,CT、MRI、99Tcm-奥曲肽-SPECT、68Ga-DOTATATE PET/CT检查可发现并定位大部分TIO致病肿瘤[14,15]。组织学上,PMT的主要特征是肿瘤细胞呈梭形或星状,细胞核小,核仁不清,有丝分裂活性低[16]。细胞嵌在黏液样或黏液软骨样基质中,伴有类似软骨样或骨样钙化灶,肿瘤组织中可见丰富的血管[16-18]。本研究中12例患者的病理学检查均证实为PMT,故TIO诊断明确。
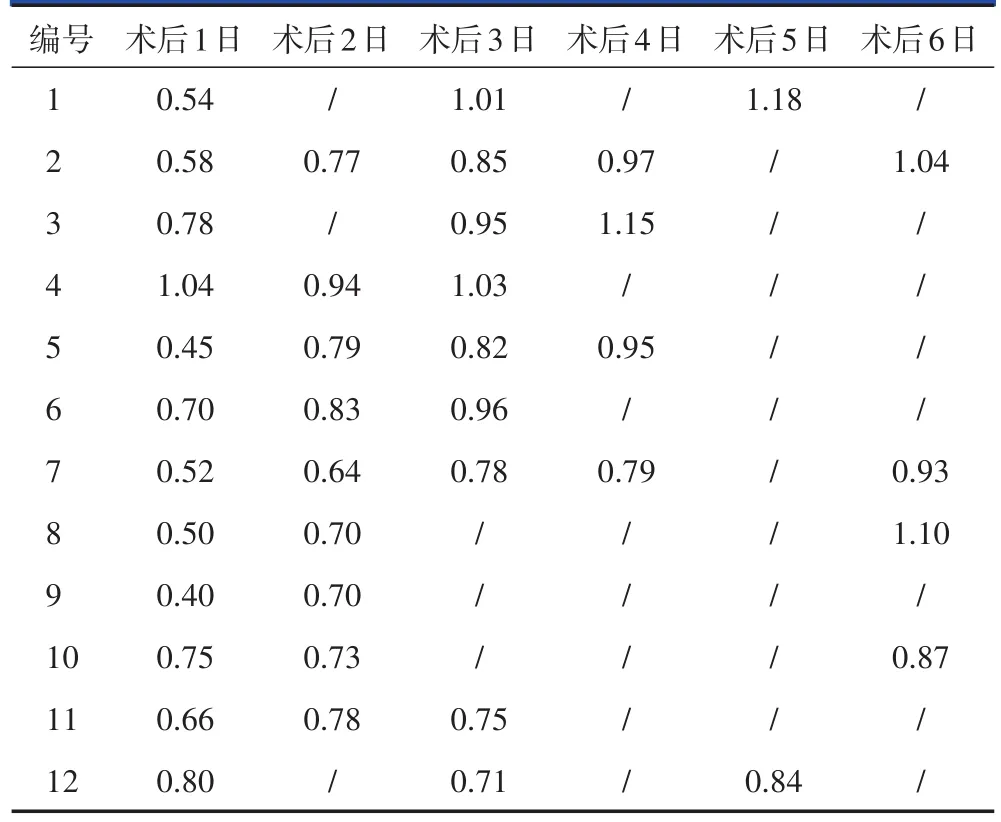
表4 12例TIO患者术后血磷水平变化情况(mmol/L)
定性诊断方面,当患者出现因肾磷丢失过多导致的低血磷性骨软化症表现时须考虑TIO,FGF-23、细胞外基质磷酸糖蛋白(matrix extracelluar phosphoglycoprotein,MEPE)、人分泌型卷曲相关蛋白 4(secreted frizzled related protein 4,SFRP4)、X染色体内肽酶同源性调磷基因(phosphate regulating genewith homologies to endopeptidases on the X chro-mosome,PHEX)等基因突变的检测对TIO的明确诊断有一定参考价值[19-21]。迄今,病理学诊断仍为TIO诊断的“金标准”[19-21]。
定位诊断方面,部分患者利用X线片、CT、MRI均可发现病变瘤体,但多数瘤体部位隐匿,且体积较小,故尚需结合99Tcm-奥曲肽-SPECT、68Ga-DOTATATE PET/CT检查进行充分定位[14,15]。TIO责任肿瘤多来自于间叶组织,而间叶组织来源的肿瘤通常有生长抑素受体(somatostatinreceptor,SSTR)表达,因此可以使用生长抑素受体显像来寻找TIO的致病肿瘤。对于腹股沟区肿瘤性骨软化症患者,致病瘤体体积常较小,临床诊断过程中均施行99Tcm-奥曲肽-SPECT、68Ga-DOTA-TATE PET/CT检查,以利于明确诊 断 与 术 中 精 准切 除[14,15,22,23]。 文 献报 道99Tcm- 奥 曲肽-SPECT全身扫描准确率达93.4%,而PET/CT亦为一种定位TIO责任肿瘤的敏感方法[22-24]。近年来的研究显示68Ga-DOTA-TATE PET/CT已经成为一种理想的TIO致病瘤体定位方法,相比于PET/CT更有优越性,甚至能检测出 SPECT、CT 未能发现的肿瘤[25,26]。因此,TIO的明确诊断需将患者的临床表现、实验室检查与多种定位手段充分结合。
治疗方面,首先应确定疾病累及部位及毗邻结构。对于腹股沟区TIO患者,由于该部位解剖结构复杂且部分患者存在局部解剖变异,手术治疗时需尤为注意对腹股沟区域神经(髂腹股沟神经、生殖股神经等)、血管(股动脉、股静脉等)、肌肉、筋膜、韧带、精索等重要解剖结构的辨认,避免发生副损伤,本研究中12例腹沟股区TIO患者的手术治疗均未发生手术相关副损伤。
综上,TIO是一种罕见的骨代谢疾病,该病的发生发展会严重影响患者的生活质量,甚至造成死亡。临床医师应提高对该病的认识,结合临床表现、影像学检查、病理诊断等手段提高诊断的准确性并采取合理的治疗方案改善其预后。关于TIO的病因、发病机制、诊疗及预后尚需进一步深入探究,以期为更多的患者带来福音。
