传统淡水鱼发酵制品中乳酸菌的分离筛选及发酵特性
2019-07-19林城杏黄瑶周迎春张鹏程罗鑫曾雪峰范劲
林城杏 黄瑶 周迎春 张鹏程 罗鑫 曾雪峰 范劲


摘 要:为解决我国传统淡水鱼易腐败、鱼腥味重、利用率低及附加值低等问题,对我国传统淡水鱼发酵制品中的乳酸菌进行分离鉴定及特性研究。结果表明:通过生理生化、耐盐性、抑菌性、适宜生长温度、生长曲线及pH值变化等实验筛选出的7 株乳酸菌均适宜作为淡水鱼发酵制品的发酵剂;通过16S rRNA序列分析法,确定其中2 株为戊糖片球菌,余下5 株为植物乳杆菌。
关键词:淡水鱼;乳酸菌;分离;发酵特性
Abstract: In order to solve the problems of traditional freshwater fish in China, such as easy spoilage, heavy fishy smell, low utilization rate and low added value, this study isolated lactic acid bacteria from different types of fermented freshwater fish in China and determined the technological properties of the isolated strains. A total of 7 isolates were obtained, and they were all found to be suitable for use as a starter culture of fermented freshwater fish according to their physiological and biochemical properties, salt tolerance, antibacterial activity, optimal growth temperature, growth curves and pH changes during their growth. Two of these were identified as Pediococcus pentosaceus, while the rest were all identified as Lactobacillus plantarum by 16S rRNA sequence analysis.
Keywords: freshwater fish; lactic acid bacteria; isolation; fermentation characteristics
DOI:10.7506/rlyj1001-8123-20190307-049
中圖分类号:TS254.1 文献标志码:A 文章编号:1001-8123(2019)05-0013-06
引文格式:
林城杏, 黄瑶, 周迎春, 等. 传统淡水鱼发酵制品中乳酸菌的分离筛选及发酵特性[J]. 肉类研究, 2019, 33(5): 13-18. DOI:10.7506/rlyj1001-8123-20190307-049. http://www.rlyj.net.cn
LIN Chengxing, HUANG Yao, ZHOU Yingchun, et al. Isolation and fermentation characteristics of lactic acid bacteria from traditional fermented freshwater fish in China[J]. Meat Research, 2019, 33(5): 13-18. DOI:10.7506/rlyj1001-8123-20190307-049. http://www.rlyj.net.cn
目前,我国淡水鱼(青鱼、草鱼、鲢鱼、鳙鱼等)的产量位居全球首位,但淡水鱼作为加工原料却存在水分含量高、土腥味重、肌间刺多及缺乏加工关键技术等问题,使得我国当前淡水鱼的加工量不足淡水鱼养殖总量的15%,与欧美日等发达国家平均淡水鱼加工量占养殖量70%的水平相距甚远[1]。
生物发酵技术以现代发酵技术为核心,利用微生物的代谢活动过程,经生物转化大规模制造各种工业发酵产品[2]。Yin Lijung等[3]将戊糖片球菌接种至鲭鱼,鱼肉pH值迅速降低,肠杆菌科、葡萄球菌和假单胞菌的生长受到抑制,白度、非蛋白氮和游离氨基酸含量增加,感官品质提升。Deatraksa等[4]利用从泰国Plaa Som Fug中分离筛选的乳酸菌(Weissella)接种发酵Plaa Som Fug,检测获得更高的叶酸含量,明显提高了其营养价值。应用生物发酵技术不仅能改善肉类品质,还能抑制腐败微生物的生长,为克服阻碍淡水鱼加工技术瓶颈提供了一条新的思路和方向[5]。我国传统淡水全鱼发酵制品在贵州、湖南、云南、广西等少数民族(苗族、侗族等)聚居的地区具有悠久的历史,产品具有色泽暗红、酸辣适口、风味浓郁等特点[6-7]。但我国少数民族传统淡水全鱼发酵制品大多仍沿用手工作坊式生产,存在生产周期长、含盐量高、质量稳定性差及工业化程度低的弊端[8-9]。然而,此类发酵制品中却栖息着具有较好发酵特性、种类繁多、数量丰富的微生物,尤其是乳酸菌[10]。因此,分离筛选该类产品发酵过程中繁衍的具有优良发酵特性的乳酸菌,并将筛选出的优良乳酸菌采用模拟自然发酵的方法接种发酵,改进传统发酵工艺,提升该类传统发酵美食品质,最终实现工业化生产,将具有一定的社会和经济意义。本研究选用湘西传统淡水全鱼发酵制品为样品,从中筛选出7 株产酸快、耐盐、耐低温、发酵特性良好的优势乳酸菌,并利用16S rRNA序列分析法对其进行鉴定[11-13]。
1 材料与方法
1.1 材料与试剂
湘西花垣酸鱼 湖南省湘西土家族苗族自治州花垣县;湘西凤凰酸鱼 按照传统方法自制。
蛋白胨、牛肉膏、酵母膏、琼脂(均为生化试剂) 上海博微生物科技有限公司、葡萄糖(生化试剂) 天津市永大化学试剂有限公司;精氨酸、半胱氨酸(均为生化试剂) 美国Sigma公司;溴甲酚紫(生化试剂)、乙酸钠、磷酸二氢钾、柠檬酸三铵、氢氧化钠、醋酸铅、CaCO3、亚硝酸钠(均为分析纯) 天津市致远化学试剂有限公司;氯化钠、MgSO4、MnSO4(均为分析纯) 成都金山化学试剂有限公司;盐酸(分析纯) 重庆川东化工(集团)有限公司;细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
XSS-2电子显微镜 奥林巴斯(中国)有限公司;SW-CJ-10超净工作台 苏州净化有限公司;SPX生化培养箱 上海科恒实业发展有限公司;HZQ-X100恒温振荡培养箱 江苏省太仓市实验设备厂;PHS-2F pH计 上海仪电科学仪器股份有限公司;WFZ UV-2100紫外-可见分光光度计 龙尼柯(上海)仪器有限公司;YQX-LS-18SI手提式压力蒸汽灭菌锅 上海博迅实业有限公司;DYCP-31CN电泳仪 北京六一生物技术有限公司;9700 PCR仪 美国应用生物系统公司。
1.3 方法
1.3.1 自制凤凰酸鱼加工工艺
市售新鲜鲤鱼→清水吐水除腥→背部连头剖开→去除内脏(去鳃)→低温加盐腌制1 周(食盐添加量6%),3 d翻缸1 次→拌入炒香的小麦粉(玉米粉、大米粉、糯米粉、大豆粉)、花椒、桂皮、八角、辣椒→拌匀→余料塞满鱼肚→装坛密封→1 个月后成品
1.3.2 乳酸菌的分离培养
无菌操作条件下分别准确称量25 g花垣酸鱼肉、花垣酸鱼酸剂、凤凰酸鱼和凤凰酸鱼酸剂样品,剪碎后无菌条件下分别加入到225 mL的无菌生理盐水中,经振荡摇匀后梯度稀释至所需浓度;移液管无菌移取0.1 mL样液,采用涂布法均匀涂布至直径为9 cm的改性MRS琼脂培养基表面,经30 ℃、48 h培养后每平板随机挑取5~7 株疑似乳酸菌菌株至MRS琼脂培养基反复划线培养,最终获得纯菌株[14-15]。
1.3.3 乳酸菌菌株的初步筛选
通过对分离纯化的每株菌株进行菌落形态观察,进行接触酶实验、革兰氏染色及葡萄糖产酸实验,初步分离筛选传统酸鱼产品中的乳酸菌[16]。
1.3.4 生理生化实验
经过初步筛选出的疑似乳酸菌菌株,进一步通过葡萄糖产气实验、明胶液化实验、硝酸盐还原实验、运动性实验、淀粉水解实验、产黏性实验、精氨酸产氨实验、产硫化氢实验、耐温性实验及氨基酸脱羧酶实验对其进行筛选[17]。
1.3.5 乳酸菌菌株的乳酸定性实验
乳酸菌是利用碳水化合物发酵产乳酸的一类细菌的总称[17],因此,采用纸层析法验证疑似乳酸菌菌株是否产乳酸:首先在滤纸的下方距底边约2~3 cm处划一横线,并每隔2.5~3.0 cm用铅笔划一“X”作样品点样点,并标注样品编号,同时以2%乳酸为标样,MRS液体培养基为空白对照;采用洁净的毛细管少量多次蘸取MRS液体培养基过夜培养的乳酸菌菌株点样,每点一次样,均用电吹风吹干;然后将点好样的滤纸置于层析缸中,使其饱和8 h,再添加展开剂,使其底部浸入展开剂中,层析至上行25 cm即可;取出晾干,喷洒显色剂后观察滤纸是否呈现黄色斑点,与标样和对照组比较,观察筛选的菌株培养液与标准乳酸液的保留系数(retention factor,Rf)
值是否相同[18]。
1.3.6 产酸速率实验
优良的发酵剂应具备快速发酵产酸的能力,能保证发酵过程中的安全,促进风味、营养物质、色泽的形成[19]。将从发酵全鱼体分离筛选的不同乳酸菌菌株分别接种至MRS液体培养基中,30 ℃培养24 h,以无菌MRS液体培养基为空白对照,采用PHS-2F pH计分别测定其pH值[20]。
1.3.7 耐盐、耐亚硝酸盐实验
发酵鱼制品的含盐量较高,因此制作肉制品发酵剂所选用的菌株要求具有一定的耐盐性,而亚硝酸盐能抑制微生物生长增殖,因此还要具备耐亚硝酸盐的性质[21]。将待测乳酸菌菌株分别接种至含有6 g/100 mL NaCl或150 mg/kg NaNO2的MRS液体培养基中,30 ℃生化培养箱中分别厌氧培养36、24 h,同时将分离的菌株分别接种至不加NaCl或不加NaNO2的MRS液体培养基中,于30 ℃培养36、24 h,以无菌MRS液体培养基作空白对照,分别对含有分离菌株的0、6 g/100 mL NaCl及0、150 mg/kg MRS液体培养基在可见光600 nm波长处测定光密度(optical density,OD)值[22-23]。
1.3.8 耐酸性实验
酸鱼是一种酸性体系,鱼肉发酵产生大量的有机酸(主要为乳酸),发酵体系pH值逐渐降低。成熟而优良的酸鱼pH值应低于4.6,因此作为发酵剂的乳酸菌应能耐受低pH值的乳酸环境。将上述分离筛选的乳酸菌菌株分别在MRS液体培养基活化24 h后,用无菌移液管吸取0.5 mL培养液,转置盛有10 mL磷酸盐缓冲液的试管中,滴加5 mol/L HCl调节pH值至2.5,磷酸盐缓冲液中乳酸菌初始浓度约为106~108 CFU/mL,37 ℃恒温培养3 h,以平板活菌数计数法测定存活菌数[24],按下式计算菌株存活率。
1.3.9 抑菌性实验
取MRS液体培养基活化后的乳酸菌菌株发酵液,经离心后取上清液;以Staphylococcus aureus和Escherichia coli為指示菌,分别用无菌移液管取0.1 mL经活化12 h的指示菌菌液,涂布在牛肉膏蛋白胨培养基上,并在指示菌培养平板上平均间隔3 cm分别打孔,每个孔内分别滴加200 μL经离心后的乳酸菌上清液,30 ℃培养24 h,记录待测乳酸菌菌株抑菌圈的大小[25-27]。
1.3.10 最适生长温度实验
分别将不同的待测菌株接入到MRS液体培养基中,分别置于10、15、20、25、30、35、40、45 ℃条件下培养24 h后于600 nm波长处测定其OD600 nm值,以不接种的液体MRS培养基为空白对照[28]。
1.3.11 生长曲线及pH值变化实验
分别取少量待测乳酸菌菌株接种到MRS液体培养基中,30 ℃活化24 h,取50 μL乳酸菌菌液,接种到5 mL MRS液体培养基中;采用可见分光光度计每隔4 h测定一次OD值,同时测定其pH值,连续测定36 h,然后每隔6 h测定一次,共连续测定48 h,同时做空白对照[29-31]。
1.3.12 16S rRNA序列分析
將筛选出的菌株采用试剂盒提取菌株基因组DNA,将各菌株基因组DNA进行16S rDNA基因序列聚合酶链式反应(polymerase chain reaction,PCR)扩增。采用细菌通用引物27F:5-AGAGTTTGATCCTGGCTCAG-3和1492R:5-GGTTACCTTGTTACGACTT-3进行扩增。扩增体系如下:2×T5 Direct PCR Mix 25 μL、10 μmol/L
正向27F引物2 μL、10 μmol/L反向1492R引物2 μL、基因组DNA 2 μL,无菌双蒸水补足至50 μL。PCR扩增程序如下:98 ℃预变性3 min;98 ℃、10 s,57 ℃、10 s,72 ℃、20 s,30 个循环;72 ℃延伸3 min[32]。
扩增后,对PCR产物进行1%琼脂糖凝胶电泳检测,将成功扩增的样品送至生工生物工程(上海)股份有限公司测序。将返回的测序结果在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库进行比对分析,初步鉴定菌株。
1.4 数据处理
所有实验均重复3 次,结果表示为平均值±标准差。使用Origin 2016软件作图,使用SPSS 17.0软件(SPSS Inc.,Chicago,IL)对数据进行统计和方差分析(P<0.05),判定数据间的差异显著性。
2 结果与分析
2.1 乳酸菌的分离培养结果
以湘西传统淡水全鱼发酵鱼为原料,共分离出106 株疑似乳酸菌菌株,菌株菌落形态有的呈圆形或针尖状,有的呈短杆状,光滑整齐、形态微小、菌落直径约1.0~2.0 mm、白色、透明或不透明。其中61 株为革兰氏阳性球菌、6 株为革兰氏阴性球菌、35 株为革兰氏阳性杆菌、4 株为革兰氏阴性杆菌。杆菌两端平直或稍弯曲,无鞭毛,无芽孢;球菌大多为单个分布或链状。
2.2 乳酸菌菌株的初步筛选结果
对分离出的96 株革兰氏阳性菌进行发酵葡萄糖产酸实验,其中71 株细菌可发酵葡萄糖产酸。对分离出的上述71 株革兰氏阳性菌进行接触酶实验,71 株菌均呈阴性。革兰氏染色阳性、接触酶阴性、可利用葡萄糖产酸的细菌可初步判定为乳酸菌。
2.3 生理生化实验结果
将初步分离纯化得到的71 株乳酸菌分别经葡萄糖产气实验、耐温性实验及硝酸盐还原等生理生化实验。由表1可知,从样品中筛选出13 株不产气、不产H2S,不产黏液、精氨酸不产氨、无氨基酸脱羧酶活性、耐低温的疑似乳酸菌菌株。
2.4 乳酸定性实验结果
由表2可知,经生理生化实验分离出的13 株疑似乳酸菌株发酵MRS液体培养基的最终产物均为乳酸,因此可以进一步判定13 株疑似菌株均为乳酸菌。
2.5 产酸速率实验结果
发酵鱼制品所需的发酵剂要求具有较快的产酸速率,以抑制致病菌和腐败菌生长,为产品提供适宜的风味。以菌株24 h产酸情况作为评价菌株产酸速率的指标,13 株初步筛选出的乳酸菌菌株在30 ℃、24 h内的pH值如表3所示。
由表3可知,在13 株被测菌株中,除了44号乳酸菌外,其余12 株菌株均具有较高的产酸速率。
2.6 耐盐、耐亚硝酸盐实验结果
依据比浊法原理,以乳酸菌菌株OD600 nm值的变化为生长指标,分析乳酸菌菌株的耐盐及耐亚硝酸盐特性。
由表4可知,筛选出的12 株乳酸菌菌株均能耐受质量浓度6 g/100 mL的食盐,其中24、211、213、411号菌株的OD600 nm值偏低,耐盐性不及113、118、145、27、28、29、220号菌株。
2.7 耐酸性实验结果
发酵鱼制品在发酵中伴随着pH值的持续降低,因此需要所用的发酵剂具有较强的耐酸性。筛选出的12 株乳酸菌在pH 2.5的磷酸盐缓冲液中37 ℃条件下培养3 h后的存活情况如表6所示。
由表6可知,不同乳酸菌菌株的耐酸能力存在差异,113号菌株在pH 2.5的酸性环境下不能存活,211、213、411号菌株存活率较低,其余菌株在pH 2.5的酸性环境下存活率高。
2.8 抑菌性实验结果
用大肠杆菌、金黄色葡萄球菌作为指示菌,在基础培养基上涂布,打孔后滴加200 μL于30 ℃培养24 h的乳酸菌菌株上清液,37 ℃培养24 h后观察各个菌株的抑菌圈大小。
由表7可知,24号菌株对大肠杆菌没有抑菌性,118、120、145、27、28、29、220号菌株对大肠杆菌和金黄色葡萄球菌具有明显的抑菌圈,表现出较好的抑菌效果。
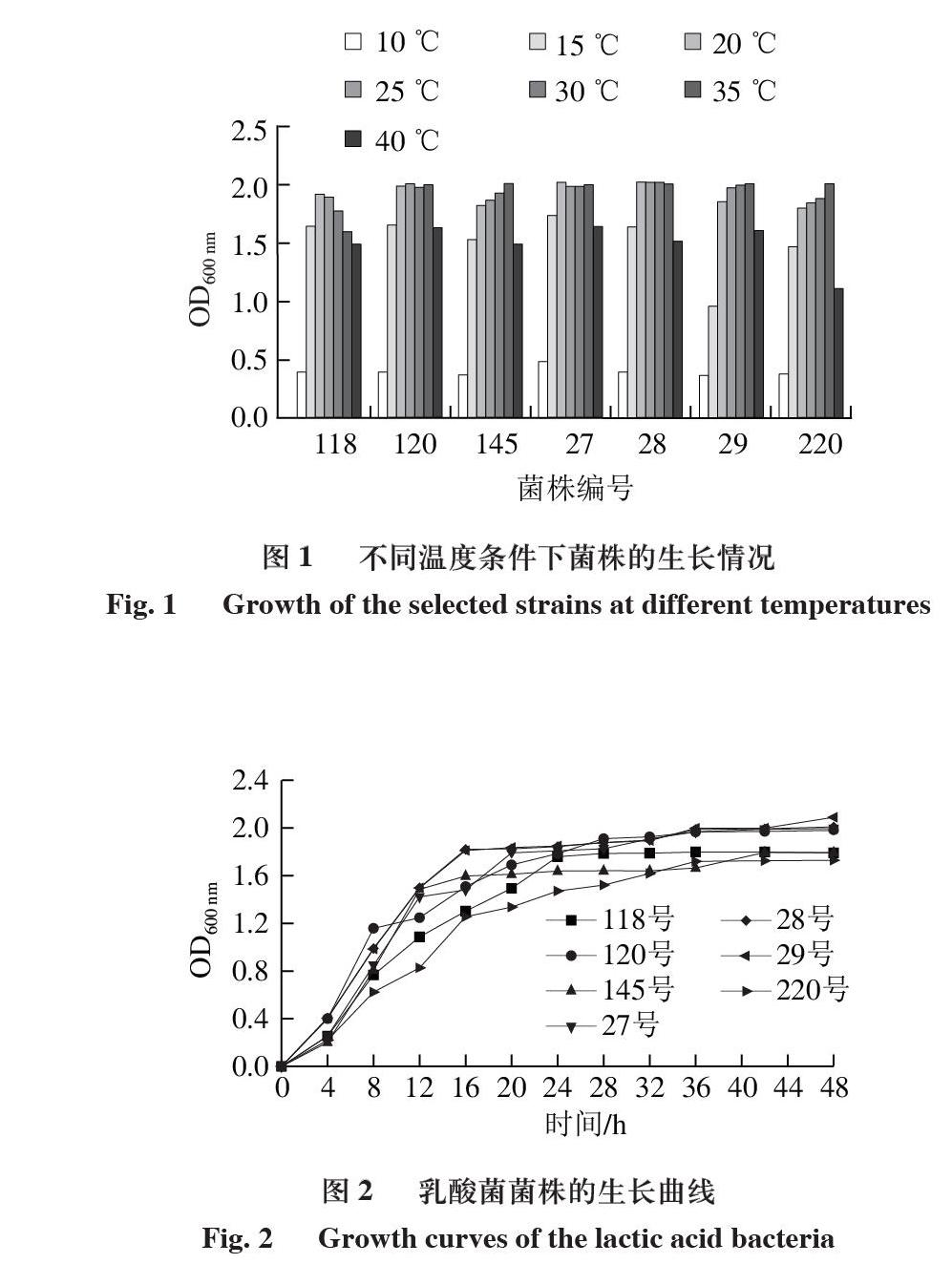
2.9 最适生长温度实验结果
由图1可知,7 株筛选出的乳酸菌菌株中,145、29、220号菌株的最适生长温度为35 ℃,118号菌株的最适生长温度为20 ℃,而120、27、28号菌株在20~35 ℃之间的生长情况没有明显差别。
2.10 生长曲线及pH值变化实验结果
生长曲线的测定:采用测定乳酸菌菌体在生长期间密度的变化,监测菌体的活力变化,明确菌体的适宜收获时间。菌体收获期往往为对数生长末期或稳定生长前期。由图2可知,7 株筛选出的乳酸菌菌株延滞期很短,在培养初期就能到达对数生长期,28、29号菌株在16 h后到达稳定生长期,生长速率明显高于其他菌株,145号菌株也能在16 h后到达稳定生长期,120、27号菌株能在20 h后到达稳定生长期,118、220号菌株28 h后到达稳定生长期,其生长速率低于其他菌株。
由图3可知:7 株筛选出的乳酸菌菌株中118、220号菌株在培养初期pH值降低较为缓慢,在4 h后pH值迅速降低,随着培养时间延长,pH值逐渐降低,在28 h后pH值降低缓慢,培养48 h后,pH值分别为4.03和4.16;其余菌株均能在培养初期促使MRS培养液pH值迅速降低,27号菌株在20 h后pH值降低趋于平缓,培养48 h后,pH值为3.97,145、28、29号菌株在24 h后pH值降低趋于平缓,培养48 h后,pH值分别为4.08、3.96和3.95,120号菌株在28 h后pH值逐渐缓慢降低,培养48 h后,pH值为3.69。
2.11 16S rRNA序列分析结果
通过以上一系列生理生化和发酵特性实验,最终筛选出7 株适宜发酵的乳酸菌菌株,经PCR结合琼脂糖凝胶电泳分析,将送至生工生物工程(上海)股份有限公司测得7 株菌的16S rRNA序列与NCBI数据库中已知细菌基因序列进行比对。
由表8可知,118、120、145、27、220号菌株与植物乳杆菌(Lactobacillus plantarum)序列的相似性均达99%,28、29号菌株与戊糖片球菌(Pediococcus pentosaceus)序列的相似性达99%,即118、120、145、27、220号菌株属于植物乳杆菌,28、29号菌株属于戊糖片球菌。
3 结 论
本研究从传统淡水全鱼发酵制品中分离、纯化出71 株革兰氏阳性、接触酶阴性、可利用葡萄糖产酸的疑似乳酸菌,通过对分离出的71 株疑似乳酸菌菌株进行生理生化实验,从中筛选出13 株不产气、不产H2S、不产黏液、精氨酸不产氨、无氨基酸脱羧酶活性、耐低温的疑似乳酸菌菌株;对这13 株疑似乳酸菌菌株进行纸层析乳酸定性实验、耐盐实验、产酸速率实验、耐酸实验、抑菌性实验、最适生长温度实验、生长曲线及pH值变化实验,得到符合淡水全鱼发酵制品发酵条件的118、120、145、27、28、29、220号7 株乳酸菌菌株;对适宜发酵的7 株乳酸菌进行种属鉴定,结果表明,28、29号菌株为戊糖片球菌,118、120、145、27、220号菌株为植物乳杆菌。筛选出传统酸鱼中的有益发酵乳酸菌,并在后期作为发酵剂接种发酵酸鱼,对改善酸鱼工艺、提高酸鱼风味和安全性将具有重要意义。
参考文献:
[1] 刘子飞, 孙慧武, 蒋宏斌, 等. 我国水产加工业发展现状、问题与对策[J]. 中国水产, 2017(12): 43-46.
[2] 燕平梅. 微生物發酵技术[M]. 北京: 中国农业科学技术出版社, 2010: 1-3.
[3] YIN Lijung, TONG Yalin, JIANG Shanntzong. Effect of combining proteolysis and lactic acid bacterial fermentation on the characteristics of minced mackerel[J]. Journal of Food Science, 2005, 70(3): 186-192. DOI:10.1111/j.1365-2621.2005.tb07155.x.
[4] DEATRAKSA J, SUNTHORNTHUMMAS S, RANGSIRUJI A, et al. Isolation of folate-producing Weissella spp. from Thai fermented fish (Plaa Som Fug)[J]. LWT-Food Science and Technology, 2018, 89: 388-391. DOI:10.1016/j.lwt.2017.11.016.
[5] 许艳顺. 发酵鲢鱼鱼糜凝胶形成及其机理研究[D]. 无锡: 江南大学, 2010: 1-2.
[6] ZENG Xuefeng, XIA Wenshui, JIANG Qixing, et al. Chemical and microbial properties of Chinese traditional low-salt fermented whole fish product Suan yu[J]. Food Control, 2013, 30(2): 590-595. DOI:10.1016/j.foodcont.2012.07.037.
[7] ZENG Xuefeng, CHEN Xiaohua, ZHANG Wei. Characterization of the microbial flora from Suan yu, a Chinese traditional low-salt fermented fish[J]. Journal of Food Processing and Preservation, 2016, 40(5): 1093-1103. DOI:10.1111/jfpp.12690.
[8] ZENG Xuefeng, XIA Wenshui, JIANG Qixing, et al. Effect of autochthonous starter cultures on microbiological and physico-chemical characteristics of Suan yu, a traditional Chinese low salt fermented fish[J]. Food Control, 2013, 33(2): 344-351. DOI:10.1016/j.foodcont.2013.03.001.
[9] 张倩, 郭晓芸, 张海松, 等. 贵州荔波传统酸肉发酵期间理化成分与发酵风味物质分析[J]. 食品科学, 2013, 34(4): 173-177.
[10] 李宗军, 江汉湖, 李红琼, 等. 湘西侗族传统发酵肉的产品特性[J]. 湖南农业大学学报(自然科学版), 2002, 28(1): 61-63. DOI:10.3321/j.issn:1007-1032.2002.01.020.
[11] 车科, 麻成金, 黄群, 等. 湘西传统酸肉乳酸菌分离、筛选及鉴定[J]. 中国酿造, 2008, 27(6): 25-28. DOI:10.3969/j.issn.0254-5071.2008.06.007.
[12] FONTANA C, VIGNOLO G, COCCONCELLI P S. PCR-DGGE analysis for the identification of microbial populations from Argentinean dry fermented sausages[J]. Journal of Microbiological Methods, 2005, 63(3): 254-263. DOI:10.1016/j.mimet.2005.03.010.
[13] BUCZKOWSKA M, DERFEL G. Safety properties and molecular strain typing of lactic acid bacteria from slightly fermented sausages[J]. Journal of Applied Microbiology, 2010, 100(1): 40-49. DOI:10.1111/j.1365-2672.2005.02772.x.
[14] YU Jie, WANG Weihong, MENGHE Bilige, et al. Diversity of lactic acid bacteria associated with traditional fermented dairy products in Mongolia[J]. Journal of Dairy Science, 2011, 94(7): 3229-3241. DOI:10.3168/jds.2010-3727.
[15] LIU Wenjun, BAO Qiuhua, JIRIMUTU, et al. Isolation and identification of lactic acid bacteria from Tarag in Eastern Inner Mongolia of China by 16S rRNA sequences and DGGE analysis[J]. Microbiological Research, 2012, 167(2): 110-115. DOI:10.1016/j.micres.2011.05.001.
[16] 朱小紅, 杨振泉, 顾瑞霞, 等. 新疆传统乳制品中优良乳酸菌的筛选及多菌株发酵剂的研究[J]. 食品与发酵工业, 2008, 34(12): 30-34.
[17] 凌代文. 乳酸菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 117-129.
[18] 桂萌, 张晓琼, 于沐洋, 等. 耐热乳酸菌肉品天然发酵剂的筛选鉴定[J]. 肉类研究, 2011, 25(8): 7-11. DOI:10.3969/j.issn.1001-8123.2011.08.001.
[19] AMMOR M S, MAYO B. Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production: an update[J]. Meat Science, 2007, 76(1): 138-146. DOI:10.1016/j.meatsci.2006.10.02.
[20] 刘素纯, 胡茂丰, 李宗军. 自然发酵肉制品中乳酸菌的分离及特性研究[J]. 食品与机械, 2006(2): 62-65. DOI:10.3969/j.issn.1003-5788.2006.02.019.
[21] HOULE J F, LAFRANCE M, JULIEN J P, et al. Selection of mixed cultures for meat fermentation[J]. Journal of Food Science, 1989, 54(4): 839-842.
[22] AMMOR S, DUFOUR E, ZAGOREC M, et al. Characterization and selection of Lactobacillus sakei strains isolated from traditional dry sausage for their potential use as starter cultures[J]. Food Microbiology, 2006, 22(6): 529-538. DOI:10.1016/j.fm.2004.11.016.
[23] 刘丽莉, 杨协力. 发酵肉制品中乳酸菌菌种筛选研究[J]. 农业机械学报, 2006(8): 229-231. DOI:10.3969/j.issn.1000-1298.2006.08.059.
[24] PENNACCHIA C, ERCOLINI D, BLAIOTTA G, et al. Selection of Lactobacillus strains from fermented sausages for their potential use as probiotics[J]. Meat Science, 2004, 67(2): 309-317. DOI:10.1016/j.meatsci.2003.11.003.
[25] PAPAMANOLI E, KOTZEKIDOU P, TZANETAKIS N, et al. Characterization of Micrococcaceae isolated from dry fermented sausage[J]. Food Microbiology, 2002, 19(5): 441-449. DOI:10.1006/fmic.2002.0503.
[26] 张辉华, 曹永长, 毕英佐, 等. 6 株乳酸菌体外抑菌实验[J]. 中国兽医杂志, 2001(7): 8-10. DOI:10.3969/j.issn.0529-6005.2001.07.003.
[27] PAPAMANOLI E, TZANETAKIS N, LITOPOULOU-TZANETAKI E, et al. Characterization of lactic acid bacteria isolated from a Greek dry-fermented sausage in respect of their technological and probiotic properties[J]. Meat Science, 2003, 65(2): 859-867. DOI:10.1016/s0309-1740(02)00292-9.
[28] MAURIELLO G, CASABURI A, BLAIOTTA G, et al. Isolation and technological properties of coagulase negative Staphylococci from fermented sausages of Southern Italy[J]. Meat Science, 2004, 67(1): 149-158. DOI:10.1016/j.meatsci.2003.10.003.
[29] 迪娜热尔·迪力达西, 刘璐, 加勒哈斯别克·塞力克, 等. 新疆传统發酵乳品中乳酸菌与酵母菌的益生特性[J]. 中国微生态学杂志, 2018, 30(1): 5-9. DOI:10.13381/j.cnki.cjm.201801002.
[30] 钟凯, 何庆华, 吴永宁. 乳酸菌ATCC367菌株在不同培养条件下的生长特性差异[J]. 中国食品卫生杂志, 2009, 21(3): 225-228.
[31] 罗红霞, 张俊, 王建, 等. 一株青贮用高性能乳酸菌的筛选[J]. 安徽农业大学学报, 2017, 44(4): 604-608. DOI:10.13610/j.cnki.1672-352x.20170811.014.
[32] TANASUPAWAT S, THONGSANIT J, OKADA S, et al. Lactic acid bacteria isolated from soy sauce mash in Thailand[J]. The Journal of General and Applied Microbiology, 2006, 48(4): 201-209. DOI:10.2323/jgam.48.201.
收稿日期:2019-03-07
基金项目:国家自然科学基金地区科学基金项目(31760455);贵州省科学技术基金项目(黔科合[2016]1046)
第一作者简介:林城杏(1994—)(ORCID: 0000-0001-9926-920X),女,硕士研究生,研究方向为食品加工。E-mail: 865323261@qq.com
*通信作者简介:范劲(1970—)(ORCID: 0000-0001-6141-909X),女,副教授,本科,研究方向为食品加工与安全。E-mail: 529715291@qq.com
