原发性肝细胞癌组织miR-221表达变化及其对肿瘤侵袭和转移的影响
2019-07-19张海雄彭亮冯伟清
张海雄,彭亮,冯伟清
(广东医科大学附属佛山禅城中心医院,广东佛山528000)
肝细胞癌(HCC)是原发性肝癌中最常见的一种类型,占原发性肝癌的70%~85%。目前,手术切除仍是HCC的首选治疗方法,也是最有效的治疗方法[1]。但HCC早期易侵袭和转移,患者术后5年生存率较低[2,3]。目前对HCC发生、发展的分子机制尚不完全清楚。微小RNA(miRNA)是一类广泛存在于真核生物体内的内源性非编码小分子RNA,长度19~25个核苷酸,主要通过结合靶基因mRNA的3′UTR区,参与基因转录后调控。已有研究证实,miRNA可通过调控癌基因或抑癌基因表达,参与肿瘤细胞增殖、分化、凋亡等生物学过程。miR-221是近年发现的miRNA,属于miR-221/222基因家族成员之一。有研究发现,在多种恶性肿瘤组织中miR-221表达异常增高,并与肿瘤的发生、发展密切相关[4]。但在HCC组织中miR-221表达变化的报道较少,其能否参与HCC的发生、发展亦不十分清楚。为此,本研究观察了原发性HCC组织miR-221表达变化,并探讨其表达变化对肿瘤侵袭和转移的影响。现报告如下。
1 材料与方法
1.1 材料 选择2014年6月~2017年6月广东医科大学附属佛山禅城中心医院手术切除的HCC组织及其配对的癌旁正常组织(距肿瘤组织边缘≥2 cm)各74例份。所有标本经组织病理学检查证实。标本来源患者均为初诊原发性HCC,术前未接受任何抗肿瘤治疗,且未合并其他组织或器官恶性肿瘤。其中,男54例、女20例,年龄(52.4±12.6)岁;合并症:肝硬化48例,HBV感染60例;肿瘤直径:≥5 cm 40例,<5 cm 34例;肿瘤数量:单发58例,多发16例;Edmondson-Steiner分级:Ⅰ、Ⅱ级48例,Ⅲ、Ⅳ级26例;临床分期:Ⅰ、Ⅱ期45例,Ⅲ、Ⅳ期29例;有微血管侵犯30例,无微血管侵犯44例。本研究经广东医科大学附属佛山禅城中心医院医学伦理委员会批准,患者或其家属知情同意。
高侵袭性HCC细胞株MHCC97H、低侵袭性HCC细胞株MHCC97L及正常肝细胞株L02(以下分别称MHCC97H、MHCC97L、L02细胞),购自中国科学院上海生命科学研究院细胞资源中心。LightCycler®96实时荧光定量PCR仪,瑞士Roche公司。miR-221抑制物(miR-221 inhibitor)及其阴性对照物(NC inhibitor),购自上海吉玛制药技术有限公司;miR-221及内参U6引物序列,由广州市锐博生物科技有限公司设计合成。TRIzol、LipofectamineTM2000,美国Invitrogen公司;逆转录试剂盒(PrimeScript RT Reagent Kit with gDNA Eraser)、实时荧光定量PCR试剂盒(SYBR® Premix Ex TaqTMⅡ),日本TaKaRa公司;纤维连接蛋白(Fibronectin)、四甲基偶氮唑蓝(MTT),美国Sigma公司;Transwell小室,美国Corning公司;Matrigel胶,美国BD公司。
1.2 HCC组织与癌旁正常组织miR-221表达检测 采用RT-qPCR法。取手术切除的HCC组织及其配对的癌旁正常组织,液氮中充分研磨,采用TRIzol法提取组织总RNA。经紫外分光光度计鉴定,OD260/OD280为1.8~2.0,表明提取的总RNA浓度和纯度合格。按PrimeScript RT Reagent Kit with gDNA Eraser说明将总RNA逆转录为cDNA。以cDNA为模板,按SYBR®Premix Ex TaqTMⅡ说明进行PCR扩增。引物序列:miR-221上游引物5′-CAAGGAATCATGTATGCTGTAG-3′,下游引物5′-AGGATGACATTACACCTTATCTC-3′;U6上游引物5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物5′-CGCTTCACGAATTTGCGTGTCAT-3′。PCR反应体系共25 μL:SYBR® Premix Ex TaqTMⅡ(2×)12.5 μL,cDNA 2 μL,上下游引物各1 μL,无酶水8.5 μL;反应条件:95 ℃预变性10 min,95 ℃ 15 s、60 ℃ 1 min共40个循环。以U6为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。以miR-221表达的均数为截断值,将HCC组织分为miR-221高表达与miR-221低表达,分析不同miR-221表达与患者临床病理特征的关系。
1.3 细胞实验
1.3.1 细胞传代培养 将MHCC97H、MHCC97L、L02细胞分别接种于含10% FBS、100 μg/mL链霉素、100 U/mL青霉素的DMEM培养基,置于37 ℃、5% CO2的细胞培养箱中培养。每3 d更换1次新的培养基。当细胞生长融合80%~90%时,用0.25%胰蛋白酶消化,每2~3 d按1∶3传代1次。取传3代、对数生长期、生长状态良好细胞进行后续实验。
1.3.2 各细胞miR-221表达检测 采用RT-qPCR法。取传3代、对数生长期、生长状态良好的MHCC97H、MHCC97L、L02细胞,采用TRIzol法提取细胞总RNA,按1.2中的方法进行逆转录和PCR扩增。以U6为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。选择miR-221相对表达量最高的细胞系进行后续实验。
1.3.3 细胞分组与转染 将上述miR-221相对表达量最高的细胞接种于6孔板,随机分为观察组和对照组,然后置于37 ℃、5% CO2的细胞培养箱中培养。当细胞生长融合60%~80%时,按LipofectamineTM2000说明,观察组加入100 pmol miR-221 inhibitor和5 μL LipofectamineTM2000转染试剂,对照组加入100 pmol NC inhibitor和5 μL LipofectamineTM2000转染试剂。转染24 h,收集细胞,采用RT-qPCR法检测miR-221表达,具体方法参照1.2。每组设6个复孔,实验重复3次,取平均值。
1.3.4 细胞黏附能力检测 采用细胞-基质黏附实验。将96孔板分别用Fibronectin或Matrigel胶包被,37 ℃孵育过夜;次日,每孔加入2%牛血清白蛋白75 μL,37 ℃孵育1 h。收集两组转染24 h细胞,用含0.1%牛血清白蛋白的DMEM培养液重悬,制成密度为5×105个/mL的细胞悬液。取细胞悬液100 μL接种于已包被基质胶的96孔板中,37 ℃孵育1 h;弃培养基,PBS彻底清洗,去除未黏附细胞,然后每孔加入10 μL MTT,37 ℃孵育4 h;去除孔内培养基,加入100 μL二甲基亚砜,充分溶解结晶。酶标仪于490 nm波长处检测各孔的OD值。以OD490值表示细胞黏附能力。每组设5个复孔,实验重复3次,取平均值。
1.3.5 细胞侵袭和迁移能力检测 ①细胞侵袭能力检测:采用Transwell侵袭实验。Matrigel胶4 ℃过夜融化,用不含血清的DMEM培养基按1∶5稀释后,包被Transwell小室上室的基底膜,然后将Transwell小室置于37 ℃、5% CO2的细胞培养箱1 h,待Matrigel胶凝固。收集两组转染24 h细胞,用无血清的DMEM培养液重悬,制成密度为1×105个/mL的细胞悬液。取细胞悬液200 μL加入Transwell小室上室,下室加入600 μL含10% FBS的DMEM培养基,然后将Transwell小室置于37 ℃、5% CO2的细胞培养箱中继续培养。培养24 h,取出小室,用棉签轻轻拭去上室未穿透细胞,4%多聚甲醛固定10 min,0.1%结晶紫染色,倒置显微镜下观察。随机取5个200倍视野,计数穿膜细胞数。以穿膜细胞数表示细胞侵袭能力。实验重复3次,取平均值。②细胞迁移能力检测:采用Transwell迁移实验。除了不用Matrigel胶包被Transwell小室上室的基底膜外,其余同Transwell侵袭实验。

2 结果
2.1 HCC组织与癌旁正常组织miR-221表达比较 HCC组织与癌旁正常组织miR-221相对表达量分别6.78±0.39、0.98±0.05,二者比较P<0.05。
2.2 HCC组织miR-221表达与患者临床病理特征的关系 74例份HCC组织中,miR-221高表达39例份、miR-221低表达35例份。HCC组织miR-221高表达与Edmondson-Steiner分级、微血管侵犯和临床分期有关(P均<0.05),与性别、年龄、肿瘤直径、肿瘤数目、肝硬化、HBV感染无关(P均>0.05)。见表1。
2.3 MHCC97H、MHCC97L、L02细胞miR-221表达比较 MHCC97H、MHCC97L、L02细胞miR-221相对表达量分别为9.47±0.43、5.26±0.36、1.02±0.06。MHCC97H、MHCC97L细胞miR-221相对表达量均明显高于L02细胞,且MHCC97H细胞miR-221相对表达量明显高于MHCC97L细胞(P均<0.05)。
2.4 两组miR-221表达比较 转染24 h,观察组与对照组miR-221相对表达量分别0.27±0.09、1.05±0.05,两组比较P<0.05。
2.5 两组细胞黏附能力比较 用Fibronectin包被时,观察组与对照组细胞黏附能力分别为0.266±0.021、0.398±0.032;用Matrigel胶包被时,观察组与对照组细胞黏附能力分别为0.295±0.011、0.423±0.023。两组比较P均<0.05。
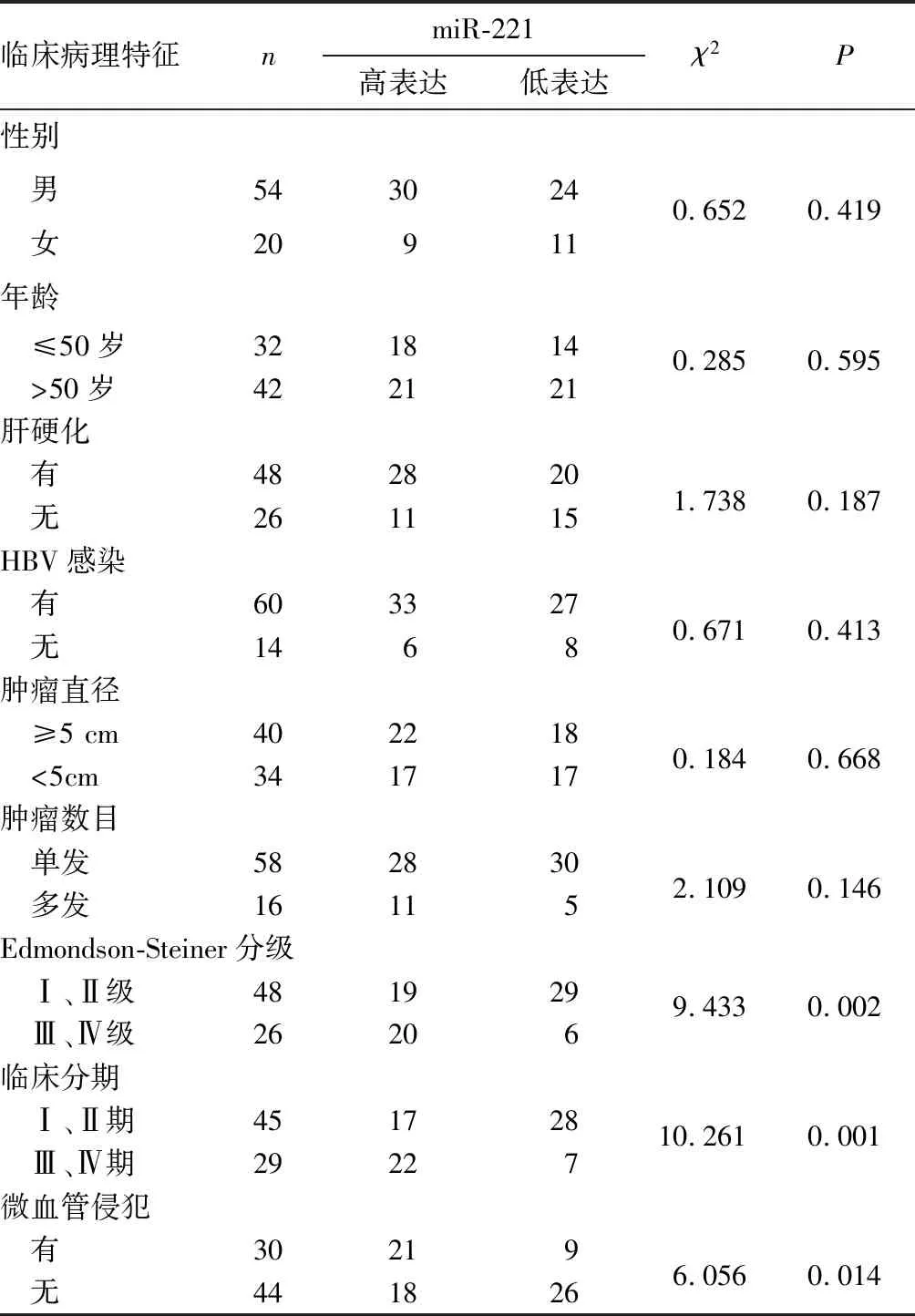
表1 HCC组织不同miR-221表达与患者临床病理特征的关系(例)
2.6 两组细胞侵袭能力比较 观察组与对照组穿膜细胞数分别(35±8)、(140±23)个,两组比较P<0.05。
2.7 两组细胞迁移能力比较 观察组与对照组穿膜细胞数分别(119±19)、(281±40),两组比较P<0.05。
3 讨论
原发性肝癌是临床常见的消化系统恶性肿瘤之一,HCC是其最常见的类型。目前,手术切除仍是HCC的首选治疗方法。由于HCC侵袭性强、恶性程度高、进展速度快,早期易侵袭和转移,故其术后5年生存率较低[5,6]。但目前对HCC侵袭和转移的分子机制尚不十分清楚。
miRNA是一类长度为19~25个核苷酸的内源性非编码小分子RNA,能够通过碱基配对的方式结合到靶基因mRNA的3′UTR区,从而抑制靶基因翻译,在机体生理或病理生理过程中发挥重要作用[7]。有研究证实,miRNA在HCC的发生、发展过程中扮演重要角色[8]。miR-221是近年发现的miRNA家族成员之一,属miR-221/222基因家族,其染色体定位于Xp11.3。有研究证实,miR-221在多种恶性肿瘤中具有癌基因作用,如胰腺癌、结肠癌、卵巢癌等[9~13],可促进肿瘤细胞增殖、侵袭和迁移等恶性生物学行为。但在HCC组织中miR-221表达的报道较少,其能否参与HCC的发生、发展亦不十分清楚。本研究结果发现,HCC组织miR-221相对表达量明显高于癌旁正常组织,且其高表达与Edmondson-Steiner分级、微血管侵犯和临床分期有关。提示miR-221在HCC中亦具有癌基因作用,可参与其发生、发展。本研究还观察了MHCC97H、MHCC97L、L02细胞miR-221表达变化,结果发现,MHCC97H细胞和MHCC97L细胞miR-221相对表达量明显高于L02细胞,与miR-221在其他恶性肿瘤细胞中的表达一致,并且MHCC97H细胞miR-221相对表达量明显高于MHCC97L细胞。进一步说明,miR-221可能参与HCC的发生、发展。
侵袭和转移是恶性肿瘤最基本的生物学特征,也是影响患者预后的重要原因。肿瘤细胞与细胞外基质黏附以及侵袭和迁移是肿瘤转移过程中的关键环节。为了观察miR-221对HCC细胞与细胞外基质黏附、侵袭和迁移能力的影响,我们通过脂质体转染法将miR-221抑制物转染至MHCC97H细胞,成功下调了MHCC97H细胞miR-221表达,采用细胞-基质黏附实验检测两组细胞黏附能力变化,结果发现,无论采用Fibronectin包被还是采用Matrigel胶包被,观察组细胞黏附能力均明显低于对照组。进一步研究发现,观察组细胞侵袭和迁移能力均明显低于对照组。提示下调miR-221表达有可能抑制HCC细胞基质黏附、侵袭和迁移能力,这为HCC的分子靶向治疗提供了依据。miRNA的功能主要取决于其所调控的下游靶基因功能,一个miRNA可能调控数十个甚至上百个靶基因,而一个靶基因可能收到数十个甚至上百个miRNA的调控。目前研究较多的miR-221下游靶基因有细胞周期蛋白依赖性激酶抑制剂Cip/Kip家族成员p27Kip1[14]和抑癌基因TP53INP1[15]、PTEN[16]以及碱性螺旋-环-螺旋转录因子家族成员Twist2[17]等,这些靶基因的生物学功能不同,也决定了miR-221在不同疾病进展过程中的作用不同。但miR-221调控HCC细胞侵袭和迁移的下游靶基因尚不明确,仍需进一步研究探索。
综上所述,HCC组织miR-221表达明显升高,其高表达可促进肿瘤的侵袭和转移。下调miR-221表达能够抑制HCC细胞的黏附、侵袭和迁移能力,这为HCC的分子靶向治疗提供了依据。
