锌转运体对男性(雄性)生殖作用的研究进展
2019-07-18施磊蒋晨依吴望舒朱欣烨余承瑄刘悦丁之德
施磊,蒋晨依,吴望舒,朱欣烨,余承瑄,刘悦,丁之德
锌转运是指锌在细胞内或细胞间的运输过程。锌转运过程主要由两大蛋白家族调控,即锌转运蛋白家族(Zinc transporter,ZnT)和锌铁调控转运蛋白家族(Zrt-,Irt-like protein,ZIP)[1]。前者能将锌由胞质中转运到胞质外(包括胞外基质、囊泡与细胞器),后者则将锌由胞质外转运到胞质中。在男性生殖系统中,锌被认为是精子发生过程中主要营养物质之一[2]。锌在男性的睾丸、附睾和前列腺中都有分布,参与保护睾丸Sertoli细胞、促进睾酮生成等过程;而锌转运体能精确调控各组织和生精细胞中锌的含量,并在这些过程中发挥了重要作用。
1 锌转运体
1.1 ZnT家族
1.1.1 ZnT家族的结构特点 ZnT家族又称膜运输蛋白家族30(solute carrier 30,SLC30),是一类膜运输蛋白,介导锌由胞质中转运到胞质外。目前在人体中已发现10个家族成员(ZnT1~10)。除ZnT5、ZnT6外,其他成员均以同二聚体的形式存在于质膜上。目前人类ZnT家族的X衍射晶体结构还未能获得,但细菌来源的同源物YiiP晶体结构已经明晰,因此,可以由二者序列的相似性推测人类ZnT家族蛋白的结构[3]。据推测,ZnT家族成员均有6个保守的跨膜结构域(TMs)。氨基(N)端与羧基(C)端均位于胞质侧[4]。TM2和TM5之间有4个亲水性的残基,可能具有结合锌的功能[5]。靠近C端的部分有一个可以结合2个锌离子的位点。此外,大部分ZnT家族的成员在TM4与TM5之间有一个富含组氨酸的套环(histidine-rich loop)结构[3]。
1.1.2 ZnT家族的定位与功能 ZnT1兼有促进胞质内锌外流[6]和抑制锌通过L型钙通道(L-type calcium channel,LTCC)内流[7]的功能。除了能够调控细胞内外锌的分布外,ZnT1还能够通过与RAF原癌基因丝氨酸苏氨酸蛋白激酶1(RAFproto-oncogene serine/threonine-protein kinase-1,Raf-1)结合启动胞外信号反应激酶(ERK)信号通路,从而调控靶细胞的生理活动。ZnT2的功能与其细胞内定位有关。研究表明,定位于内体(endosome)和分泌小室(secretory compartment)的ZnT2能够将锌离子从胞质转运到小泡并最终分泌,而定位于质膜的ZnT2与胞质锌转运出细胞有关。ZnT2同样可存在于线粒体内膜,并对线粒体锌池(zinc pool)的维持和扩大起到重要作用。ZnT3在大脑和睾丸组织中特异性高表达。目前研究较为明确的是定位于大脑谷氨酸能神经元的ZnT3,其作用可将锌离子转运至突触小泡[8]。睾丸组织的ZnT3的具体功能尚不清楚,推测其参与了精子发生过程中锌离子的转运。ZnT4、ZnT5、ZnT6与ZnT7拥有相似的生理学功能。研究显示,组织非特异性碱性磷酸酶(tissue non-specific alkaline phosphatase,TNAP)的激活受ZnT1、ZnT4、ZnT5、ZnT6和ZnT7共同调控[9]。此外,ZnT4、ZnT5、ZnT6和ZnT7在前列腺腺上皮细胞中均有表达,它们可能共同参与了转运锌进入腺上皮细胞内质网和(或)高尔基体以维持锌稳态过程。ZnT8主要在胰岛β细胞的胰岛素分泌小泡上表达,对于胰岛素晶体的形成十分重要。ZnT8在睾丸组织中也有表达,其功能可能与睾酮合成有关[10]。ZnT9具有启动Wnt信号通路和维持锌稳态的双重功能,而目前研究显示ZnT10是锰转运体,其作为锌转运体的功能还尚未被发现[11]。表1为ZnT家族在男性生殖系统中的分布及亚细胞定位。
1.2 ZIP家族
1.2.1 ZIP家族的结构特点 ZIP家族又称膜运输蛋白家族39(solute carrier 39,SLC39),是一类介导锌摄入的跨膜蛋白。目前已在人体中发现14个成员(ZIP1~14)。根据蛋白结构特点,ZIP家族又可分为4个亚家族,即LIV-1、subfamilyⅠ、subfamilyⅡ和gufA。大部分ZIP家族成员具有8个保守的跨膜域[5]。N端与C端均位于胞质外侧,即细胞器膜内侧或质膜外侧。其中N端很长且富含组氨酸,可能与锌的转运有关,而C端则非常短[4]。大部分ZIP在TM3和TM5之间有一个套环(loop)区域,其中有一段富含组氨酸的序列。TM4与TM5为具有双亲性(amphiphile)即亲水性和亲脂性(疏水性)的螺旋,被认为可形成一个供金属离子穿过的腔隙[4]。
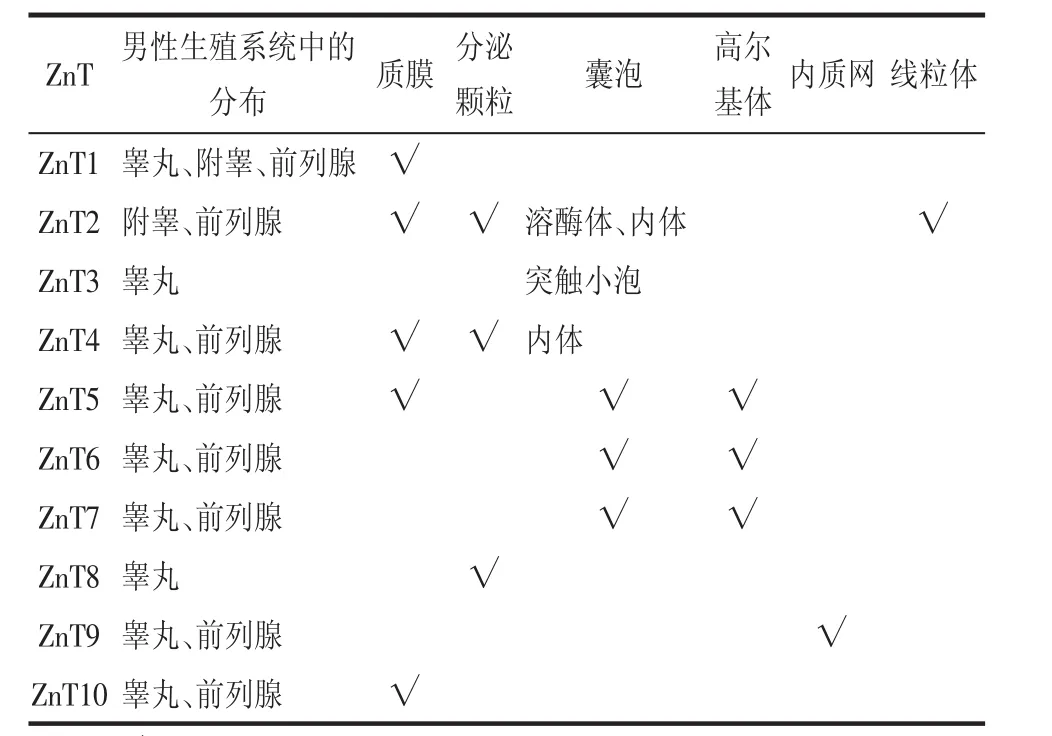
表1 ZnT家族在男性生殖系统中的主要分布及亚细胞定位
1.2.2 ZIP家族的定位与功能 ZIP1主要分布在质膜上,负责将胞外锌转运至胞质内。ZIP2和ZIP3都是重要的锌摄入转运体。ZIP4主要表达于人表皮角质形成细胞(human epidermal keratinocyte),其编码基因突变会导致肠病性肢端皮炎(acrodermatitis enteropathica)。研究发现,敲除ZIP4基因会导致角质形成细胞胞质中锌含量下降以及锌结合蛋白ΔNp63转录活性降低,致使表皮最上层角质形成细胞增殖,提示ZIP4在维持表皮角质形成细胞锌稳态中有重要作用[12]。ZIP5存在于睾丸中,在Sertoli细胞和精原细胞的质膜上均有表达。需要指出的是,尽管Sertoli细胞质膜上有ZIP1,但在Sertoli细胞主要负责锌内流的转运体是ZIP5[13]。ZIP6和ZIP10拥有相似的亚细胞定位,主要位于质膜[14]。在睾丸中,ZIP6和ZIP10都特异性表达于精子细胞,推测两者可能在精子发生过程中发挥富集锌的作用。另外,与其他ZIP家族的转运体不同,ZIP7主要存在于内质网上,其功能是将内质网内储存的锌释放到胞质中。目前已有研究发现,通过ZIP7释放到胞质的锌参与启动多种与细胞增殖和转移有关的信号通路,提示ZIP7在调控细胞正常生理活动方面有一定作用[15]。ZIP8和ZIP14是两个在进化上非常相近的转运体。过去的研究更注重于这两者在免疫方面的功能,而近期的研究表明,在男性生殖系统中,ZIP8和ZIP14的主要作用是为精母细胞发育提供锌。此外,在Leydig细胞表面也发现了ZIP14的表达,推测其能够在睾酮合成和分泌过程中提供锌。ZIP9除了作为锌转运体之外,近年来还被发现是一种重要的睾酮受体[16]。ZIP11是gufA亚家族的唯一成员,关于它的研究较少。现已知ZIP11具有增加胞内锌浓度和金属硫蛋白表达的功能。ZIP12在人脑中高度表达,敲除后虽不影响神经元细胞活力,但神经元产生的突起明显变少且变短,提示ZIP12在大脑发育过程中起关键作用。而目前未有研究发现睾丸组织中ZIP12的具体功能。ZIP13的亚细胞定位非常特殊,有研究认为ZIP13存在于高尔基体,而Jeong等[17]的研究显示ZIP13存在于细胞内富含锌的小泡中,但该小泡与已知细胞器的关系尚不清楚。目前已知ZIP13编码基因的缺陷会引起Spondylocheirodysplasia-Ehlers-Danlos综合征(Spondylocheirodysplasia-Ehlers-Danlos syndrome,SCD-EDS),Jeong等[17]在研究了SCD-EDS患者和未受影响的杂合子亲代(heterozygous parent)的原代成纤维细胞以及ZIP13靶向小干扰RNA(siRNA)转染的HeLa细胞和非靶向对照的HeLa细胞后,推测ZIP13可将锌从这些小泡中转运到胞质,从而维持细胞内锌稳态。表2为ZIP家族在男性生殖系统中的分布及亚细胞定位。

表2 ZIP家族在男性生殖系统中的主要分布及亚细胞定位
2 锌转运体在男性(雄性)生殖系统中的作用
2.1 锌转运体在睾丸中的作用
2.1.1 锌转运体与睾丸组织 大量实验证明,睾丸组织中锌在细胞分配失调,尤其是锌的缺乏,会导致睾丸功能受损。具体机制可能为氧化应激水平的上升,凋亡通路的激活以及炎症因子的释放等[18]。由此推测,锌转运体的正常分布对睾丸组织的保护起着重要作用,保证了锌在各种细胞中的合理分配,使锌发挥其正常的生理功能。尽管锌转运体在睾丸组织的大部分细胞中均有分布,但锌转运体如何调控睾丸组织中各种细胞内锌分配的机制或通路目前尚未完全阐明,如睾丸如何从血液循环中获得锌,如何调控精子发生中锌的转运。
2.1.2 锌转运体与生精细胞 锌转运体在生精细胞中有着独特的表达,参与了精子发生。在精子发生过程中,各阶段的生精细胞对于胞内锌含量有着不同的要求,而这依赖于锌转运体的差异化表达。有研究检测了表达于大鼠粗线期精母细胞与圆形精子细胞上的锌转运体,发现二者的锌转运体的表达不尽相同。ZnT6在粗线期精母细胞中的表达量为圆形精子细胞的5倍。ZIP12在圆形精子细胞中的表达量则是粗线期精母细胞中的5倍。进一步对于锌摄入的测定表明,这样的差异直接导致了二者胞内锌含量的不同。研究人员推测,这很可能是由于相对于粗线期精母细胞,处于精子发生后期的圆形精子细胞需要更多的胞内锌含量以完成染色质凝聚(condensation)等改变[19]。另一项对于小鼠的研究发现,精原细胞特异性表达ZIP14,而初级精母细胞、次级精母细胞则表达ZIP5,但两者的功能都主要为摄入锌。精母细胞还会通过调节ZIP8和ZIP10的表达量以辅助锌的摄入[20]。
此外,锌转运体也为精子细胞变形提供了重要保障。在精子细胞变形的过程中,一些特定的过程需要锌转运至胞质,而且不同阶段精子细胞质膜表面的锌转运体种类也不同。圆形精子细胞表达ZIP6、ZIP8和ZIP10,而正在伸长的精子细胞表达ZIP1和ZIP6,不再表达ZIP8与ZIP10。这种精子细胞质膜上锌转运体表达的变化除了可能与质膜特定区域的丧失有关,也可能与某些锌转运的途径不再被需要关联[20]。
2.1.3 锌转运体与睾丸其他细胞 锌转运体除直接参与精子发生过程外,还涉及构建适宜的睾丸微环境。睾丸Sertoli细胞表达ZnT1、ZIP5和ZIP9[16],其中ZnT1水平明显高表达。结合精母细胞特异性表达ZIP14的事实,有学者推测锌在睾丸内的转运方向是从Sertoli细胞转入精母细胞。此外,ZnT1可能与血睾屏障的功能有关。Sertoli细胞质膜上的ZIP9可与睾酮结合,进而通过与G蛋白的作用触发睾酮的非经典信号通路(non-classical testosterone signaling cascade),促进了紧密连接蛋白(claudin)的表达和紧密连接的形成,提示ZIP9对血睾屏障的维持有一定作用[16]。
另一方面,锌转运体与睾酮的生成密切相关。ZnT7在小鼠睾丸的Leydig细胞中表达,并且可能参与类固醇合成[21]。此外,有研究发现,在经人绒毛膜促性腺激素处理的新生小鼠Leydig细胞中,ZnT8的表达显著上升,与此同时,血清睾酮水平也有明显升高。后续实验指出,ZnT8基因敲除的小鼠血清睾酮水平远低于正常小鼠,进一步证明ZnT8在睾酮生物合成中起到关键作用。具体机制可能为ZnT8通过影响蛋白激酶A(protein kinase A,PKA)信号通路进而影响线粒体中的锌含量[10]。而表达于Leydig细胞质膜上的ZIP14则主要负责将锌转入细胞,转入的锌继而参与了睾酮的生物合成[20]。锌在5α-还原酶激活过程中至关重要,5α-还原酶为睾酮转化成生物活性形式5α-二氢睾酮所必需,而锌缺乏可使大鼠睾丸中参与睾酮合成酶的mRNA和蛋白水平均明显降低,最终导致睾酮合成量下降。
2.2 锌转运体在附睾中的作用 锌在附睾部位的转运方向是从附睾上皮细胞到储存的精子。附睾组织的锌含量高于睾丸组织,但仍低于输精管和精囊[13]。锌转运体可在附睾的不同部位表达[22]。免疫荧光实验发现,ZnT1在几乎所有附睾腔面的假复层纤毛柱状上皮内高表达,尤其是主细胞(principal cell)和基细胞(basal cell)。ZnT2在附睾管的腔面呈高表达且大部分在主细胞内,而围绕管腔的肌细胞(myoid cell)表达较少。ZIP家族中只有ZIP6和极少量的ZIP5被发现在主细胞有高表达[13]。由锌转运体维持的高锌含量对于附睾行使正常生理功能有着重要意义。一方面,高锌含量有助于维持附睾特异性蛋白谷胱甘肽过氧化物酶5(glutathione peroxidase 5,GPX5)的表达[23]。GPX5保护精子质膜免受活性氧损伤。另一方面,附睾组织内逐渐增多的锌储备及以ZnT家族蛋白为主导的表达模式是细胞外高锌环境的两个先决条件,附睾管道内的高锌浓度为附睾内精子提供了锌内流的强大驱动力。
然而,与附睾组织的锌转运体表达模式相反,附睾精子表面仅表达ZIP1、ZIP5、ZIP6和ZIP8,不表达ZnT家族蛋白[13]。这说明附睾精子在细胞程序性设定上是吸收锌的过程。原子吸收光谱测定法(atomic absorption spectrometry)证实附睾精子具有高效吸收锌的能力,因此其锌含量明显高于睾丸精子[13]。吸收的锌主要聚集在精子的颈部和中段,推测是为精子运动力的获得(motility acquisition)做好准备[24]。需要指出的是,免疫荧光、原子吸收光谱和金属自显影技术(autometallography)显示精子获得运动力之后在整个细胞内呈现出锌的减少[13]。早期的研究在海星精子中发现类似的变化,由此研究者假设聚集在精子中段的锌被胞外高亲和力的物质(如组氨酸和金属螯合剂)捕获,锌的外向转运起到催化启动精子运动的作用,但由于附睾精子表面未检测到ZnT家族蛋白表达,因此,该锌的外向转运如何实现还有待于进一步研究。此外,精子在附睾成熟中经历了染色质凝聚等变化。精子内逐渐升高的锌含量可能与染色质的重塑(remodeling)和压缩(compaction)有关[13]。虽然形态学实验已证明锌能够稳定精子的染色质和膜结构,然而锌转运体参与精子成熟的具体机制仍需要进一步实验来证明。
2.3 锌转运体在前列腺中的作用 前列腺是人体内锌含量最高的器官。在前列腺外周层的腺上皮分泌细胞中,每千克的湿重其锌含量高达3μmol。前列腺锌的功能主要与细胞代谢及增殖有关:一方面可以竞争抑制顺乌头酸酶,保护柠檬酸不被氧化,进而保护精子不被氧化。另一方面,胞质内锌通过调控线粒体产能效率,抑制细胞增殖,诱导凋亡。低锌含量与前列腺癌的发病密切相关,但锌离子调控前列腺腺上皮细胞的增殖与凋亡的生理学意义还有待研究[25]。
精浆中的锌浓度与前列腺功能有关。正常生育男性的精液中含高水平游离锌 [每100 mL含锌(14.08±2.01)mg],其含量远高于不育男性组[每100 mL含锌(10.32±2.98)mg][2]。精浆的锌可能和精子的抗氧化、损伤修复和生殖管道的免疫获得有关[2]。
参与前列腺锌分泌与转运的锌转运体主要来自ZnT家族。ZnT2分布在前列腺所有细胞的内质网上,其功能可能是使细胞胞质中锌含量达到最适水平。ZnT4、ZnT5、ZnT6和ZnT7分布于高尔基体和内质网,其转运的锌可能最终被分泌到胞外。ZIP1定位于前列腺腺上皮细胞的基底面,而在基底细胞中无表达[26]。该蛋白能快速转运血液中的锌,以维持前列腺腺上皮细胞内高锌含量。ZIP2、ZIP3和ZIP4定位于前列腺腺上皮细胞的腔面,主要通过重吸收精浆中锌以维持细胞内锌稳态[27-28]。ZIP9被发现定位于人前列腺癌PC-3细胞系的质膜,与Sertoli细胞质膜上ZIP9机制类似。ZIP9与睾酮结合后可激活G蛋白。然而,ZIP9在前列腺癌细胞中引发的信号通路下游靶蛋白与其在Sertoli细胞中不同,ZIP9可激活肿瘤细胞的线粒体凋亡通路,同时增加胞内锌含量,加速细胞凋亡进程[29]。
3 结语
综上所述,正常的锌转运过程有利于男性(雄性)生殖系统中锌代谢的稳态平衡,在精子发生和成熟中起着重要作用。锌转运异常将会影响生精上皮中生精细胞的正常发育、睾丸间质中Leydig细胞的睾酮生物合成、附睾中精子运动力的获得以及前列腺腺上皮中锌的重吸收等过程,最终导致男性(雄性)生育力受损。锌的代谢过程均需要锌转运体参与。然而,目前这一领域研究仍存在着大量的未知性:如人锌转运体家族的X衍射晶体结构如何,锌转运体的mRNA与蛋白在同一细胞内含量差别巨大的原因等。因此,更进一步阐明锌及转运体在男性(雄性)生殖系统中的具体作用机制,不仅可为临床弱精子症及其他男科疾病发病机制的探索提供新线索,同时也有望成为这些疾病治疗的潜在性靶点。
