体外受精-胚胎移植后双胎妊娠之一完全性葡萄胎一例报道
2019-07-18方昉郭哲璇廖慧慧
方昉,郭哲璇,廖慧慧
葡萄胎是一种良性的妊娠滋养细胞疾病(gestational trophoblastic disease,GTD)。双胎之一葡萄胎即双胎妊娠中一胎为葡萄胎,另一胎为正常胎儿,临床极为罕见,发生率约百万分之一[1]。近年来随着二胎政策的放开和辅助生殖技术(assisted reproductive technolgy,ART)的不断发展,发病率有所上升。双胎之一葡萄胎易出现大量阴道出血、妊娠滋养细胞肿瘤、子痫前期、甲状腺功能亢进、胎膜早破等并发症,严重影响母儿健康。故提高对该病的认识、临床准确诊断、恰当干预对该病的预后十分重要。目前尚无明确指南指导双胎之一葡萄胎的临床诊治。现回顾分析1例双胎之一完全性葡萄胎(complete hydatidiform mole,CHM) 患者的临床资料,探讨ART对其发病率的影响及双胎之一葡萄胎的临床特点、诊断和处理原则,供临床参考。
1 临床资料
患者 女,38岁。孕1产0,因体外受精-胚胎移植(IVFET)术后1个月余,阴道出血20余天,发热3 d,于2018年12月20日收入广州中医药大学第一附属医院(我院)。患者平素月经规律,经期7 d,周期28 d,末次月经:2018年10月19—26日,量色质如常。不明原因不孕,2018年11月5日行IVF-ET移植囊胚2个,11月22日无明显诱因阴道少量出血,后逐渐增多至月经量,11月29日于广东药科大学附属第三医院查人绒毛膜促性腺激素β亚单位(β-hCG)53 696.88 mIU/mL,孕酮(P)155.4 nmol/L,雌二醇(E2)3 180 pmol/L;三维彩色超声示:宫内早孕,胚胎存活,孕约6周,近宫腔下段囊性暗区,囊性暗区旁稍高回声,考虑血肿可能,大小约17 mm×14 mm,建议定期复查。遂于广东药科大学附属第三医院住院,予肝素抗凝,赛能、他克莫司、甲泼尼龙调节免疫,氨甲苯酸止血,黄体酮补充孕激素等安胎处理后阴道出血量减少。12月5日于广东药科大学附属第三医院复查β-hCG 114 107.43 mIU/mL,B型超声(B超)示:宫内早孕,胚胎存活,孕约7周,宫腔内混合性回声声像,考虑积血、盆腔积液。出院后转诊至中山大学孙逸仙纪念医院继续住院保胎治疗,12月13日复查阴道B超示:宫腔内见1孕囊,大小约47 mm×20 mm×37 mm,内见1卵黄囊及1胚胎,头臀长(CRL)约17.7 mm,见心管搏动,原始胎盘位于后壁,胚胎大小相当于孕8+2周,孕囊大小相当于孕8+3周,并见不规则液性暗区包绕孕囊约2/3面积,大小约41 mm×22 mm×62 mm,内见点片状稍高回声,考虑宫腔内血肿声像。12月17日上午患者无明显诱因出现寒战发热,最高体温39℃,伴少量阴道出血,舌淡红,苔白腻,脉弦滑。查尿白细胞3+,尿细菌4+,血超敏C反应蛋白>5 mg/L,C反应蛋白31.4 mg/L,中性粒细胞百分比(NEU%)94.8%,予抗炎、退热等对症治疗后,症状改善不明显,出院后转至我院住院治疗。入院诊断:中医诊断:1.胎漏-肾虚血瘀,2.发热-少阳证;西医诊断:1.先兆流产,2.发热(查因:泌尿系感染?宫内感染?),3.IVF-ET术后。
入院后生命体征平稳,完善相关检查(心电图、生化等,胸片暂未行),12月20日妊娠三项:β-hCG 235 321 IU/L,P 130.4 nmol/L,E28 427 pmol/L,血红蛋白(Hb)102 g/L,超敏C反应蛋白98.50 mg/L。口服中药和解少阳、解热利尿后患者退热,复查超敏C反应蛋白及尿常规未见明显异常;经中药补肾安胎,肌内注射黄体酮补充孕激素维持妊娠等对症处理后,患者无明显阴道出血。12月29日复查β-hCG 373 680 IU/L,子宫附件彩色超声示:宫内双胎妊娠可能,其一如孕约10+周,可见胎心搏动;其二发育异常,宫腔见一混合回声团,大小约84 mm×54 mm,呈蜂窝状,考虑葡萄胎?稽留流产后改变?见图1。告知患者不排除宫内妊娠合并葡萄胎可能,继续安胎治疗可能出现的风险,患者及家属强烈要求继续安胎治疗。2019年1月1日复查β-hCG 443 197 IU/L,再次与患者及家属充分沟通病情后,患者要求终止妊娠。于2019年1月2日行彩色超声引导下清宫手术,超声下见:宫腔内探及孕囊样回声,内见胚胎,其旁见不规则液性暗区及多发小囊状无回声,如蜂窝状。术中吸出宫腔内组织物共约150 g,标本肉眼可见葡萄样水泡组织,大小不一,混有血块及蜕膜组织碎片,并见完整胎儿肢体及绒毛组织,见图2。术中诊断:双胎妊娠(其中一胎为葡萄胎)。术后予静滴缩宫素止血,头孢美唑钠预防感染,配合中药内服促进恶露排出。术后病理结果回报:滋养叶细胞增生活跃,符合部分性葡萄胎(partial hydatidiform mole,PHM)改变。术后流产组织染色体检查结果回报:46,XY未见染色体非整倍体异常。术后第一天(2019年1月3日)复查βhCG迅速下降至173 930 IU/L(患者β-hCG数值变化见图3);Hb 91 g/L;胸片、血浆D-二聚体等未见明显异常。1月9日复查β-hCG 6 901 IU/L;子宫附件彩色超声:子宫大小正常,宫腔积液,宫腔内见条状无回声暗区,大小约12 mm×3 mm。又于1月11日行第二次清宫,术中吸出组织物约5 g,术后病理示送检物为分泌期子宫内膜,平滑肌及纤维素性渗出物,未见绒毛。1月15日复查β-hCG1 290 IU/L;子宫附件彩色超声:子宫未见明显异常,双附件区未见明显占位性病变。与患者充分交代离院医嘱后,予办理带药出院,目前仍在随访中。

图1 2018年12月29日宫腔内可疑葡萄胎超声图像

图2 2019年1月2日B超监视下清宫后组织物
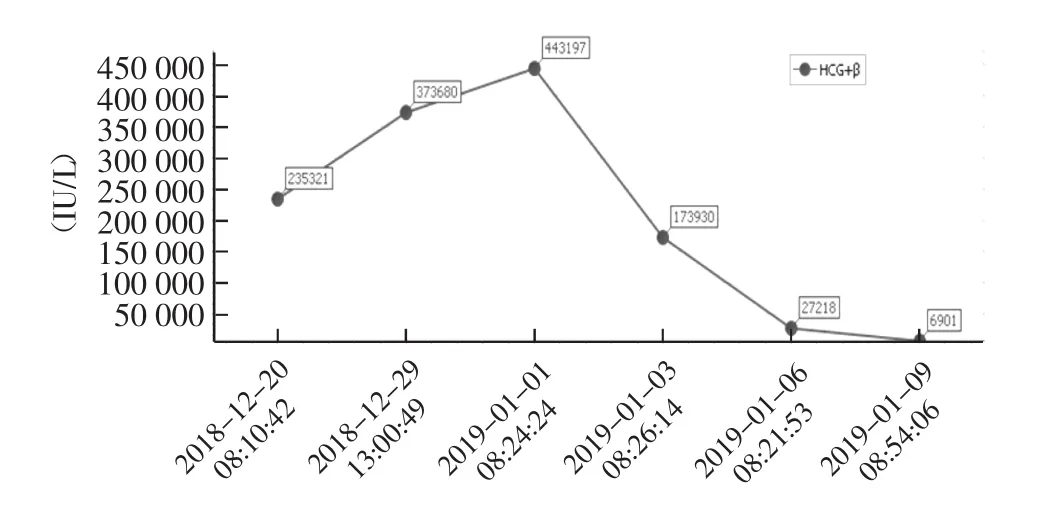
图3 患者β-hCG数值变化
2 讨论
2.1 ART与双胎妊娠合并葡萄胎 葡萄胎是一种良性的GTD,1978年有学者根据组织病理学和遗传学起源不同将其分为CHM和PHM。宫内妊娠合并葡萄胎极为罕见,发生率约百万分之0.5~1.0[1]。本案例病理结果提示PHM,但结合流产组织的染色体核型分析,考虑为双胎之一CHM,即CHM与正常胎儿共存(complete hydatidiform mole and coexistent fetus,CHMCF),发生率占妊娠的1/100 000~1/22 000[2]。近年来,随着二胎政策的放开和ART的不断发展,多胎妊娠率大大上升,合并葡萄胎的发生率也随之上升。
从葡萄胎发生的细胞遗传学分析,受精异常是该病发生的根本原因。除外极少见因基因突变引起的双亲来源性CHM[3],CHM的细胞核中仅含有父源性的雄性基因组,染色体核型为二倍体。其中90%为46,XX,由一个细胞核缺如或失活的空卵与一个单倍体精子(23,X)受精,经自身复制为2倍体(46,XX)。另有10%核型为46,XY,由一个空卵分别和两个单倍体精子(23,X和23,Y)同时受精而成。PHM的染色体核型90%以上为三倍体,合并存在的胎儿也为三倍体,由二倍父源、单倍母源的三倍基因组组成。最常见的核型是69,XXY,其余为69,XXX或69,XYY,由一看似正常的单倍体卵子和两个单倍体精子受精,或由一单倍体卵子和一个减数分裂缺陷的双倍体精子受精而成。四倍体部分性葡萄胎常常含有三个单倍体父源性基因组,核型为92,XXXX、92,XXYY或92,XXXY。由此可见,异常受精与卵子异常和精子缺陷密切相关。在应用促排卵药物的过程中,卵巢过度排卵,多个卵细胞一次性排出,容易致使不成熟卵细胞生成,甚至空卵。Piura等[4]报道的31例CHMCF中,有9例患者曾给予了绝经期促性腺激素(HMG)或hCG或氯米酚诱导排卵,这与Wax等[5]得出的大多数CHMCF发生于氯米芬或HMG和β-hCG治疗后的结论相符。故目前认为,诱导排卵药物(如HMG,hCG)增加了空卵的发生率,是导致CHM发生的危险因素。另外还有学者指出,ART中胚胎长时间的体外培养、培养基注入子宫的高压力和大体积、胚胎移植时患者的位置向下倾斜、卵母细胞质量和父母亲双方的年龄等都可能影响完全性葡萄胎的发生[6]。早期的一项数据更是让人触目惊心,Kahraman等[7]指出看似正常的植入前胚胎超过40%存在染色体异常。故目前在辅助生殖领域,胚胎植入前遗传学诊断(preimplantation genetic diagnosis,PGD)和胞浆内单精子显微注射(intracytoplasmic sperm injection,ICSI)显得愈发重要,是预防葡萄胎发生的关键。
2.2 双胎之一CHM的诊断与鉴别诊断 宫内妊娠合并葡萄胎的诊断多依赖B超,但早期诊断较为困难。在早期,超声难以看到葡萄胎典型的“落雪征”或“蜂窝状”表现,而只表现为囊性外观胎盘或变形孕囊等[8]。本例患者的早期超声表现类似宫内血肿声像,容易引起误诊和漏诊,故当出现停经后阴道不规则出血、子宫异常增大(大于停经月份)、妊娠剧吐、卵巢黄素化囊肿、血hCG数值异常升高(>10万IU/L)等临床表现时,要考虑葡萄胎的可能,加强血β-hCG和B超监测,必要时行磁共振成像(MRI)等其他辅助检查协助诊断。
2.2.1 双胎之一CHM与PHM的鉴别 宫内妊娠合并葡萄胎的诊断一经确立,首要任务即是明确合并CHM还是PHM,因为二者在临床处理及预后上完全不同。在超声上,PHM由于染色数目异常,常常显示三倍体胎儿的特征,可表现为胎儿结构畸形和(或)生长受限,且葡萄胎声像尚不典型,与正常部分的胎盘无分界,可分散存在一些无回声区[9];而CHM胎儿、胎盘结构正常,葡萄胎声像典型,与胎盘界限清晰。张爱青等[9]通过回顾文献与临床结局对照还指出,若在妊娠早期通过超声探查到双活胎,即可排除CHMCF的可能。由于葡萄胎早期超声诊断不甚明确,黎昕等[10]从MRI角度回顾分析了9例经病理诊断为CHM的影像学表现,发现早期葡萄胎具有相对特异的征象:宫腔内小片异常信号,T1WI呈等、稍高混杂信号,T2WI表现为以高信号为主的不均匀高、稍低信号,增强后宫腔内病灶呈轻度强化,部分病变区无强化。并且指出子宫内膜低信号基质带是否完整是影像学上区分良恶性滋养细胞肿瘤的重要鉴别点。病理检查对诊断也有一定参考意义,但由于病理特征有时并不典型,且诊断存在主观性,故不作为区分CHM和PHM的诊断标准,并需要只在母源染色体中表达的p57kip2印迹基因来帮助鉴别[11]。目前临床上产前诊断主要依靠染色体分析,通常利用X、Y和任一常染色体的着丝粒探针进行荧光原位杂交(FISH)技术来判断。此方法具有快速、简便、特异性强的优点,已代替传统的腹式B超引导下绒毛活检和羊膜腔穿刺的染色体核型分析[12]。
2.2.2 双胎之一CHM及双胎之一胚胎停育后绒毛水肿的鉴别 绒毛水肿同葡萄胎一样表现为大小不等的水泡状物,系胚胎早期死亡,绒毛膜上皮不能把从母血中吸收的水分运给胎儿利用而潴留于绒毛间质内所形成。虽可以通过病理检查滋养层细胞是否增生来明确诊断,但不满足临床诊断的需要。超声下,双胎之一胚胎停育后绒毛水肿时,妊娠早期可以见到两个胚胎,且可疑为“葡萄胎”的病灶不随孕周增加而增大[9]。近年来,为了提高诊断的准确性并进行分子分型,一项既可以确定倍体又能确定染色体双亲来源的短串联重复序列(short tandem repeat,STR)多态性分析,已经成为组织基因分型的最准确和最可靠的方法,解决了以往DNA流式细胞倍体分析、p57免疫组织化学检测等传统技术不能对二倍体水肿性流产(diploid hydropic abortion,HA)、部分性葡萄胎、三体、双雌单雄性三倍体等含母本等位基因成分的滋养细胞疾病进行鉴别的难题[6,13]。北京妇产医院利用STR分析196例组织形态学疑似葡萄胎样本的结果表明,该技术可有效避免非葡萄胎妊娠的过度诊断,为临床医师制定患者的治疗及随访方案提供了可靠保障[13]。
2.3 双胎之一葡萄胎的处理 双胎之一葡萄胎往往存在多种并发症,例如阴道出血、子痫前期、甲状腺功能亢进、滋养细胞肿瘤、胎膜早破等,不仅会使胎儿宫内窘迫、胎儿生长受限引起早产等,甚至可以导致胎儿宫内死亡及引发子宫破裂、滋养细胞栓塞等危急重症危及产妇生命。其中合并部分性葡萄胎者,因其胎儿染色体亦多为三倍体,常在妊娠早期流产或合并严重畸形、胎盘或羊水异常等,建议立即终止妊娠[14]。Kawasaki等[15]统计了18例双胎之一PHM的案例,活产率为22.2%。而早期对CHMCF的研究数据显示其活产率也仅为17%~28%[16]。故以往的学者认为双胎妊娠合并葡萄胎,不管是完全性还是部分性,均应及早终止妊娠。然而,Sebire等[17]通过分析77例CHMCF的临床资料,给出了大约40%的CHMCF最终成功分娩且并未比终止妊娠和单纯性葡萄胎的患者有更高的GTD风险的结论,这与2012年Aguilera等[18]对CHMCF的活产率研究结果一致。但最新的整理发现,与ART相关的CHMCF患者的活产率和GTD发生率分别为31.3%和53.3%[19]。故目前临床上对CHMCF的处理仍存在争议。随着医疗条件的不断进步和越来越多双胎甚至多胎妊娠合并葡萄胎者成功妊娠的病例被陆续报道,多数的临床医师倾向于对有强烈继续妊娠意愿的患者在严密监护下行保守治疗,包括医学观察、单纯葡萄胎清除术等。1例29岁女性借ART怀孕,诊断为三胎之一完全性葡萄胎,在严密监护下于孕37周成功分娩,且hCG在分娩后4周恢复到基线水平,随访的一年时间内并未发现进一步的并发症[20]。但是当孕妇出现阴道大出血、子痫前期、甲状腺危象等并发症,或葡萄胎体积持续增大、血β-hCG水平过高且持续上升等,均提示预后不良,应适时终止妊娠[21]。本例患者高龄,血β-hCG水平异常升高(>44万IU/L)且葡萄胎体积持续增大,故予B超监视下清宫终止妊娠处理。
总体而言,对于双胎妊娠合并葡萄胎的处理,个人认为要结合产前诊断;胎儿发育情况;母体并发症;hCG增长趋势;水泡样胎盘的变性速度;患者的妊娠意愿等方面综合考虑,原则上双胎之一PHM应及时终止妊娠,双胎之一CHM应制定个体化的诊疗方案。
