胚胎植入前遗传学检测技术的发展及临床应用
2019-07-18陈欢吴畏
陈欢,吴畏
无论是自然受孕还是体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET) 受孕,非整倍性染色体异常都是妊娠失败的主要原因。辅助生殖技术(assisted reproductive technology,ART)的有效性取决于移植胚胎的质量及种植潜能。植入前遗传学检测(preimplantation genetic testing,PGT)可筛选染色体正常的胚胎进行移植,增加种植率、降低流产率从而增加了IVF的有效性,在ART和临床优生学中占有重要的地位。近来对PGT后代的随访发现,PGT可能对胚胎发育造成影响,促使更多关于非侵入性植入前遗传筛查(noninvasive preimplantation genetic screening,NIPGS)的研究。本文综述PGT尤其NIPGS在ART中的应用及发展前景。
1 PGT技术的起源与发展现状及适用范围
1.1 PGT技术的起源与发展现状 传统产前诊断方法主要是通过绒毛活检、羊膜腔穿刺等方法取得胎儿相关样本,然后进行染色体核型分析。然而这些技术均为有创性,有流产风险。随着ART及测序技术的发展,PGT开始应用于临床。第一例成功的PGT由Handyside等[1]于1990年完成,该病例利用鉴定Y染色体的存在来减少生育母源性X连锁隐性疾病患儿的机会。此后遗传学家开始尝试使用单细胞聚合酶链反应(PCR)、荧光原位杂交(FISH)、微阵列比较基因组杂交(aCGH),单核苷酸多态性微阵列(SNP array)以及高通量测序技术(NGS)对来自极体、卵裂期胚胎的卵裂球、滋养外胚层细胞的遗传物质进行检测[2-4]。各活检时间优缺点比较见表1,目前用于PGT各种检测技术比较见表2。
1.2 PGT技术适用范围 目前PGT主要分为单基因异常检测(PGTfor monogenic,PGT-M)、染色体结构异常(PGTfor structural rearrangements,PGT-SR)和非整倍体筛查(PGTfor aneuploidies,PGT-A)三大类。PGT-M主要应用于检测单基因遗传病,目前文献报道进行PGT-M的单基因遗传病多达数百种。PGT-SR主要应用于检测染色体病,包括染色体数目或结构异常。PGT-A可应用与高龄、反复IVF种植失败以及反复妊娠丢失患者,选择染色体正常胚胎移植可以提高妊娠率,降低流产率。还可应用于人类白细胞抗原(HLA)分型、线粒体相关疾病以及携带有癌症等疾病易感基因的人群。对于妊娠中检测到的这些疾病,不同国家处理方式不同,如人工流产、宫内治疗或继续妊娠。PGT是产前诊断的最早形式,进行PGT可有效地避免因胎儿染色体异常等的选择性流产。
然而,即使染色体正常也不能确保成功妊娠。导致着床失败的其他因素包括线粒体拷贝变异与核DNA比例改变导致的胚胎应激状态[使用过的第3天的培养基中线粒体DNA(mtDNA)可作为胚泡潜能和植入结果的评估标志[8]]、新发缺失(dels)或重复(dups)、自身免疫因子紊乱、子宫内膜容受性降低、内分泌异常、解剖异常或其他未知因素等[9]。同时需向患者普及检测方法的相关知识及对检测结果给予指导,特别是对于嵌合胚胎根据染色体异常类型及嵌合比例给予相应的遗传咨询。

表1 各活检时间优缺点

表2 PGT检测技术比较
2 目前PGT技术存在的问题
2.1 检测样本的结果是否可以准确反映整个胚胎的遗传组成 利用aCGH行PGT诊断的准确度为95%~98%,SNParray行PGT准确度为96.5%~99.8%,NGS行PGT准确度为99.5%~100%[10]。各种检测方法检测结果不一致的原因有以下几个方面。①嵌合体胚胎:含有2种及以上不同染色体组成细胞系的胚胎被称为嵌合体胚胎,局部取材的偏差可导致错误的诊断。PGD国际协会(PGDIS)规定异常细胞占比20%~80%为嵌合体胚胎,目前PGDIS指南及多数研究认为在无整倍体胚胎移植情况下,可尝试移植嵌合体胚胎,且基于嵌合水平及特定染色体选择优先移植顺序,并且妊娠后需进行产前诊断[11]。②囊胚后期具有自我修复的能力:小鼠实验证实非整倍体胚胎具有自我修复能力[12],目前其机制的假说有正常细胞优势生长、异常细胞自我纠正和正常细胞向内细胞团聚集[13]。③等位基因脱扣(allele dropout,ADO):其发生机制可能包括DNA退化,导致DNA双链裂解不完全;PCR反应条件不完善,细胞裂解不完全;UPD等。这些问题的发生率与检测样本量大小相关,囊胚期样本量较卵裂期大,故囊胚期活检可显著降低ADO率,同时多重荧光PCR可有效解决ADO问题。④DNA污染:来源包括精子、颗粒细胞以及操作者的DNA等,可通过严格控制操作流程及采用胞浆内单精子注射(ICSI)受精方式减少污染。
2.2 活检本身对胚胎发育可能的影响 Kirkegaard
等[14]采用延时成像(time-lapse)观察对比活检和未活检的D3胚胎,发现活检后的囊胚细胞分裂融合至囊胚期的时间明显延长。近年研究数据表明,胚胎活检后可能降低胚胎发育潜力[15],动物研究显示胚胎活检对神经和肾上腺发育有负面影响[16-18];而对人PGT子代随访发现18月龄儿精细动作、姿势和肌张力等与对照组(未行PGT的ART子代)有轻微差别,2岁的幼儿较对照组有轻度神经系统异常[19-20]。
2.3 胚胎冷冻复苏的影响 诊断胚胎需冻存,约5%~10%的胚胎不能耐受冷冻及复苏过程[21]。
2.4 胚胎生物学方面相关因素 如线粒体拷贝数,研究表明其与卵母细胞质量和胚胎发育潜力有关,具有高水平mtDNA的胚胎非整倍性风险升高,可能与植入失败有关。
3 NIPGS的起源及发展
3.1 NIPGS的起源 最理想的PGT形式是获得代表整个待测胚胎遗传构成的活检材料,而不影响发育潜力。由于现有活检技术对胚胎发育的影响,人们一直在寻找无创及有效的胚胎检测方法。目前已经实现了胎儿非整倍性和单基因遗传病的非侵入性产前检测[22-23]。细胞凋亡似乎是胎儿DNA从胎盘释放到母体循环中的主要途径,而研究发现胚胎体外培养时,细胞凋亡和游离DNA的释放也有发生。NIPGS的理论基础为研究证明在囊胚腔液(blastocoelefluid,BF)或胚胎培养液(spent culture medium,SCM)发现的DNA很可能来源于生长胚胎中的凋亡细胞。使用DNA特异性荧光染料对滋养外胚层和内细胞团核进行差异标记,研究发现在囊胚扩张时检测到内细胞团中的细胞凋亡波。通过测序,BF中DNA片段的优势群体长度与源自凋亡胎盘滋养层细胞的游离DNA长度相似[23-26]。然而有部分学者提出这种DNA来源于胚胎丢弃的细胞作为非整倍性的校正机制[27],但是由于非整倍体胚胎与整倍体胚胎的培养基中游离DNA的数量并没有显着增加,因而排除了这一假设[28]。因此,胚胎释放的游离DNA可进行富集及遗传分析来诊断胚胎染色体非整倍体疾病,是目前唯一一种没有侵入性的胚胎遗传学诊断和分析技术。
3.2 NIPGS的临床研究 2013年,Stigliani等[29]在SCM中检测到胚胎mtDNA,发现其与胚胎碎片率相关。同年Palini等[30]在BF中发现可用于基因分析的DNA。2014年Gianaroli等[31]使用BF进行了PGT的初步研究。2015年Herrera等[32]在SCM中也发现了可用于基因分析的DNA,Wu等[33]报道了基于SCM的α地中海贫血胚胎相关基因检测,并与卵裂球扩增检测结果比较,证实了无创PGT的应用潜力。但NIPGS各研究游离DNA和胚胎遗传检测结果的一致性差异较大,见表3。
目前研究中SCM+BF组合样品的扩增效率和效用较好,将胚泡液释放到培养基中以增加DNA的浓度。有研究认为在玻璃化之前通过微针或激光脉冲人工收缩囊胚可以提高胚胎的存活率和临床效果[38,40]。
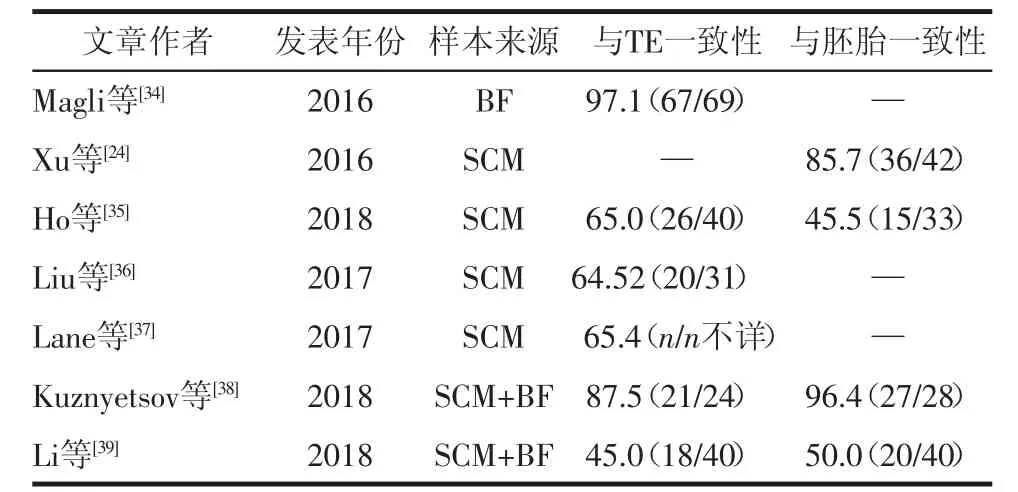
表3 各临床研究检测结果一致性比较 [%(n/n)]
3.3 NIPGS应用的优势及局限性 NIPGS的优势在于删除昂贵的显微操作活检程序并且避免了细胞移除相关的风险。并且除了BF其余都是胚胎冷冻保存的常规操作,防止晶体形成并提高冷冻保存后的胚胎存活率[41]。但其仍存在较多局限性:①胚胎DNA释放的机制仍未完全了解;②细胞凋亡是胚胎自我修复过程,理论上非整倍体细胞首先被淘汰,检测有假阳性可能;③培养液DNA污染:a.卵丘细胞引起的母体污染,在进行ICSI之前,要求去除所有卵丘细胞(母体来源并且通常具有正常的染色体组成),如果这种去除不完全,残留的细胞可能在胚胎发育过程中释放DNA,从而可能成为假阴性检测结果的原因,可通过仔细彻底地去除所有胚胎培养前的卵丘细胞,进一步减少假阴性率;b.精子附着在透明带上引起父源污染的风险,与PGT类似,建议与ICSI一起进行,确保去除附着在透明带上的任何额外精子;④胚胎嵌合现象可引起的检测结果假阳性:可以在第6天进行胚泡活检来验证假阳性[24];⑤利用SCM进行无创PGT-A需要胚胎单独培养取代常规的共培养,失去了共培养的优势,增加了费用。
4 结语与展望
目前测序成本已大幅下降,PGT技术已广泛应用于临床,但存在嵌合体的胚胎检测困难,并且PGT可能对胚胎发育及子代有影响。而NIPGS没有活检细胞,移除了对胚胎发育及子代可能的相关风险,是一项安全、极具潜力的技术,但其常规应用于临床实践仍然需要更多的研究和技术改进来完善。目前ART中评估和选择最佳胚胎主要基于胚胎形态学分级,希望在基因组学、转录组学、蛋白质组学、代谢组学和延时成像领域的进一步研究可以帮助选择最佳胚胎。
