40岁以上高龄女性体外受精-胚胎移植妊娠结局分析
2019-07-18夏梦董娟马龙吴春香蔡令波刘嘉茵
夏梦,董娟,马龙,吴春香,蔡令波,刘嘉茵
女性生育力与年龄密切相关[1]。随着女性年龄增加自然受孕能力开始下降,35岁女性1年内累积妊娠率约为70%,而40岁以上女性妊娠率急剧降低,平均每月妊娠率约为5%[2-3]。目前国内外学者关于女性高龄的定义尚无统一标准,国内大多文献支持将女性高龄定义在35~38岁以上,国外则定义为40岁以上[3]。由于辅助生殖技术(ART)的进步以及伦理和社会因素的变化,40岁以上寻求辅助生殖助孕的高龄女性急剧增多。欧洲人类生殖和胚胎学协会(ESHRE)数据显示,40岁以上女性对ART治疗的需求从2000年的10%~15%上升到2009年的20%~25%[4]。高龄妊娠是生殖医学最具挑战的领域之一。在实施体外受精-胚胎移植(IVF-ET)过程中,高龄女性卵巢储备功能减退,而促排卵方案也无法代偿这种下降趋势。40岁以上女性基础卵泡数急剧减少,卵子质量下降,影响胚胎发育潜能。子宫内膜一些器质性病变导致内膜容受性下降,不利于胚胎着床。这些均导致了高龄女性妊娠率下降和流产风险增高。
2007年Tsafrir等[5]对1 217例行IVF治疗的40岁以上女性研究显示,女性40岁以后成功率逐年下降,从40岁时的妊娠率和活产率分别为13.9%和9.1%,降至45岁时的2.8%和0.7%,且45岁以上女性无一例活产。如何安全有效地帮助高龄夫妇助孕,已成为当今ART治疗的棘手问题。本研究回顾性分析我院生殖中心40岁以上高龄女性运用自身卵子行IVF的2 467个治疗周期的卵巢内分泌功能指标评估、胚胎情况及妊娠结局,旨在为高龄女性提供及时的生育咨询与指导,以及为改善高龄女性个体化ART治疗结局提供临床依据。
1 对象与方法
1.1 研究对象 从辅助生殖管理系统(CCRM)数据库调取我院生殖中心2015年1月—2017年12月完成的、女方年龄40岁以上且使用自身卵子行IVF的2 467个治疗周期,回顾性分析各项临床资料。纳入标准:女方年龄≥40岁;新鲜移植周期;排除供精、卵子捐赠、冻胚复苏移植周期及失访周期。
1.2 研究方法
1.2.1 促排卵方案 根据患者卵巢储备功能及基础疾病情况,采用拮抗剂方案、微刺激方案或自然周期方案。对于卵巢功能减退患者、反复失败或年龄>42岁患者建议采用微刺激和自然周期方案。①拮抗剂方案:于月经第3天开始促性腺激素(Gn)促排,以重组卵泡刺激素(r-FSH)100~225 U和(或)人绝经期促性腺激素(hMG)75 U启动。Gn应用4~5 d后经阴道B超监测卵泡和血清激素水平,在优势卵泡直径≥12~13mm时开始注射醋酸西曲瑞克(默克雪兰诺公司,德国)0.25 mg/d至人绒毛膜促性腺激素(hCG)日。②微刺激方案:于月经周期第3天开始每天口服氯米芬(法地兰,高特制药有限公司,塞浦路斯)50 mg,并隔日肌内注射hMG 75 U至hCG日,周期第8天行阴道B超监测卵泡生长情况。③自然周期方案:不使用任何药物,月经第7~9天开始行阴道B超检测卵泡生长情况,每隔1~2天重复B超检查。当有优势卵泡直径>12 mm时,每天进行阴道B超检查及抽血检测激素水平。
1.2.2 诱导排卵时间 经阴道B超和激素水平监测卵泡发育,当至少2个卵泡直径≥18 mm时注射重组hCG(艾泽,默克雪兰诺公司,德国)6 500 U扳机。若为微刺激方案或自然周期方案,当优势卵泡直径>16 mm,hCG日平均每个优势卵泡血清雌二醇(E2)约为1 100 pmol/L(即300 pg/mL)时,注射促性腺激素释放激素激动剂(GnRHa,曲普瑞林,博福-益普生制药有限公司,法国)0.1~0.2 mg诱导排卵。
1.2.3 胚胎培养和移植 扳机后36 h经阴道B超监测下取卵,根据患者临床情况和既往治疗结果采用IVF或卵胞浆内单精子注射(ICSI)授精。ICSI适应证为:严重的少、弱、畸精子症,不可逆的梗阻性无精子症,生精功能障碍(排除遗传缺陷疾病所致),体外受精失败,精子顶体异常及需行植入前胚胎遗传学诊断(PGD)的病例。在受精后第3天根据胚胎评分和患者子宫内膜情况挑选1~2枚胚胎移植(Ⅲ级以上可移植胚胎),移植后常规黄体支持。我院生殖中心建议单胚胎移植的适用人群为:身材矮小(身高≤155 cm或体质量<45 kg)、子宫畸形(单角子宫、双角子宫、子宫纵隔)、子宫手术史(既往剖宫产史、子宫肌瘤剥除史)、子宫颈机能不全(包括子宫颈成形术后、子宫颈部分切除术后)、计划生育二胎、既往产科并发症(如妊娠期高血压疾病等)或合并症(如慢性高血压、糖尿病等)。若患者存在卵巢过度刺激风险、子宫内膜过薄、hCG日孕酮≥8 nmol/L或其他不适宜移植胚胎的情况(如发热、腹腔内出血等),则建议全胚冷冻。移植后剩余胚胎经患者知情同意后冷冻或行囊胚培养,第5~6天将发育成囊胚的胚胎进行冷冻保存。有冷冻胚胎或囊胚者待择期复苏周期冻胚移植。
1.3 胚胎发育评分 卵裂期胚胎评分标准(400倍镜下观察):(一级)胚胎发育速度正常,卵裂球均匀、数目均等,细胞质均一,无空泡,碎片不超过5%;(二级)胚胎发育速度正常,卵裂球均匀或大致均匀、数目均等或大致均等,细胞质均一,无空泡,碎片5%~10%之间;(三级)胚胎发育速度大致正常,卵裂球不均匀/均匀、数目不均等/均等,细胞质中有少量空泡,少于15%碎片;(四级)胚胎发育速度异常,卵裂球不均匀、数目不均等,细胞质不均一,有大量空泡,10%~50%碎片。一级和二级胚胎为优质胚胎,一、二、三级胚胎为可移植胚胎。
1.4 妊娠结局的判断 移植后14 d检测血清β-hCG,若为阳性则于移植后4~6周行B超检查,超声下见宫内孕囊及胎心搏动判定为临床妊娠。临床妊娠者黄体支持至移植后8周。妊娠12周内胚胎停止发育或妊娠物排出定义为早期流产。孕满28周且至少有1个存活新生儿分娩定义为活产。随访至胎儿出生,并记录妊娠患者分娩情况及胎儿情况。
1.5 统计学方法 采用SPSS22.0统计软件进行统计分析。正态分布的定量资料采用均数±标准差(x±s)表示,组间比较采用独立样本t检验;非正态分布数据用中位数(四分位数)[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验;定性资料采用百分率(%)表示,组间比较采用χ2检验。所有检验均以P<0.05为有统计学意义。
2 结果
2.1 各年龄段患者基本临床资料分析 本中心40~48岁女性实施自身卵子体外受精治疗共2 467个周期,基本临床资料见表1。各年龄段患者体质量指数(BMI)和基础FSH比较差异均无统计学意义(P>0.05)。但与40~44岁相比,47岁及48岁患者不孕年限逐渐增加(P<0.05);46岁及以上患者抗苗勒管激素(AMH)水平显著降低(P<0.05),48岁患者AMH水平仅为0.33 ng/mL。
2.2 高龄患者不孕因素分析 对40岁以上高龄患者不孕原因进行分析结果显示,首要不孕原因为卵巢功能减退(37.58%)。根据欧洲人类辅助生殖协会博洛尼亚标准(Bologna Criteria),卵巢功能减退的国际标准为:窦卵泡数(AFC)<5~7枚,或AMH<0.5~1.1 ng/mL,既往常规促排卵卵巢低反应(≤3枚卵子)。3条满足2条即为卵巢功能减退。不孕原因其次为盆腔和输卵管因素(32.67%),以及不明原因性不孕(14.80%)。见表2。
2.3 各年龄段患者周期结局及取消周期原因分析 2 467个周期中,取消1 055个周期(42.76%),全胚冷冻840个周期(34.05%),移植518个周期(21.00%)和PGD 54个周期(2.19%)。各年龄段患者取消周期比例趋势分析显示,与40~42岁组相比,除46岁组外,43岁及以上患者的周期取消率更高(P<0.05),尤其47岁和48岁患者超过50%的周期无法完成。见图1。进一步对1 055个取消周期因素分析显示,最主要的原因是未取卵(18.86%)、囊胚培养未形成(18.48%)、未获卵(14.60%)及无可移植胚胎(12.80%)。见图2。
2.4 各年龄段女性获卵数及胚胎情况比较 排除未取卵、未获卵及未行授精周期,对共2 024个周期获得卵子并实施体外受精的女性胚胎培养情况进行分析结果显示,与40~43岁组相比,44岁以上女性获卵数显著减少(P<0.05)。40~48岁女性体外受精培养胚胎情况分析结果显示,正常受精率、可移植胚胎率和优质胚胎率差异无统计学意义;但与40~43岁相比,44岁以上女性囊胚形成率随年龄增加显著降低(P<0.05)。见表3。
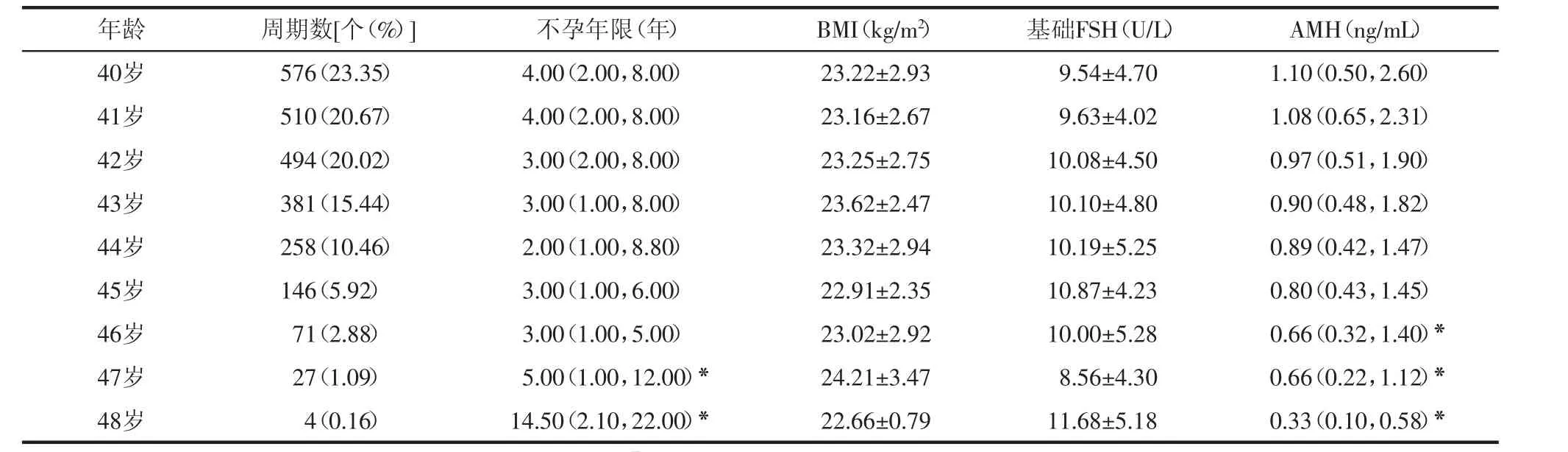
表1 各年龄段患者基本临床资料比较 (N=2 467)

表2 高龄患者不孕因素分析
2.5 各年龄段患者妊娠结局比较 2 024个取卵周期中518个周期行新鲜胚胎移植,平均移植胚胎数为(1.14±0.34)枚,移植周期临床妊娠率为19.5%,种植率为16.41%,活产率为10.42%,流产率为46.53%,仅有1例异位妊娠,2例活产双胎。各年龄段患者移植胚胎数比较差异无统计学意义(P>0.05)。40~48岁女性ART妊娠结局分析结果显示,与40~42岁相比,43岁以上女性临床妊娠率、胚胎种植率及活产率显著降低(组间比较均P<0.05),46岁17个移植周期仅1个周期妊娠并分娩,47岁和48岁患者均未成功妊娠。同时44岁和45岁流产率显著上升(P<0.05)。见表4。
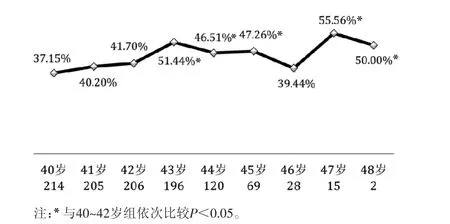
图1 各年龄段患者取消周期比例比较
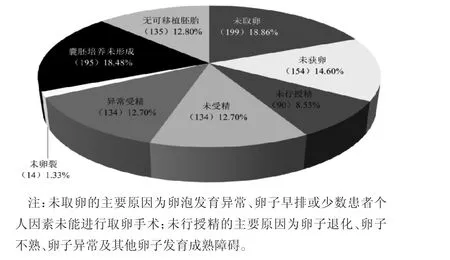
图2 高龄患者取消周期原因分析
2.6 血清AMH水平对妊娠结局的影响 视AMH水平为独立变量分析其对妊娠结局的影响,518个新鲜胚胎移植周期结果显示,与AMH>1.0 ng/mL组相比,AMH≤1.0 ng/mL组妊娠率、种植率及活产率均显著下降(P<0.05),流产率明显升高(P<0.05);同时获卵数显著减少(P<0.05),AMH≤1.0 ng/mL组平均获卵数目仅约为AMH>1.0 ng/mL组的一半,因此认为血清AMH水平与IVF-ET治疗中的实际获卵数密切相关。见表5。
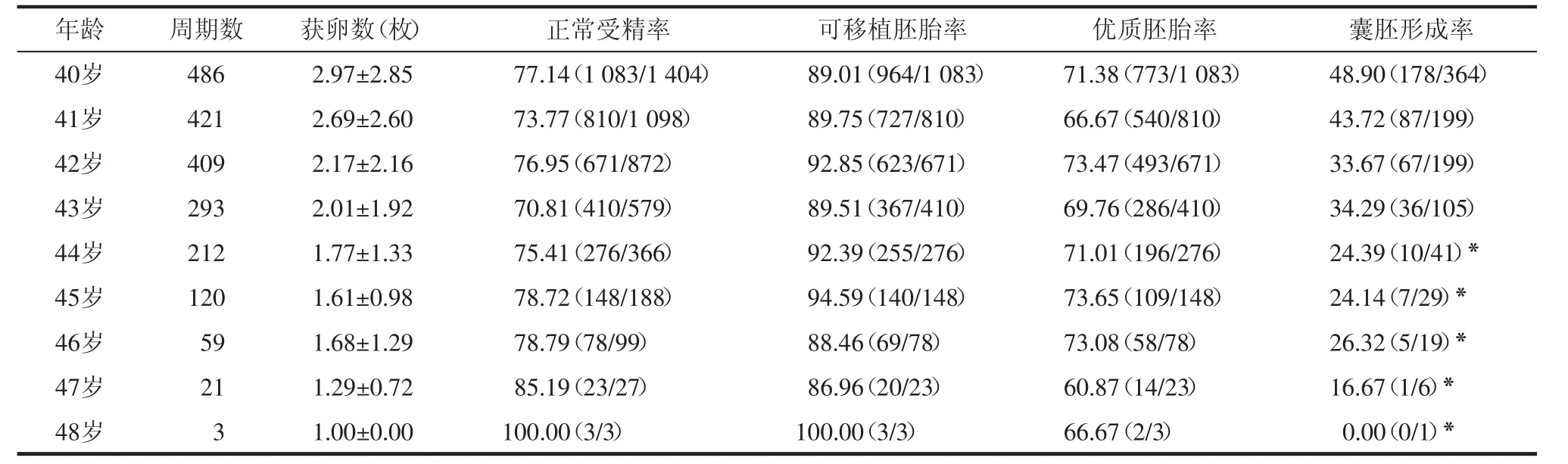
表3 各年龄段患者获卵数及胚胎情况比较 (N=2 024)

表4 各年龄段患者妊娠结局比较 (N=518)
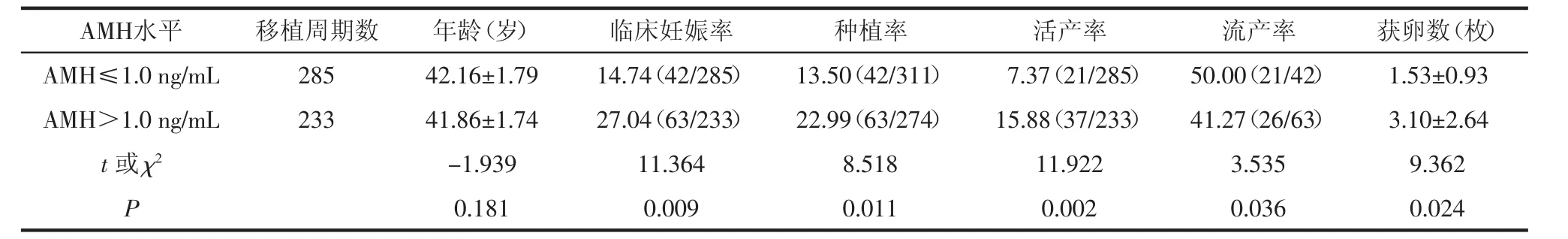
表5 AMH水平对妊娠结局的影响 (N=518)
3 讨论
本研究通过对2015—2017年40~48岁女性使用自身卵子行ART助孕的2 467个治疗周期结局进行分析,结果证实,卵巢功能减退是40岁以上高龄女性不孕的首要因素(37.58%)。高龄女性获卵数明显减少,尤其是44岁以上女性胚胎发育潜能显著降低。43岁以上女性临床妊娠率、胚胎种植率及活产率显著降低,而流产率增高。最高妊娠年龄为46岁,且仅有1例妊娠并分娩,47岁和48岁均未妊娠。
3.1 高龄女性不同年龄ART助孕结局分析 美国2014年女性健康数据报道,在过去10年中,由于职业女性推迟生育以及重组家庭夫妇妊娠的渴望,40岁以上女性寻求辅助生殖治疗的人数一直在稳步增加[6],国内情况亦相似。年龄是女性生育力最重要的影响因素,然而相比年轻女性,40岁以上女性的生育力每年急剧衰减[7],面对高龄女性选择试管助孕,一直以来有个问题困惑着广大生殖学者:多大年龄借助ART受孕是合理的年龄上限?目前尚缺乏统一标准。
2007年Spandorfer等[8]报道45~48岁以上女性平均每取卵周期妊娠率为21.1%,流产率高达72.2%,累积活产率仅为2.2%。46岁和47岁女性妊娠率分别为17%和9%,但均未获得活产。2009年Hourvitz等[9]对459例42~47岁女性研究显示,平均临床妊娠率为5.3%,从42岁妊娠率7.7%直线下降,45岁以上没有成功妊娠,44岁5名女性妊娠中仅有1名活产婴儿。虽然生殖医学工作者们持续努力改善高龄女性IVF-ET的妊娠结局,但应该明确认识到女性达一定年龄后这种成功率的下降是无法避免的。Klipstein等[10]报道1 263例40~48岁女性2 705个治疗周期中,平均活产率为9.7%,累积活产率从40岁开始为28.4%,43岁急剧下降为9.6%,44岁下降到1.6%,46岁为0%。本研究数据显示,各年龄段女性移植胚胎数没有差异的情况下,40岁女性临床妊娠率为26.92%,44岁下降到18.87%,46岁显著下降为5.88%,47岁为0%;40岁女性种植率为23.65%,44岁急剧下降为7.49%,46岁下降到5.56%,47岁为0%;40岁女性活产率为18.46%,44岁急剧下降为5.66%,45岁下降到2.78%,46岁仅有1例分娩,47岁没有活产婴儿;同时40岁女性流产率为31.43%,44岁明显上升为70%,45岁上升到75%。因此认为,为40~43岁女性提供最后一次妊娠机会是合理的,但44岁以上女性实施ART助孕应慎重。
3.2 高龄女性不孕及影响助孕结局最重要的原因是卵巢功能减退 女性的不明原因不孕,年龄是根本因素。Somigliana等[11]研究发现,40~45岁女性不明原因性不孕的发生率是20~29岁女性的2倍以上。而高龄女性与年轻女性相比,数据所呈现的差异却仅表现在卵巢功能减退方面(56%vs.30%),提示40岁以上女性不明原因性不孕可能主要是由于卵巢功能变化所导致的。本研究结果显示,40岁以上高龄女性首要不孕原因为卵巢功能减退(37.58%),而不明原因性不孕比例为14.80%。因此,由于卵巢功能潜在的衰退,高龄女性卵巢功能减退所导致的不孕现象可能比本研究数据显示的37.58%这一比例更高。
高龄女性卵巢功能逐渐衰退,具体表现为卵巢储备功能下降和卵母细胞质量下降[7,12]。卵巢储备功能降低,卵巢中可募集卵泡数目急剧减少从而影响生育潜能,导致生育力降低[13-14]。本研究显示,相较40岁以上女性平均不孕年限为5.49年,47岁女性不孕年限为7.26年,48岁增加到12.88年。取消周期的最主要原因是未行取卵手术(199个周期,18.86%),主要是由于激素水平的突发紊乱导致卵子早排或卵泡停止发育。在获卵数方面,因未获卵而无法继续治疗的为154个周期(14.60%),是取消周期的主要原因之一。已取到卵子实施IVF-ET周期中,获卵数随年龄增加而减少,40~43岁女性平均获卵数可达2枚以上,44岁以上获卵数明显减少为1.77枚,47岁和48岁平均每位患者最多仅能取到1枚成熟卵子。
2006年美国疾病预防与控制中心(Centers for Disease Control and Prevention,CDC)报告显示,在接受来自于<35岁年轻女性赠卵的ART治疗周期中,无论受者年龄如何,平均活产率可达55%,<35岁受者活产率为54.4%,>42岁为53.2%[15]。因此女性生育力一方面受到年龄影响,同时还主要受到卵母细胞质量下降的影响。高龄女性卵母细胞的功能丧失主要表现在不能阻止多精入卵、早期卵裂失败、不能维持母源性基因表达过渡到胚胎基因表达,以及早期胚胎着床失败[16-17]。高龄卵子线粒体包绕的平滑内质网面积增加、空泡增多、线粒体DNA数量减少和片段缺失等,这些异常形态认为是卵母细胞退化的征象[18]。本研究中2 024例高龄女性胚胎培养形态学观察显示42岁以上女性的卵母细胞胞浆粗糙更明显。在本研究结果中表现为,主要由于卵子不成熟、卵子退化及卵子异常所导致的未行授精而取消周期(90个周期,8.53%)。40~48岁女性ART胚胎情况分析显示,正常受精率、可移植胚胎率和第3天卵裂期优质胚胎率无明显差异,虽然卵裂期胚胎在形态学上无法辨别优劣之分,但44岁以上女性囊胚形成率随年龄增加而明显降低这一现象证实了高龄女性胚胎发育潜能是显著降低的。40岁女性囊胚形成率为48.90%,44岁急剧下降到24.39%,47岁仅为16.67%,48岁没有囊胚形成。囊胚培养未形成(195个周期,18.48%)及无可移植胚胎(135个周期,12.80%)是导致取消周期的另一类主要因素。此外形态学显示,与42岁之前囊胚比较,45岁以上女性囊胚的内细胞团和滋养层细胞数明显减少,即囊胚质量显著降低。但我们的形态学观察计量数据还不够充分,后期还将继续进一步行统计分析。
3.3 高龄女性血清AMH水平预测助孕结局的价值 2010年ESHRE定义了卵巢反应不良的标准,其中一条标准,血清AMH水平<0.5~1.1 ng/mL认为是诊断卵巢储备功能减退条件之一[19]。Tokura等[20]研究表明,血清AMH水平直接反应高龄女性IVF-ET治疗中获卵水平,AMH为1.0 ng/mL认为是卵巢反应不良的临界值。ROC曲线分析显示<3枚获卵数的女性AMH<1.0 ng/mL,与≤1.0 ng/mL组比,>1.0 ng/mL组妊娠率更高(36.8%vs.16.7%),且随着AMH升高,妊娠组平均获卵数也显著增加(5.4枚vs.3.4枚)。本研究结果显示,与AMH>1.0 ng/mL组相比,AMH≤1.0 ng/mL组妊娠率、种植率及活产率均显著下降,流产率明显升高,同时获卵数显著减少(均P<0.05)。该数据证实高龄女性血清AMH水平是评估卵巢功能的有力指标,且AMH能够预测ART治疗中实际获卵水平。根据ESHRE标准AMH约为1.0 ng/mL作为临界值时获卵数约为3枚,与文献获得类似结论。
综上,通过回顾性分析我中心40岁以上高龄女性运用自身卵子行体外受精的2 467个治疗周期的胚胎情况、妊娠结局及卵巢功能评估指标,结果表明,卵巢功能减退是40岁以上高龄女性不孕的首要因素。女性生育力随年龄逐渐降低,尤其是44岁以上女性胚胎发育潜能显著降低。最高妊娠年龄为46岁且仅有1例妊娠活产,没有更高年龄的妊娠分娩。
本研究结果所呈现的相关数据希望能够为期待尝试ART治疗的高龄女性提供一些帮助,但临床医生和患者必须面对的一个问题是:使用自身卵子行辅助生育治疗的年龄上限是多少?根据我们研究结果,40~43岁年龄段女性ART助孕仍有一定的价值,尤其是卵巢仍有一定储备者(AMH>1.0 ng/mL)。44岁以上女性原则上不再建议ART助孕,但对于极少数卵巢储备功能提示较好的44~45岁女性,可在知情同意极低成功率和妊娠风险的情况下实施ART助孕。对于46岁以上卵巢功能衰竭的女性强烈建议卵子捐赠或收养。我们应尊重高龄女性的生育权,帮助高龄患者权宜生殖伦理、生育风险的平衡,尤其平衡母亲利益和孩子日后的幸福。选择个体化助孕方式,竭力在她们丧失生育力之前获得满意的妊娠结局。
