转染bFGF基因的BMSCs移植对急性心肌梗死大鼠再灌注损伤的影响及机制探讨
2019-07-18王倩任琳张鹏宇李芳杨桂凤
王倩,任琳,张鹏宇,李芳,杨桂凤
急性心肌梗死(AMI)是造成心力衰竭的重要病因,AMI可导致心肌细胞产生不可逆损伤,且心肌细胞较难有效自我增殖和修复[1]。目前,AMI主要治疗手段包括药物干预、冠状动脉(冠脉)旁路移植术、经皮冠状动脉介入治疗(PCI)均可恢复缺血后再灌注,但仍不能有效修复已受损心肌细胞,正常心功能较难恢复[2]。因此,亟需寻找有效治疗方法,以减轻AMI再灌注损伤、改善心功能。近年来,随着生物工程技术的不断发展,干细胞移植技术逐渐得到关注和重视。骨髓间充质干细胞(BMSCs)具有多向分化潜能,通过应用诱导剂使其分化为心肌细胞,治疗AMI再灌注后所致心功能不全,但其效果仍存在争议[3]。碱性成纤维细胞生长因子(bFGF)在多种细胞增殖、分化中起重要作用,且与心肌细胞受损后修复关系紧密[4]。因此,本研究将PBR322-bFGF质粒转染至BMSCs中,观察转染bFGF基因的BMSCs移植对AMI再灌注后心功能、炎症反应及心肌细胞凋亡的影响,为临床中利用干细胞移植治疗AMI再灌注损伤奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级雄性SD大鼠,48只,4周龄,体质量90~110 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0001,小鼠均自由摄食(普通饲料)、饮水,饲养于(24±1)℃,60%恒湿、12 h/12 h明暗循环条件下。
1.1.2 主要试剂和仪器质粒PBR322-bFGF(军事医学科学院)、低糖DMEM培养基(GIBCO公司)、胎牛血清(Hyclone公司),大鼠肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-10(IL-10)酶联免疫吸附试验试剂盒(R&D公司),逆转录试剂盒(Takara公司),BCA蛋白定量分析试剂盒(Thermo公司),小鼠抗大鼠CD90、CD105、CD34、CD45单抗(Biolegend公司),兔抗大鼠bFGF多抗,MM-9单抗、TIMP-1多抗(Santa Cruz),HRP标记的羊抗兔IgG抗体(Sigma);DH-150动物呼吸机(浙大医学仪器厂),ECG-6511型心电图仪(上海光电医用电子仪器有限公司),DSX100光学显微镜(奥林巴斯公司),RM2245徕卡切片机(Leica公司),3550UV酶标仪、7500实时荧光定量PCR仪、PE2400电泳仪、CheniDoc XRS化学发光成像分析系统(Bio-rad公司)。
1.2 方法
1.2.1 BMSCs体外分离及培养大鼠引颈处死后,无菌条件取股骨及胫骨,去除两端干骺端,用低糖DMEM培养基反复冲洗骨髓腔,1000 rpm离心5 min后弃去上清,DMEM重悬后加入淋巴细胞分离液,采用密度梯度离心法获取纯化细胞,接种至DMEM培养基(含10%胎牛血清)、37℃、5%CO2、饱和湿度下培养,取第3代BMSCs细胞,消化后调整细胞密度至1×106个/ml,接种于含有盖玻片的细胞培养板中,倒置显微镜观察细胞成单层生长时取出盖玻片,洗涤3次后与95%酒精中固定15 min,洗涤后3%过氧化氢服用10 min,加入蛋白阻断剂室温封闭10 min,甩掉阻断剂后滴加鼠抗CD90、CD105、CD34、CD45抗体4℃摇床孵育过夜,加入FITC标记羊抗兔二抗避光孵育30 min,洗涤后晾干,甘油封片后置于纤维镜下观察,选择CD90+、CD105+,CD34-、CD45-即为骨髓BMSCs细胞。
1.2.2 质粒bFGF转染BMSCs采用lipofectamine 2000脂质体转染法,将纯化的bFGF质粒、脂质体及BMSCs细胞混匀后,置于37℃、5%CO2、饱和湿度条件下培养6 h,换液后继续培养36 h,将培养液换为含5 mg/L的Blasticidin培养基孵育过夜,之后每3~4 d换液1次(含5 mg/L的Blasticidin),经10~12 d筛选后,获得转染bFGF基因的BMSCs细胞(经实时荧光定量-聚合酶链反应法鉴定BMSCs转染bFGF成功)。进行移植前,加入50 mg/L的BrdU同条件培养48 h进行标记。
1.2.3 急性心肌梗死(AMI)再灌注模型建立及分组干预取40只大鼠,其中30只用2.5%戊巴比妥钠麻醉后,四肢连接心电图检测仪,气管插管连接实验动物呼吸机给予正压通气,于左胸第4肋间开胸,乳突牵开器牵开肋骨,暴露心脏,6-0无创带针缝合针从左冠状动脉前降支穿过,进针深度约1.5 mm,在缝合线下放置直径为2.0 mm的聚乙烯管进行结扎,当心电图出现ST弓背向上型抬高提示AMI成功,100 min后剪短结扎线恢复血供,出现再灌注性心律失常,且结扎线以下动脉充盈并由搏动提示AMI再灌注造模成功[5],将造模成功大鼠按照随机数表法分为模型组、BMSCs组、BMSCs+bFGF组,模型组在梗死周边心外膜区用微量注射器分4点注射DMEM培养基,每点200 μl,BMSCs组同部位注射等量未转染BMSCs,BMSCs+bFGF组同部位注射等量转染bFGF的BMSCs。其余10只大鼠同前手术操作步骤,仅穿线不结扎持续100 min,设为假手术组,在心脏同位置分点注射培养基。术后逐层缝合切口,呼吸平稳后拔出气管插管,常规给予抗生素预防感染。操作过程中死亡大鼠采用同期饲养大鼠补入。
1.2.4 心功能检测术后4周,异氟烷麻醉大鼠,采用多普勒超声仪进行心脏超声检查,记录各组大鼠左心室舒张末期内径(LVIDd)、收缩末期内径(LVIDs)、缩短分数(FS)、射血分数(EF)。所有检测值均取4个心动周期的平均值。
1.2.5 血清TNF-α、IL-1β、IL-10水平检测术后4周,大鼠眼眶采血5 ml,3000 rpm离心10 min,取上层血清,采用酶联免疫吸附法(ELISA)检测各组大鼠血清TNF-α、IL-1β、IL-10含量,严格按照试剂盒说明书步骤操作,酶标仪检测450、460、462 nm处吸光度值,设570 nm为校正波长,根据标准曲线计算血清TNF-α、IL-1β、IL-10含量。
1.2.6 心肌组织病理学观察术后4周后,处死大鼠后立即开腹暴露心脏,取紧靠左心室前侧壁心肌组织,放入4%多聚甲醛固定24,常规酒精梯度脱水、石蜡包埋后,制作4 mm连续切片。切片经二甲苯脱蜡后、酒精梯度水化,采用常规苏木精-伊红染色法(HE)进行染色,中性树胶封片后观察心肌组织病理学变化。
1.2.7 心肌细胞凋亡指数(AI)检测术后4周处死大鼠,取心脏制作常规石蜡切片,切片常规脱蜡、水化后,滴加3%的过氧化氢孵育5 min,然后加入蛋白酶K于37℃孵育30 min,滴加pH6.0枸橼酸盐缓冲液进行高压修复1.5 min。严格按照TUNEL检测试剂盒说明书操作:每张切片滴加TUNEL反应液混合液25 μl,37℃避光孵育1 h,洗涤后,滴加DAB显色液100 μl室温孵育3 min,苏木精核染1 min、盐酸乙醇分化1~3 s、碳酸锂返蓝20 s,晾干后中性树脂封片,光镜下观察,每张切片随机选择5个视野拍照,用应用Image Pro Puls 6.0软件分析,计算AI=阳性细胞/细胞总数×100%。
1.2.8 bFGF、MMP-9、TIMP-1 mRNA相对表达量检测处死小鼠取心脏组织,加入液氮并研磨后,Trizol法提取组织中总RNA。用逆转录试剂盒将mRNA逆转录cDNA。产物经琼脂糖凝胶电泳法鉴定后,进行实时荧光定量PCR,严格按照试剂盒说明书设定反应体系:SYBR Premix Ex Taq 12.5 μl,10 μmol/L上下游引物各0.5 μl,cDNA 2 μl,ddH2O 9.5 μl;反应条件:95 ℃预变性2 min;94 ℃变性10 s,60 ℃退火30 s,72 ℃延伸60 s,重复40个循环。以β-actin为管家基因,2-△△CT为目的基因的相对表达强度,所有实验重复3次取Ct平均值。采用凝胶成像系统测定bFGF、MMP-9、TIMP-1 mRNA相对表达量。bFGF:上游引物:5'-GCTAGCTGATCGTAGTC GTACGT-3';下游引物:5'-CTATCGTACGTA GCTAGCTAGTCG-3';MMP-9:上游引物:5'-ATCGATCGATCTCGTATCTGTATC-3';下游引物:5'-CGTAGCTAGCTAGCTGTACGTAT-3';TIMP-1:上游引物:5'-CGTAGCTAGCTAGCTA TCGTACA-3';下游引物:5'-GTCAGTCGATG CTAGCTAGCTAG-3';β-actin:上游引物:5'-CTGACTAGTCGTACGTAGCTACA-3';下游引物:5'-CGTAGCTGATCGTATCGTAGCTC-3'。
1.2.9 bFGF、MMP-9、TIMP-1蛋白相对表达量检测取75 mg左右心肌组织,液氮中研磨后转至离心管,加入0.5 ml细胞裂解液,置于100℃水浴中10 min,离心后取上清液,二喹啉甲酸(BCA)法进行蛋白定量。取60 μg样品加入等体积上样缓冲液混匀后,100 ℃水浴加入3 min,12 000 rpm离心10 min取上清液,进行十二烷基硫酸钠聚丙烯酰氨凝胶电泳(SDS-PAGE)电泳分离,电转仪电转40 min,加入封闭液室温摇床2 h,加入封闭液稀释一抗(1:500),4 ℃摇床孵育过夜,加入封闭液稀释二抗(1:10000),常温孵育0.5 h,暗室中曝光、显影及定影。应用凝胶成像系统扫描并进行灰度值分析,以bFGF、MMP-9、TIMP-1蛋白灰度值与内参β-actin灰度值比值表示蛋白相对表达量。
1.3 观察指标①BMSCs细胞分离及鉴定结果;②心功能指标对比;③血清TNF-α、IL-1β、IL-10水平对比;④心肌组织病理学观察及AI对比;⑤ bFGF、MMP-9、TIMP-1 mRNA相对表达量、MMP-9/TIMP-1值对比;⑥bFGF、MMP-9、TIMP-1蛋白相对表达量、MMP-9/TIMP-1值对比。
1.4 统计学分析采用SPSS 17.0统计软件对数据分析处理,计量资料均采用均数±标准差(x±s)表示,心功能、血清炎性因子、AI、基因及蛋白的相对表达量多样本计量资料比较采用单因素方差分析,两两样本比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs细胞分离及鉴定结果原代BMSCs培养第3 d开始贴壁生长,呈多边形或纺锤形,传代培养至第3代时体积增大,呈长梭行,大小均一。免疫细胞荧光法鉴定BMSCs特征表型,CD90、CD105阳性表达率分别为96.03%、95.44%,CD34、CD45均呈阴性表达,符合BMSCs的典型特征表型(图1~2)。
图1 BMSCs分离培养形态学观察
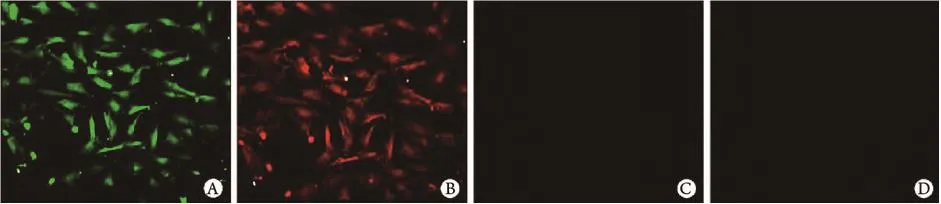
图2 BMSCs表面特征抗原鉴定(×200)(图A:CD90;图B:CD105;图C:CD34;图D:CD45)
2.2 心功能指标对比LVIDd、LVIDs组间比较,假手术组最低、BMSCs+bFGF组其次、BMSCs组稍高、模型组最高,每两组间比较差异均有统计学意义(P<0.05),EF、FS组间比较,假手术组最高、BMSCs+bFGF组其次、BMSCs组稍低、模型组最低,每两组间比较差异均有统计学意义(P<0.05)(表1)。
2.3 血清TNF-α、IL-1β、IL-10水平对比血清TNF-α、IL-1β水平组间比较,假手术组最低、BMSCs+bFGF组其次、BMSCs组稍高、模型组最高,每两组间比较差异均有统计学意义(P<0.05),IL-10组间比较,BMSCs+bFGF组最高、BMSCs组其次、模型组稍低、假手术组最低,每两组间比较差异均有统计学意义(P<0.05)(表2)。
2.4 心肌组织病理学观察及AI对比AI组间比较,假手术组最低、BMSCs+bFGF组其次、BMSCs组稍高、模型组最高,每两组间比较差异均有统计学意义(P<0.05)(表3、图3~4)。
2.5 bFGF、MMP-9、TIMP-1 mRNA相对表达量、MMP-9/TIMP-1值对比bFGF、TIMP-1
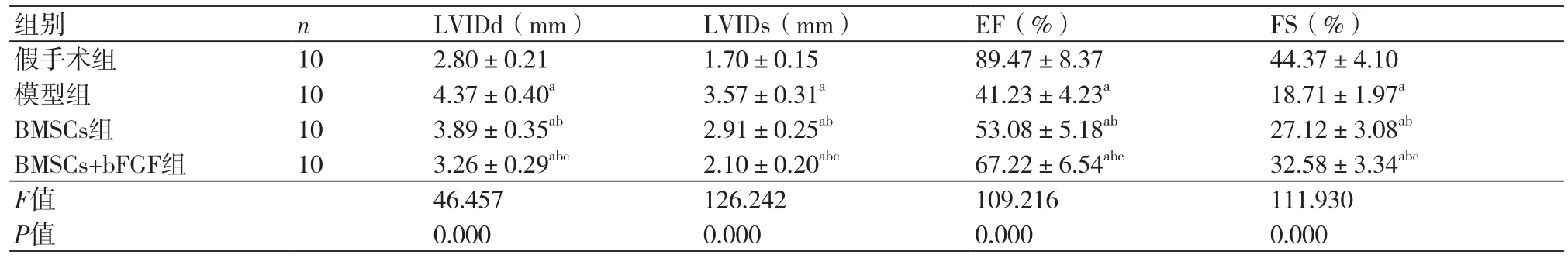
表1 心功能指标对比(x±s)
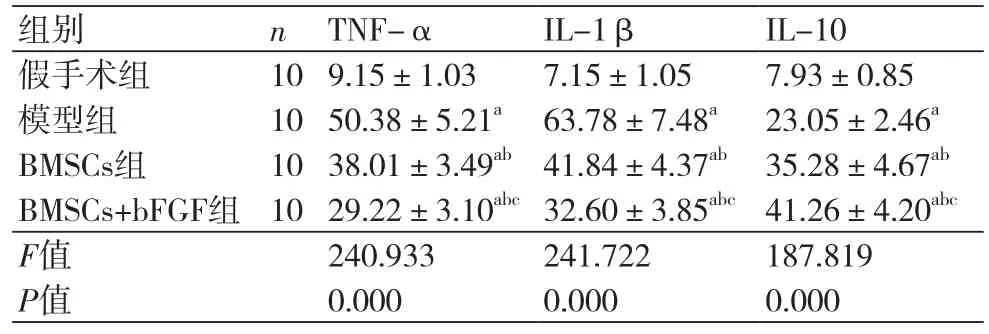
表2 血清TNF-α、IL-1β、IL-10水平对比(x ±s,pg/ml)

表3 AI对比(x±s)
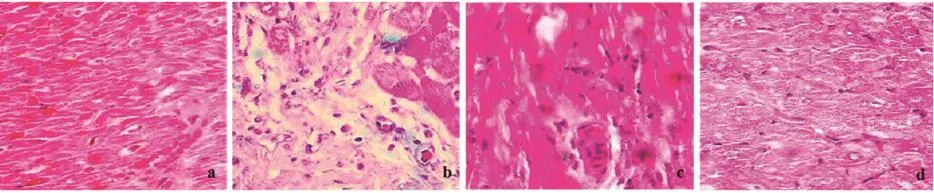
图3 心肌组织HE染色(×400)(a~d分别为假手术组、模型组、BMSCs组、BMSCs+bFGF组)
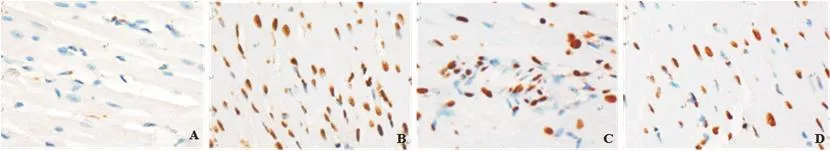
图4 心肌组织TUNEL染色(×400)(A~D分别为假手术组、模型组、BMSCs组、BMSCs+bFGF组)
mRNA相对表达量组间比较,BMSCs+bFGF组最高、BMSCs组其次、模型组稍低、假手术组最低,每两组间比较差异均有统计学意义(P<0.05);MMP-9 mRNA相对表达量、MMP-9/TIMP-1值组间比较,假手术组最低、BMSCs+bFGF组其次、BMSCs组稍高、模型组最高,每2组间比较差异均有统计学意义(P<0.05)(表4)。
2.6 bFGF、MMP-9、TIMP-1蛋白相对表达量、MMP-9/TIMP-1值对比bFGF、TIMP-1蛋白相对表达量组间比较,BMSCs+bFGF组最高、BMSCs组其次、模型组稍低、假手术组最低,每2组间比较差异均有统计学意义(P<0.05);MMP-9蛋白相对表达量、MMP-9/TIMP-1值组间比较,假手术组最低、BMSCs+bFGF组其次、BMSCs组稍高、模型组最高,每2组间比较差异均有统计学意义(P<0.05)。结果见图5~6。
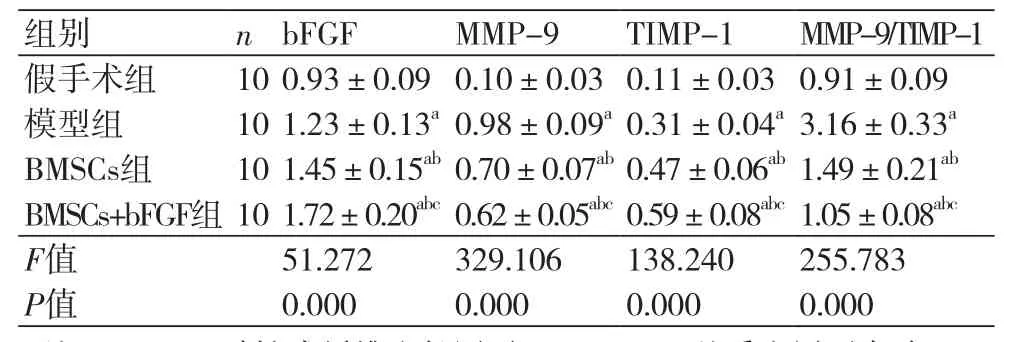
表4 bFGF、MMP-9、TIMP-1 mRNA相对表达量、MMP-9/TIMP-1值对比(x±s)
3 讨论
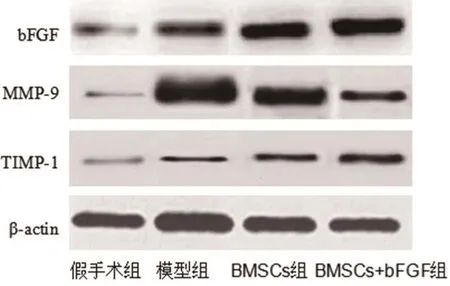
图5 蛋白免疫印迹图
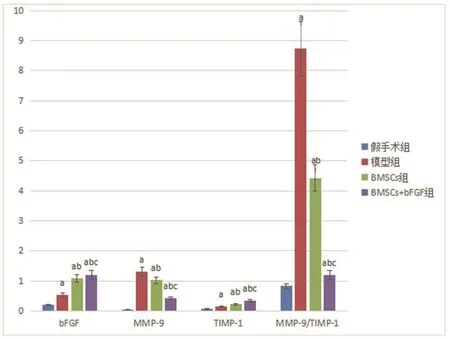
图6 bFGF、MMP-9、TIMP-1蛋白相对表达量、MMP-9/TIMP-1值对比
心肌细胞对缺血、缺氧及氧化应激等多种应激十分敏感,且心肌细胞的再生和自我修复能力差,AMI后再灌注时由于心肌细胞受到再灌注血流的应激,可再次诱发多种病理反应,最终可导致AMI后存活的部分细胞再次死亡[6,7]。因此,在对AMI后患者进行再灌注治疗时,应选用有效的预防性手段,减少心肌细胞凋亡,保护患者正常心功能,对患者预后意义重大。BMSCs来源于中胚层,具有遗传稳定、多向分化、免疫耐受及旁分泌等多种生物学活性,且BMSCs可自体取材,排异风险低,临床应用较易实现,在细胞移植治疗方面具有较大优势[8]。
本研究发现,免疫细胞荧光法鉴定BMSCs出现CD90、CD105阳性表达,CD34、CD45阴性表达的典型特征表型,提示成功分离获得BMSCs。LVIDd、LVIDs、TNF-α、IL-1β、AI比较,假手术组最低、BMSCs+bFGF组其次、BMSCs组稍高、模型组最高(P<0.05),FS、EF比较与上述结果相反(P<0.05);IL-10比较,BMSCs+bFGF组最高、BMSCs组其次、模型组稍低、假手术组最低(P<0.05),提示转染-bFGF质粒的BMSCs可显著改善AMI后再灌注大鼠的心功能、缓解炎症反应,并且可减少心肌细胞凋亡。研究证实[9],在心肌局部注射BMSCs后,处于局部心脏微环境的BMSCs可被诱导分化为心肌样细胞,其功能与机体原有心肌细胞相似,进而改善心功能。bFGF是一种有丝分裂原,可促进血管生成及创伤修复,应用转染bFGF基因的BMSCs,使心肌组织中分泌更多bFGF,有效改善心脏微环境,更利于干细胞定向分化,改善心功能[10]。bFGF可通过促进各种炎性细胞的粘附和趋化,调节炎症因子浸润部位,有效抑制AMI再灌注损伤产生的炎症反应,降低炎症因子TNF-α、IL-1β合成,增加IL-10的合成和分泌,缓解炎症反应[11]。动物实验研究表明[12],在大鼠AMI后给予bFGF,可显著减轻缺血再灌注损伤,可能是bFGF促进血管生成,血管密度增加可对抗氧化应激的缘由,进而减少心肌细胞凋亡和坏死。转染bFGF基因的BMSCs移植后,BMSCs与bFGF共同促进AMI再灌注后心功能恢复,并且可缓解缺血再灌注损伤。
M M P-9 m R N A和蛋白相对表达量、MMP-9/TIMP-1值组间比较,假手术组最低、BMSCs+bFGF组其次、BMSCs组稍高、模型组最高(P<0.05);bFGF、TIMP-1 mRNA和蛋白相对表达量组间比较,BMSCs+bFGF组最高、BMSCs组其次、模型组稍低、假手术组最低(P<0.05),提示转染-bFGF质粒的BMSCs对大鼠AMI再灌注损伤的保护作用可能与心肌组织bFGF水平上调、MMP-9/TIMP-1旁分泌机制有关。MMP-9属于锌离子依赖的内切蛋白水解酶家族重要成员之一,在心室重构中起关键作用[13]。TIMP-1是一种低分子量蛋白,含有N端和C端功能区,两端分别与MMP-9锌离子活性中心区及其他部位结合,形成非共价键复合物,阻断MMP-9与其相应底物结合,抑制细胞外基质降解[14]。生理状况下,MMP-9与TIMP-1间处于动态平衡状态,共同维持细胞外基质平衡,AMI再灌注时产生缺血再灌注损伤,MMP-9大量表达,心肌细胞外基质过度降解,大量炎性细胞在细胞间隙游走,TNF-α、IL-1β等炎症因子分泌增加[15]。移植转染bFGF基因的BMSCs后,一方面直接上调bFGF表达,另外BMSCs可通过旁分泌作用促进bFGF分泌,bFGF水平升高,促进心肌细胞外基质平衡,进而调节MMP-9与TIMP-1恢复平衡状态,细胞外基质代谢恢复正常,心肌组织炎症反应得以缓解,心肌组织微环境改善,减少心肌细胞凋亡,也利于干细胞定植和分化为类心肌细胞[16]。因而,转染-bFGF质粒的BMSCs对大鼠AMI再灌注损伤的保护作用可能与旁分泌机制有关。
综上所述,转染-bFGF质粒的BMSCs可显著改善AMI后再灌注大鼠的心功能、缓解炎症反应,并且可显著减少心肌细胞凋亡,可能与bFGF水平上调、调控MMP-9/TIMP-1旁分泌机制有关,为临床中利用干细胞移植治疗AMI再灌注损伤奠定理论基础。
