新生儿危重症评分联合Bcl-xL蛋白在脓毒症新生儿早期危重状态评估中的应用*
2019-07-17吴文燊彭琪黄天丽廖金凤谭槟滢李宁
吴文燊, 彭琪, 黄天丽, 廖金凤, 谭槟滢, 李宁△
1东莞市第八人民医院(东莞市儿童医院)新生儿科(广东东莞 523000); 2东莞市儿科研究所(广东东莞 523000); 3广东医科大学公共卫生学院(广东东莞 523000)
脓毒症(sepsis)是威胁新生儿生命以及导致残疾等不良预后的主要原因[1]。新生儿脓毒症症状不典型、病情变化迅猛,延误治疗可导致病情恶化甚至患儿死亡,更因其治疗费用巨大容易导致医疗纠纷。因此,尽快评估患儿危重程度及采取积极有效治疗对挽救患儿生命及改善疾病预后至关重要。基于临床表现的新生儿危重症评分,尤其是新生儿急性生理学评分(SNAP-Ⅱ)和新生儿急性生理学围产期补充-Ⅱ(SNAPPE-Ⅱ),被认为与新生儿死亡及预后具有较好的相关性[2-3];但是仍然需要适宜的分子生物学标志物与其结合进行作为客观的评价指标。大分子B淋巴细胞瘤蛋白(Bcl-xL蛋白)是抗凋亡蛋白,不仅可以抑制细胞凋亡,而且可以抑制细胞坏死[4],是机体对抗炎症反应导致细胞损害的保护性蛋白,其水平可更加直接地反映外界损害与机体之间的相互作用,协助评估疾病的严重程度。本研究以确诊脓毒症的新生儿为研究对象,检测凋亡指标血Bcl-xL蛋白水平,分析SNAP-Ⅱ、SNAPPE-Ⅱ、血Bcl-xL蛋白水平与新生儿病情危重程度、病情变化的关系,探讨早期血Bcl-xL检测应用于脓毒症新生儿临床危重性预测的可行性,为临床早期评估新生儿脓毒症严重程度、判断预后寻找新的分子标记物。
1 资料与方法
1.1 一般资料 脓毒症组:2016年1月至2017年12月期间,本院新生儿科收治的、在入院6 h内确诊为脓毒症(包括脓毒症休克)的新生儿。脓毒症诊断标准参照序贯器官衰竭评估(SOFA)标准[5]并结合病史及实验室检查:(1)病史:母体有孕期感染或胎膜早破病史(胎盘绒毛膜炎、产道B组链球菌定植、胎儿宫内窘迫、泌尿系感染等);新生儿生后接受侵袭性操作(气管插管、血管穿刺、静脉营养、外科手术等);有其他基础疾病如呼吸窘迫综合征(respiratory distress syndrome,RDS)、吸入综合征、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、先天性心脏病、代谢性疾病等。(2)临床表现:生命体征改变,烦躁、嗜睡等精神状态改变,进食、大小便、肢体活性减少,以及各系统脏器功能障碍或损害表现。(3)实验室检查:病原学培养、分子生物学、免疫学检查测阳性,炎症指标变化[白细胞显著增高或降低,C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、肿瘤坏死因子-α(TNF-α)增高,纤维蛋白原降解产物增加,脑脊液、胸腔积液、腹腔积液细胞数增加等],多器官功能损害的证据(代谢性酸中毒、心血管功能下降、肺功能下降、肾功能下降、肝功能下降或损害、骨髓功能抑制等)。脓毒症休克诊断标准:经充分液体复苏后,血乳酸水平仍高于2 mmol/L并需缩血管药物维持血压正常。观察新生儿病情变化,于24 h内发生脓毒症休克者纳入脓毒症休克亚组,未发生脓毒症休克者纳入普通脓毒症亚组。
对照组:2016年1月至2017年12月期间,本院新生儿科收治的非脓毒症的新生儿,疾病种类主要为新生儿黄疸、糖尿病母亲新生儿等。胎龄、年龄、性别等与脓毒症组具有可比性,见表1。


项目脓毒症组(n=37)对照组(n=20)t/Z/2值P值出生体重(kg)3.00±0.633.23±0.361.4600.150性别[例(%)]0.3260.568 男25(67.6)12(60.0) 女12(32.4)8(40.0)胎龄(周)38.1±2.739.2±1.61.730.089分娩方式[例(%)]0.6200.431 顺产22(59.5)14(70.0) 剖宫产15(40.5)6(30.0)入组时年龄(h)∗2.2(0.2,7.5)2.2(0.5,8.8)0.0340.973
*M(P25,P75)
1.2 方法
1.2.1 标本采集 新生儿于收入院1 h内抽取血液标本,包括全血细胞分析、血培养、血电解质、肝、肾功能、CRP、PCT、动脉血气分析、血Bcl-xL蛋白测定等,并视病情留取脑脊液、胃液、气道分泌物、中段尿、胸腔积液、腹腔积液、大便标本等行病原学检测,行X线胸片、心脏超声等辅助检查。脓毒症组新生儿入院6 h行新生儿危重症评分(SNAP-Ⅱ和 SNAPPE-Ⅱ)。
1.2.2 Bcl-xL蛋白水平检测 血Bcl-xL蛋白浓度采用ELISA法检测。Bcl-xL检测(CUSABIO,产品编号:CSB-EL027199HU)试剂盒,酶标仪(Multiskan Mk3型,赛默飞世尔(上海)仪器有限公司)。样本血清1 000g×离心15 min,取50 μL加入于反应孔,同时加入Bcl-xL样品50 μL于反应孔内。立即加入50 μL的生物素标记的抗体。盖上膜板,轻轻振荡混匀,37℃温育1 h。甩去孔内液体,每孔加满洗涤液,振荡30 s,甩去洗涤液,用吸水纸拍干。重复此操作3次。每孔加入80 μL的亲和链酶素-HRP,轻轻振荡混匀,37℃温育30 min。甩去孔内液体,每孔加满洗涤液,振荡30 s,甩去洗涤液,用吸水纸拍干。重复此操作3次。每孔加入底物50 μL,轻轻振荡混匀,37℃温育10 min。避免光照。取出酶标板,迅速加入50 μL终止液,立即在450 nm波长处测定各孔的OD值。
1.2.3 SNAP-Ⅱ[6]和SNAPPE-Ⅱ[7]评分方法 SNAP-Ⅱ评分法为新生儿入院6 h内取平均血压、体温、氧合指数[氧分压(PO2)/氧浓度(FiO2)]、pH值、尿量、抽搐等最异常值进行相应评分,得分越高,病情越危重[8]。SNAPPE-Ⅱ评分法在SNAP-Ⅱ方法基础上,纳入出生体重、5 min Apgar评分、小于胎龄儿等三项围产期因素,见表2。

表2 新生儿SNAPPE-Ⅱ评分 分

2 结果
2.1 一般资料 共有37例诊断为脓毒症患儿纳入脓毒症组,孕周(38.1±2.7)周,出生体重(3.00±0.63)kg,同期纳入对照组的新生儿共20例,两组病例一般情况差异无统计学意义。脓毒症组SNAPⅡ及SNAPPE-Ⅱ评分分别为(18.1±16.8)分和(19.0±19.3)分。脓毒症组中,有16例在入院24 h内发生脓毒症休克,纳入脓毒症休克亚组,有21例未发生脓毒症休克,纳入普通脓毒症亚组。脓毒症休克亚组中,1例抢救无效死亡,1例因后遗症严重放弃治疗后死亡;普通脓毒症亚组和对照组均无死亡病例。
2.2 脓毒症组与对照组血Bcl-xL水平比较 脓毒症组新生儿血Bcl-xL水平(3.41±0.56)ng/mL,较对照组[(0.82±0.54)ng/mL]高,两组差异有统计学意义(P=0.004);脓毒症组中,脓毒症休克亚组Bcl-xL水平[5.64(1.95,8.66)]ng/mL,高于脓毒症亚组[0.93(0.66,1.40)]ng/mL,差异有统计学意义(P<0.001)。
采用Bcl-xL对脓毒症进行ROC曲线分析,ROC曲线下面积是75.0%,95%可信区间为61.8%~85.5%,见图1。在取Youden指数最大值时的结果作为最佳阳性判断值,诊断脓毒症的阈值为>0.759 ng/mL,其敏感度和特异度分别为75.7%和75.0%,阳性预测值和阴性预测值分别是84.8%和62.5%。
采用Bcl-xL对脓毒症严重程度进行分析,Bcl-xL曲线下面积为83.0%,95%可信区间为67.1%~93.3%,见图2。判断脓毒性休克的阈值为>3.022 ng/mL,其敏感度和特异度分别为75.0%和95.2%,阳性预测值92.3%,阴性预测值83.3%。
2.3 脓毒症休克亚组与普通脓毒症亚组危重症评分的比较 脓毒症休克亚组SNAP-Ⅱ评分和SNAPPE-Ⅱ评分分别为(31.0±18.8)分和(32.9±22.9)分,脓毒症亚组SNAP-Ⅱ评分和SNAPPE-Ⅱ评分分别为(8.3±2.9)分和(8.3±2.9)分。脓毒症休克亚组SNAP-Ⅱ评分高于脓毒症亚组,差异有统计学意义(P<0.000 1)。脓毒症休克亚组SNAPPE评分高于脓毒症亚组,差异有统计学意义(P<0.000 1)。
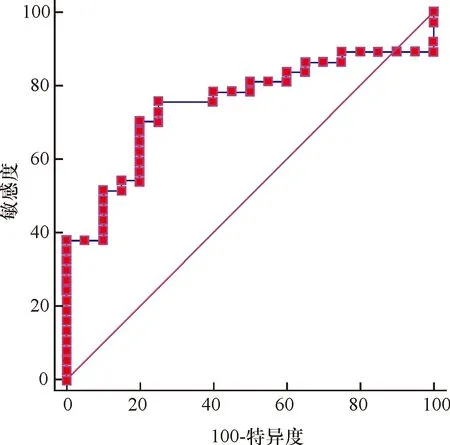
图1 Bcl-xL诊断脓毒症的ROC曲线

图2 Bcl-xL鉴别脓毒性休克的ROC曲线
取SNAP评分>10作为阈值,诊断脓毒性休克的敏感度为75%、特异度为100%、阳性预测值100%、阴性预测值84%。
2.4 血Bcl-xL水平与新生儿危重症评分之间的关系 血Bcl-xL水平与SNAP-Ⅱ和SNAPPE-Ⅱ具有线性相关(P<0.000 1),相关系数分别为0.616和0.598。采用血Bcl-xL水平与SNAP-Ⅱ或者SNAPPE-Ⅱ联合诊断脓毒性休克的敏感度为93.8%,特异度为95.2%,阳性预测值93.8%,阴性预测值95.2%。
3 讨论
脓毒症是指感染或疑似感染因素引起的全身炎症反应综合征,进一步发展可引起多器官功能障碍综合征(MODS)甚至死亡[9]。尽管现代医学技术不断进展,脓毒症的发病率和病死率仍高居不下,在世界各国都是导致疾病和死亡的主要原因[10]。脓毒症病死率高、住院时间长、治疗费用高,成为人类健康的严重威胁和经济发展的巨大负担[11]。许多分子标记物被研发用于脓毒症诊断和评估,但是由于敏感性、特异性、时效性等限制,适于临床应用的却为数不多[12]。
新生儿因其特异性免疫及非特异性免疫均低下,是脓毒症的高危人群。无论在足月儿还是早产儿,脓毒症是导致新生儿患病和死亡的主要疾病之一[13],由于各系统功能尚不成熟,“无特异性临床表现和体征”是新生儿脓毒症突出的特点,不易被早期发现和确诊。全血细胞计数、CRP、PCT等生物标记物是用于脓毒症诊断的主要指标,IL-6、TNF-α等细胞因子主要应用于预测脓毒症的发生[12]。上述指标因影响因素较多,各自存在局限性[14-16]。目前,在早期反映机体损害的实际情况以及对于疾病严重程度的预判方面,仍缺乏具有良好敏感度和特异度的生物学标志物。
SNAP-Ⅱ、SNAPPE-Ⅱ评分是临床上应用比较广泛、通过客观指标评估危重程度、预测新生儿病情转归的评价手段,通常以住院24 h内平均血压、体温、PO2/FiO2、pH值、尿量、抽搐等最异常值,以及出生体重、5 min Apgar评分、小于胎龄儿等三项围产期高危因素进行评估[3, 6-7]。也有研究将其评价时间缩短至入院6 h,以求对疾病严重程度尽早做出判断。但该评分仍然需要适合的分子生物学标志物,对新生儿脓毒症疾病危险程度及预后进行早期、全面、客观的预测。
Bcl-xL蛋白属于Bcl-2家族Ⅰ类成员,具有抑制细胞凋亡的作用。在正常细胞中,Bcl-xL分布于胞质和膜上,在凋亡信号作用下,Bcl-xL转位到线粒体外膜和其他细胞器膜上[17]。在线粒体外膜上可以与其他促凋亡蛋白结合或形成离子通道维持线粒体外膜的完整性[1]。Bcl-xL基因的表达主要在转录水平进行调节,多种前炎症因子可以对Bcl-x启动子区域的共同基序进行调节,促进Bcl-xL基因的表达。如,炎症反应的启动因子NF-κB的激活可上调Bcl-xL基因在B细胞和T细胞中的表达。IL-6介导的信号通路通过激活Stat3和Janus激酶,进而诱导Bcl-xL的表达。大量研究表明Bcl-xL参与多种蛋白质-蛋白质相互作用发挥其抑制凋亡功能[18]。在哺乳动物中,Bcl-xL和Bcl-2通过干扰Caspase-3的活性阻止凋亡[19],也可以通过维持线粒体膜电位和控制活性氧的毒性发挥其抗凋亡的作用[17]。Bcl-xL蛋白不仅可以抑制细胞凋亡,而且可以抑制细胞坏死,是机体对抗炎症反应导致细胞损害的保护性蛋白,其水平能体现外界损害与机体之间的相互反应,直接地反映疾病的严重程度。
在成人脓毒症的研究中,严重脓毒症、脓毒症休克患者与普通脓毒症患者相比,血小板线粒体中的Bcl-xL蛋白含量下降,同时线粒体膜电位下降,提示线粒体功能损害严重,细胞正常的氧化磷酸化无法进行,导致机体处于危重状态,与危重症评分有较好的一致性[19]。而此时血中Bcl-xL水平如何,则未有数据。我们推测,在脓毒症前炎症因子刺激下,细胞Bcl-xL蛋白表达增强,但在细胞及线粒体受到严重破坏不能维持正常形态和功能后,则生成的Bcl-xL蛋白可能释放入血。血Bcl-xL蛋白水平检测需血量少、方法简单、结果快速,适用于新生儿疾病的临床检测,且目前尚无报道将血Bcl-xL水平检测应用于新生儿脓毒症危重状态评估的研究。因此,我们拟通过对脓毒症新生儿血Bcl-xL蛋白水平的检测,为临床医生早期评估机体的损害程度和疾病的严重程度、预判病情的进展情况,提供有效、可靠的分子生物学指标。
本研究显示,入院1 h内检测血Bcl-xL蛋白水平,脓毒症组新生儿血Bcl-xL蛋白水平高于与对照组,差异有统计学意义(P<0.05);更为有意义的是,脓毒症组中,入院24 h内发生脓毒症休克的新生儿与未发生脓毒症休克的新生儿相比,前者入院1 h内血Bcl-xL蛋白水平比后者明显增高,差异有统计学意义(P<0.05)。SNAP-Ⅱ、SNAPPE-Ⅱ与新生儿预后的关系与得到广泛认可,本研究对入院6 h内脓毒症新生儿评估SNAP-Ⅱ、SNAPPE-Ⅱ,脓毒症休克亚组评分较普通脓毒症组显著增高;在两个亚组中,血Bcl-xL蛋白水平与SNAPPE-Ⅱ具有良好的一致性。该结果提示血Bcl-xL蛋白水平和危重症评分联合,敏感度和特异度比单用血Bcl-xL蛋白或者危重症评分都高,所以两个联合对预判疾病的危重状态效果更好。血Bcl-xL蛋白水平可望作为新的分子标记物,早期协助判断脓毒症对新生儿机体损害的严重程度和预判病情的进展情况,结合新生儿危重症评分,特异性、预见性地为临床评估新生儿脓毒症严重程度、判断预后提供参考依据。
