清道夫受体A启动子区DNA甲基化在同型半胱氨酸致动脉粥样硬化中的作用*
2019-07-17张靖张自新姜怡邓
张靖, 张自新, 姜怡邓
1宁夏人民医院心血管内科(宁夏银川 750002); 2宁夏医科大学总医院放疗科(宁夏银川 750004); 3宁夏医科大学病理生理教研室(宁夏银川 750004)
动脉粥样硬化(AS)是一种以动脉粥样硬化斑块形成为主要特征的慢性增生性疾病,发生的机制包括内皮细胞的损伤、平滑肌细胞增生、泡沫细胞形成,其中泡沫细胞的形成发挥重要的作用。研究表明,高同型半胱氨酸血症(hyperhomocysteinemia, HHcy)是AS的重要独立危险因子[1]。所谓同型半胱氨酸(Hcy),是体内一碳单位代谢的中间产物,其代谢途径主要有两种:转甲基途径和转硫途径。我们前期的研究[2]发现,Hcy可引起泡沫细胞脂质代谢异常进而促进AS发生发展,但其机制如何目前尚不清楚。清道夫受体 A(scavenger receptor classA, SR-A)是一种主要分布在巨噬细胞的表面的糖蛋白,巨噬细胞通过SR-A内吞修饰的脂蛋白,促进动脉粥样硬化斑块的形成[3]。但SR-A在AS中的表达调控机制尚不清楚。因此我们于2016年1月至2017年7月进行本研究,旨在探讨SR-A的表达水平改变及其启动子区DNA甲基化在Hcy致AS过程中的作用及其机制,为Hcy引起的AS相关疾病的诊疗提供理论依据。
1 材料与方法
1.1 实验动物 ApoE基因敲除(ApoE-/-)小鼠购自北京维通利华公司,小鼠为SPF级近交系C57BL/6J,均为雄性纯合子,5周龄。另选择健康5周龄雄鼠(SPF 级 C57BL/6J)作为对照组,对照小鼠购自宁夏医科大学实验动物中心。
1.2 实验方法
1.2.1 实验动物模型的复制及分组 本研究采用近交系C57BL/6J背景的5周龄雄性野生型小鼠和ApoE-/-小鼠(SPF级,北京维通利华公司)为研究对象。以C57BL/6J小鼠作为正常对照组(12只):小鼠给予普通饮食;将ApoE-/-小鼠通过随机数表法分为两个组:(1)ApoE-/-对照组(12只),小鼠饲以普通饮食;(2)高蛋氨酸组(12只):小鼠饲以高蛋氨酸饮食(即向普通鼠用饲料中额外添加1.7%蛋氨酸)。
1.2.2 动物处理 在小鼠饲养16周后,禁食12 h后称重,待小鼠被成功麻醉后眼球取血静置以分离血清。随后将小鼠开腹并分离小鼠主动脉,用生理盐水清洗主动脉后迅速置于液氮中冷冻1 min,最后-80℃保存。
1.2.3 测定血清Hcy、LDL、HDL、TG、CH浓度 通过全自动生化分析仪检测各组小鼠血清当中的Hcy、胆固醇(cholesterol,CH)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)及三酰甘油(triglyceride,TG)浓度。
1.2.4 制备小鼠主动脉冰冻切片 将小鼠主动脉自冰箱中取出后,用干净的生理盐水冲洗后,自主动脉根部小心剪取1 cm。将取下的血管放在支承器上,滴上专用冷冻包埋剂冰冻固定、成型。将冷冻好的血管组织块固定后切成约5 μm的组织片,封片后油红O染色镜检。
1.2.5 THP-1单核细胞的复苏、传代及培养 从液氮罐中取出装有THP-1单核细胞(中原公司代购的美国ATCC)冻存管,完全融化,然后在无菌下取出细胞,加入适量培养液后轻轻吹打混匀为细胞悬液,后接种于6孔板中。置37℃温箱静置培养,次日更换一次培养液,继续培养,观察生长情况。若细胞密度较高,及时传代。
1.2.6 细胞分组、处理及油红O染色 用含100 nmol/L佛波酯(PMA)的培养液干预细胞48 h后,显微镜观察THP-1单核细胞是否具有细胞贴壁、伸出伪足、形状不规则等巨噬细胞的相关特点。继续培养48 h后使巨噬细胞转化为泡沫细胞。更换为含有不同终浓度Hcy(50、100、200、500 μmol/L Hcy)和(或AZC)(50 μmol/L Hcy+10 μmol/L AZC)的培养液干预泡沫细胞,并同时设置培养基中不含有Hcy及AZC的正常对照组细胞,48 h后吸尽液体,PBS洗3次,加入试剂一应用液,盖上盖玻片,染色10~15 min,37℃温蒸馏水洗5~20 s;加入试剂二复染液,染色3~5 min,37℃温蒸馏水冲洗30~60 s,取出盖玻片,在盖玻片表面水干透之前滴加试剂三水性封固剂,封片后镜检。
1.2.7 cDNA第一链合成 按组分进行反应液的配制,轻柔混匀上述反应液,短暂离心使液体沉入管底后放入PCR仪中,42℃反应60 min,70℃ 5 min,停于4℃。得到的cDNA反应液可于-20℃条件下短期保存。将试剂置于冰上,配置反应体系,进行荧光定量PCR检测:在 NCBI GenBank数据库中查询LDLR(NM-001172633.1)采用Primer Premier 5.0软件设计引物,LDLR的引物:上游:5′-AGGAGCCCGAGTAAATTG-3′,下游:5′-CGGCAACAAGCAGAAGAA-3′,探针:5′-6-FAM-CCCCAGGAAACGGACCCT-TAMRA-3′,扩增产物长度为162 bp。GAPDH:上游:5′-GAGCTGAACGGGAAACTCAC-3′,下游:5′-GGTCTGGGATGG AAACTGTG-3′,扩增产物长度为146 bp。收集各组细胞,用TrizoI抽提总RNA,按反转录试剂盒说明书反转录合成cDNA,用以下条件进行PCR:94℃预变性3 min,94℃变性45 s,57℃退火45 s,72℃延长45 s,扩增35个循环。
1.3 数据处理
1.3.1 荧光定量PCR反应数据处理 荧光定量PCR反应数据结果计算公式:目的基因的相对量=2-ΔΔCt,ΔΔCt=[Ct (待测样品)-Ct GAPDH(待测样品)]-[Ct (校正样品)-Ct GAPDH (校正样品)]。
1.3.2 巢式降落式甲基化特异性PCR(nMS-PCR)检测SR-A启动子区DNA甲基化 巢式降落式甲基化特异性PCR(nested touch-down methylation-specific PCR, nMS-PCR),是在甲基化特异性PCR(MS-PCR)的实验基础上加入了巢式降落式反应、并经过适当优化的一种基因甲基化程度检测技术。按DNA提取试剂盒说明书提取基因组DNA,用亚硫酸盐修饰法对DNA进行甲基化修饰。采用网上在线(http://www.urogene.org/methprimer/)和MethPrimer设计引物,LDLR外引物:上游:5′-TTAAAATGAAGTAAAAATTTTTTTT-3′,下游:5′-CCTTCATAAACTTAACCTTAAAATC-3′,PCR条件:30个循环(94℃,30 s;54.5℃, 30 s;72℃,1 min),PCR产物长度:251 bp。甲基化上游:5′-AATAGTGGTTTTTTAAATATTTCGG-3′,甲基化下游:5′-TCATAAACTTAACCTTAAAATCGTC-3′;非甲基化上游:5′-AATAGTGGTTTTTTAAATATT-TTGG-3′,非甲基化下游:5′-TTCATAAACTTAA CCTTAAAATCATC-3′。反应条件:94℃预变性5 min,然后采用降落式PCR程序,30个循环(94℃,30 s;56℃,30 s;72℃,1 min),再于恒定的退火温度下进行20个循环(94℃,30 s;42℃, 30 s;72℃,1 min),最后72℃再延伸10 min。甲基化产物为133 bp,非甲基化产物为134 bp,琼脂糖凝胶电泳,紫外线照像分析光密度。每组实验重复3 次。
1.3.3 结果计算与分析 采用软件自带Image Lab软件分析各条带光密度值,分析样品甲基化和非甲基化结果,结果计算公式为:甲基化百分比=甲基化(OD值)/[甲基化(OD值)+非甲基化(OD值)]。

2 结果
2.1 小鼠主动脉病理改变 油红O染色结果:正常对照组小鼠主动脉血管壁的三层结构清晰,且内膜光滑,平滑肌细胞排列整齐,内皮下未见脂质及炎性细胞浸润,中层及外膜结构清楚,未见病理改变;ApoE-/-对照组小鼠的主动脉管壁增厚,内膜增生,可见少量泡沫细胞形成;HHcy模型组小鼠主动脉粥样斑块形成,血管壁有隆起,内膜增厚,内膜下平滑肌细胞增生,管腔狭窄,有脂滴聚集,大量巨噬细胞浸润,中层结构紊乱,平滑肌增生、坏死,并有炎性细胞浸润。见图1。

A: 正常对照组; B: ApoE-/-对照组; C:高蛋氨酸组
2.2 小鼠血清Hcy及血脂含量 高蛋氨酸组小鼠血清当中的Hcy水平明显升高且高于ApoE-/-对照组和正常对照组小鼠,分别为两者的1.62倍和3.47倍,经统计学分析,3组比较差异均有统计学意义。高蛋氨酸组小鼠的血清LDL、TG、CH水平分别为ApoE-/-对照组的1.70倍、2.37倍和1.34倍,分别为正常对照组的3.62倍、8.28倍、7.24倍,HDL下降约32%和27.7%(P<0.05,P<0.01),以上结果分析提示HHcy能够加重血脂代谢紊乱。见表1。


组别nHcy(μmol/L)LDL(mmol/L)HDL(mmol/L)TG(mmol/L)CH(mmol/L)正常对照组125.900±0.2600.396±0.0321.789±0.1830.197±0.0461.997±0.347ApoE-/-对照组1212.670±1.355∗∗0.843±0.158∗∗0.748±0.187∗∗0.689±0.176∗10.794±0.674∗∗高蛋氨酸组1220.475±4.947∗∗△△1.432±0.392∗∗△△0.475±0.098∗∗△1.632±0.586∗∗△△14.465±2.432∗∗△△
与正常对照组比较*P<0.05,**P<0.01;与ApoE-/-对照组比较 △P<0.05, △△P<0.01
2.3 小鼠主动脉SR-A表达改变 高蛋氨酸组小鼠的主动脉中SR-A mRNA表达水平为1.78±0.09,显著高于正常对照组和ApoE-/-对照组小鼠的相对表达量,分别为1.18±0.06和0.89±0.08,差异有统计学意义(与正常对照组比较t=3.383,P<0.05;与ApoE-/-对照组比较,t=5.621,P<0.05);高蛋氨酸组小鼠的主动脉中蛋白表达水平为1.32±0.07,显著高于正常对照组和ApoE-/-对照组小鼠的相对表达量,分别为0.72±0.03和0.78±0.06,差异有统计学意义(与正常对照组比较t=3.254,P<0.05;与ApoE-/-对照组比较,t=4.579,P<0.05)。见图2。

A:各组小鼠主动脉中SR-A mRNA表达 B: 各组小鼠主动脉中SR-A 蛋白表达; *与高蛋氨酸组比较P<0.05
2.4 小鼠主动脉SR-A 启动子区DNA甲基化水平改变 采用生物信息学网站预测分析了SR-A启动子区的甲基化位点,见图3-A。高蛋氨酸组小鼠主动脉中SR-A启动子区DNA甲基化水平为0.47±0.05,显著高于对照组与正常对照组SR-A启动子区DNA甲基化水平,分别为0.32±0.02和0.30±0.04,差异无统计学意义(P>0.05)。见图3-B。
2.5 Hcy干预泡沫细胞后SR-A表达 不同浓度Hcy刺激泡沫细胞后,与正常对照组比较,SR-A mRNA和蛋白表达升高,但不呈剂量依赖关系,其中在50、100、200 μmol/L Hcy组SR-A mRNA 及蛋白水平显著升高(P<0.05)。见图4。
2.6 Hcy干预泡沫细胞后SR-A启动子DNA甲基化水平改变 分别用50、100、200、500 μmol/L Hcy干预泡沫细胞,通过nMS-PCR检测发现,Hcy并未引起SR-A启动子区甲基化水平改变。见图5。
2.7 腺病毒DNMT1感染泡沫细胞后SR-A启动子区DNA甲基化改变 构建DNMT1重组腺病毒载体并转染泡沫细胞,48 h后观察荧光效率,提取细胞总DNA,用nMS-PCR法检测SR-A启动子区DNA甲基化的变化,结果显示:DNMT1过表达后SR-A启动子区DNA甲基化水平0.67±0.02,DNMT1过表达合并100 μmol/L Hcy刺激后SR-A启动子区DNA甲基化水平0.62±0.05,两组差异无统计学意义(P>0.05)。见图6。
2.8 腺病毒DNMT1感染泡沫细胞后SR-A表达改变 构建DNMT1过表达并分别用腺病毒载体(空白对照组)和DNMT1重组腺病毒载体(过表达)感染泡沫细胞,48 h后提取细胞总RNA,检测SR-A mRNA和蛋白表达水平。结果表明:DNMT1过表达合并100 μmol/L Hcy刺激后SR-A mRNA表达水平为2.62±0.36, DNMT1过表达组0.42±0.06,空白对照+100 μmol/L Hcy组SR-A mRNA表达水平为3.82±0.43,前者分别与后两者比较差异有统计学意义(与DNMT1过表达组比较t=8.42,P<0.05;与空白对照+100 μmol/L Hcy组比较t=6.57,P<0.05),见图7-A。DNMT1过表达合并100 μmol/L Hcy刺激后SR-A蛋白表达水平为0.26±0.04, DNMT1过表达组0.05±0.01,空白对照+100 μmol/L Hcy组SR-A蛋白表达水平为0.38±0.03,前者分别于后两者比较差异有统计学意义(与DNMT1过表达组比较t=7.63,P<0.05;与空白对照+100 μmol/L Hcy组比较t=5.34,P<0.05)。见图7-B。

A:SR-A启动子区甲基化位点;B:nMS-PCR后样品琼脂糖凝胶电泳(M:甲基化条带,U:非甲基化条带);C:SR-A甲基化统计图
图3ApoE-/-小鼠主动脉SR-A启动子区DNA甲基化水平
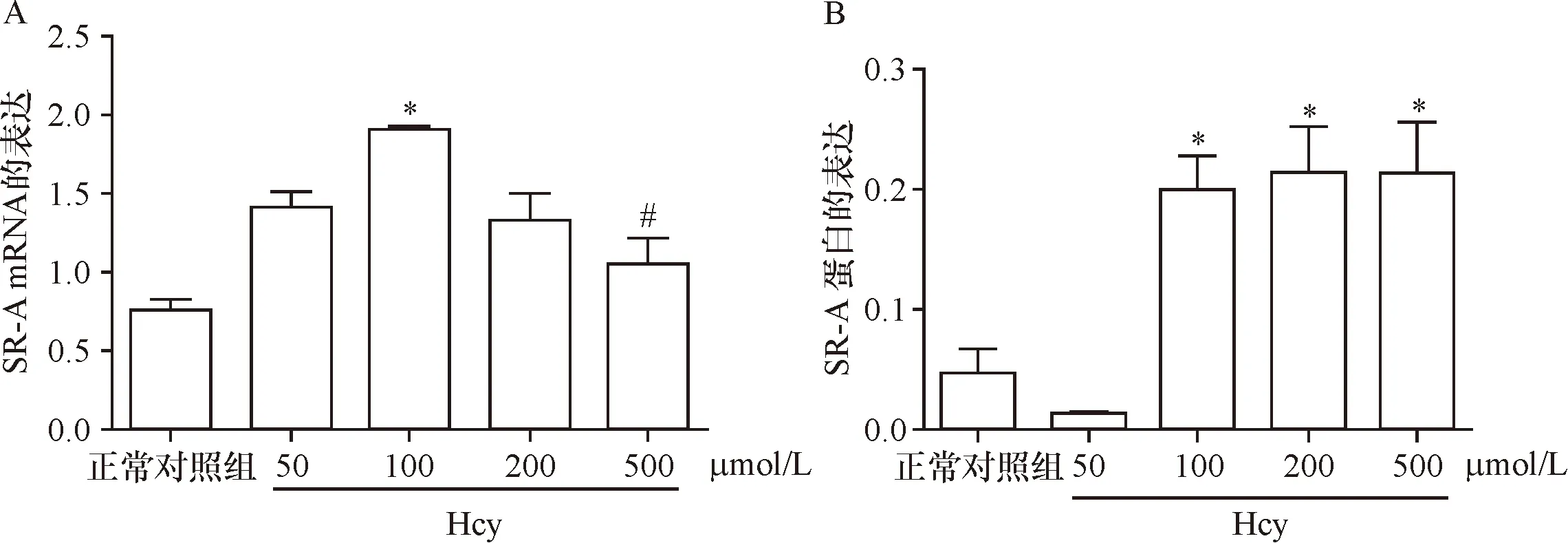
A:泡沫细胞SR-A mRNA表达;B: 泡沫细胞SR-A蛋白表达;*与正常对照组比较 P<0.05; #与50 μmol/L Hcy组比较 P<0.05

A:SR-A启动子区DNA甲基化电泳图;B:SR-A启动子区DNA甲基化水平统计图

A:SR-A启动子区DNA甲基化电泳图;B:SR-A启动子区DNA甲基化水平统计图

A:DNMT1腺病毒感染泡沫细胞后SR-A mRNA表达;B:DNMT1腺病毒感染泡沫细胞后SR-A蛋白表达,*与空白对照组比较P<0.05, #与DNMT1过表达组比较P<0.05, △与空白对照+100 μmol/L Hcy组比较P<0.05
图7DNMT1腺病毒感染泡沫细胞后SR-A的表达改变
2.9 SR-A甲基化对泡沫细胞形成的影响 Hcy可以增加细胞泡沫样改变,镜下泡沫细胞的形状不规则,胞浆内充满大量红色脂质颗粒,状如脂滴,且有部分细胞因吞噬脂质导致细胞体积明显增大;而在加入AZC之后,结果显示AZC明显促进了Hcy引起的泡沫细胞内的脂质聚积这一作用。见图8。

A: 正常组泡沫细胞形态;B: 50 μmol/L Hcy干预后的泡沫细胞形态改变; C:AZC干预后泡沫细胞形态改变
3 讨论
血管壁受到高浓度的糖、脂类等刺激后,就会产生慢性炎症反应[4],使血液中的单核细胞向病变部位浸润,细胞伸出伪足并分化为巨噬细胞,巨噬细胞在吞噬大量脂质后变为泡沫细胞[5]。大量泡沫细胞堆积在血管内膜下形成动脉粥样斑块,这是动脉粥样硬化相关疾病发生的关键环节。高血脂、高血糖、高血压、吸烟等已被确认为AS的危险因素[6]。有研究表明,体内Hcy水平升高,AS的发病率及死亡率明显上升,因此,HHcy被视作AS的独立危险因素[7]。当血清当中Hcy水平>5 μmol/L,发生心血管疾病的危险性增加20%~30%;但将Hcy水平维持在9 μmol/L以下,心血管疾病5年存活率可达95%;如果血清Hcy水平持续在9~15 μmol/L之间时,心血管疾病5年存活率大约为90%;当血清Hcy水平达到16~20 μmol/L时,5年存活率低于75%[8]。目前认为,Hcy致病机制与其代谢途径密不可分[9]。首先,Hcy在体内是甲硫氨酸循环的中间产物,因此,当摄入的蛋氨酸水平增加时,可能会导致Hcy水平升高,从而促进疾病的发生发展[10]。
SR-A是一种位于吞噬细胞表面的糖蛋白,能够参与免疫系统的病原体识别与清除活动,同时还可清除丧失唾液酸的陈旧红细胞以及循环中的某些凋亡细胞[11]。还有学者发现SR-A 能够作为脂蛋白受体从而参与AS的发生发展[12],这一结果在一定程度上为临床治疗和干预指明了方向,本研究表明,相比对照组,给予高蛋氨酸饮食喂养的ApoE-/-小鼠主动脉当中SR-A的mRNA及蛋白表达水平均出现显著上调,且细胞水平的实验结果与动物水平一致。这就提示Hcy可促进SR-A表达,故Hcy有可能通过增加SR-A的表达水平促进了脂质的胞内沉积并最终加速AS的发展。
DNA甲基化是表遗传学领域的关键内容之一,有学者先后发现,在AS的进展过程中,氧化低密度脂蛋白受体、二甲基精氨酸二甲氨基水解酶等多种基因的DNA甲基化程度均出现了明显的变化[13]。在前期研究中,课题组发现Hcy能够下调DNMT1的表达水平并影响下游基因的DNA甲基化水平[14]。
综上所述,Hcy可能通过调控SR-A启动子区的DNA甲基化从而改变表达水平,增加泡沫细胞中的脂质聚集并加速AS的发生发展,为AS的分子生物学诊断提供新的视角。
