日本结缕草Zj ERF 1的克隆、转录激活活性、亚细胞定位及表达分析
2019-07-17滕珂张蕊檀鹏辉岳跃森范希峰武菊英
滕珂,张蕊,檀鹏辉,岳跃森,范希峰,武菊英*
(1.北京草业与环境研究发展中心,北京100097;2.北京林业大学草坪研究所,北京100083)
植物为适应在生长发育过程中遭受到的多种生物胁迫及非生物胁迫,进化出了复杂的分子调控机制[1]。转录因子是一类能够结合启动子作用元件的DNA结合蛋白,通过激活或抑制相关基因的转录来发挥功能[2]。AP2/ERF转录因子家族以APETALA2(AP2)结构域来命名,是植物中最大的一类转录因子家族之一,广泛参与DNA结合。根据所含AP2结构域的数量,AP2/ERF转录因子可以分为AP2、RAV和ERF(ethylene responsive factor,乙烯响应元件结合蛋白)等类型[3]。AP2转录因子含有两个AP2结构域,主要在花的发育和形态建成过程中起作用。RAV转录因子包含一个AP2/ERF结构域和一个B3结构域,参与植物生长发育和非生物胁迫应答[4]。ERF转录因子只含有一个AP2结构域,根据其结合的位点可分为两类:一类通过结合靶基因的GCC-box来对其转录进行调控,参与乙烯(ET)、茉莉酸(JA)和水杨酸(SA)等激素的信号转导途径;另一类通过结合CCGAC位点参与多种非生物胁迫途径[5-6]。
目前,前人已经在拟南芥(Arabidopsis thaliana)[6]、水稻(Oryza sativa)[7]、柑橘(Citrus reticulata)[8]和菜心(Brassica campestris)[9]等多种植物中克隆并鉴定出了ERF转录因子,并对其功能展开了深入研究。拟南芥AtERF 7结合GCC-box抑制下游基因的转录,减弱了保卫细胞对ABA的敏感性,提高了植物细胞的保水能力[10]。水稻OsERF 922可通过调控ABA合成相关基因的表达来调节内源ABA的含量,从而改变水稻对盐胁迫的适应能力[11]。柑橘Cit ERF 13通过结合Cit PPH启动子的DRE(dehydration-responsive element,干旱响应元件)来调控其表达,促进叶绿素降解[8]。进一步研究揭示了Cit ERF13可通过抑制叶绿素合成、CO2羧化作用等多种途径抑制光合效率[12]。菜心Br ERF72是一种可受MeJA(methyl jasmonate,茉莉酸甲酯)诱导,细胞核定位且具有转录激活活性的转录因子,可通过直接结合Br LOX4、Br AOC3和Br OPR3启动子的GCC或DRE/CRT(C-repeat,C重复元件)来参与JA合成途径,进而调控植物叶片衰老[9]。
结缕草(Zoysia japonica)是一种重要的暖季型草坪草,因其耐践踏、抗旱性强、耐盐等优点而广泛应用于运动场草坪的建植及城市绿化[13-14]。然而,目前结缕草的遗传资源研究仍十分有限,在GenBank中仅有500多条EST(expressed sequence tags,表达序列标签)序列[15]。深入挖掘结缕草优良的基因资源,不仅可以增强对结缕草抗逆分子机理的认识,而且有助于结缕草性状改良育种。虽然已经从一些模式植物中克隆得到ERF基因,但是ERF在结缕草中的功能研究还鲜有报道,其功能并不清楚。本研究利用RACE(rapid amplification of cDNA ends,c DNA末端快速克隆)技术首次从日本结缕草中克隆得到Zj ERF 1基因,同时利用染色体步移方法对其启动子进行了克隆,并对ZjERF 1基因与其启动子进行了生物信息学分析;研究了ZjERF1的转录激活活性和亚细胞定位特征,并分析了激素及盐、干旱胁迫处理后ZjERF 1基因的表达情况,旨在为深入研究Zj ERF 1基因的功能提供基础。
1 材料与方法
1.1 材料
本研究所用的日本结缕草品种‘Meyer’由江苏省中国科学院植物研究所刘建秀研究员惠赠,种植于温室,农杆菌EHA105、亚细胞定位载体3302Y3、酵母双杂交载体pGBKT7、Y2HGold酵母菌株及本生烟草(Nicotiana benthamiana)均由本实验室保存。RACE试剂盒、反转录试剂盒、BglⅡ快切酶、Bam HⅠ快切酶、p MD-19T、PrimeSTAR HS DNA Polymerase、Infusion连接酶和酵母缺陷型培养基等购于宝生物公司(Ta KaRa)。RNA提取试剂盒、PCR产物纯化试剂盒购自OMEGA公司。大肠杆菌感受态DH5α购于天根生化科技公司。PCR Mix、SYBR Mix购自康为世纪公司。PEG4000、乙烯(ET)、脱落酸(ABA)和茉莉酸甲脂(MeJA)购于SIGMAALDRICH。
1.2 方法
1.2.1 Zj ERF 1克隆与生物信息学分析 利用试剂盒提取健康生长的日本结缕草叶片RNA。根据前期转录组数据设计5′/3′RACE的引物(表1),按照RACE试剂盒说明书进行5′/3′RACE。反应结束后经琼脂糖凝胶电泳检测,将PCR产物纯化后连接克隆载体p MD-19T,检测为阳性的菌液送北京睿博兴科生物技术有限公司测序,利用DNAMAN 8.0拼接测序结果。根据拼接序列设计引物ZjERF1-F/R,以日本结缕草cDNA为模板扩增基因全长,反应程序为95℃10 min;95℃30 s,57℃30 s,72℃45 s,30个循环;72℃5 min,12℃保温。目的片段纯化后连接克隆载体,检测后测序,测序正确的菌液提取质粒用于后续实验。
利用DNAMAN 8.0软件预测基因编码的氨基酸序列。保守结构域分析及同源比对利用NCBI的Blast功能,用CLUSTALW(https://www.genome.jp/tools-bin/clustalw)和BoxShade(https://embnet.vital-it.ch/software/BOX_form.html)在线软件作图。蛋白质的亲疏水性、分子量及等电点推导用ProtParam。信号肽预测使用SignalP 4.1。系统进化树利用MEGA 5.0软件构建。亚细胞定位情况预测用Softberry网站。
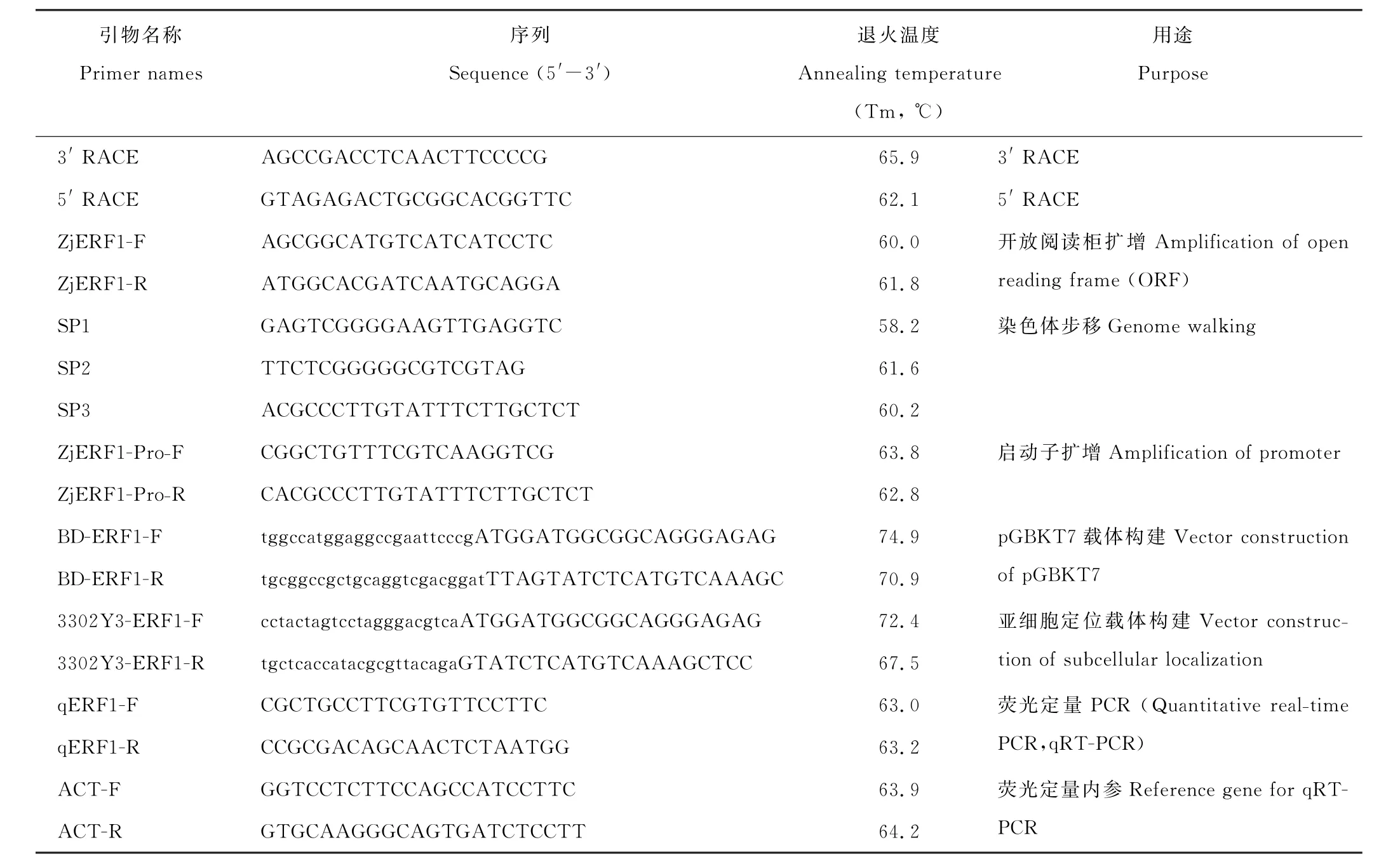
表1 引物列表Table 1 Primer list of this study
1.2.2 ZjERF 1启动子克隆与作用元件预测分析 CTAB(cetyltrimethyl ammonium bromide,溴化十六烷基三甲铵)法提取健康生长的日本结缕草叶片DNA,根据ZjERF 1基因gDNA序列的5′端设计染色体步移的3条特异性引物SP1、SP2、SP3(表1),以日本结缕草基因组DNA为模板进行染色体步移,反应结束后将2、3轮产物进行琼脂糖凝胶电泳检测,条带单一的PCR产物送去测序。根据染色体步移测序结果设计引物ZjERF1-Pro-F/R(表1)扩增启动子序列,反应程序为95℃10 min;95℃30 s,57℃30 s,72℃90 s,30个循环;72℃5 min,12℃保温,PCR产物纯化后连接p MD-19T载体,阳性菌液送测序。通过PLACE网站(https://sogo.dna.affrc.go.jp)预测Zj ERF 1基因启动子可能存在的作用元件。
1.2.3 ZjERF1转录激活活性验证 以测序正确的p MD-ZjERF1质粒为模板,BD-ERF1-F/R为引物(表1),用PrimeSTAR进行PCR扩增,反应程序为98℃10 s,98℃10 s,68℃30 s,25个循环;72℃3 min,12℃保温。利用Bam HⅠ单酶切p GBKT7载体,PCR仪中反应15 min。将PCR产物及载体单酶切产物进行纯化,之后在In-Fusion连接酶的作用下进行同源重组。连接产物转化DH5α,挑取单克隆送公司测序,测序正确的菌液提质粒,保菌备用。利用Li AC(lithium acetate,醋酸锂)法[16],将pGBKT7-ZjERF1转化为酵母感受态细胞,涂布于一缺培养基(SD-Trp),30℃培养2 d左右。挑取单克隆,PCR鉴定为阳性的菌液,以p GBKT7空载体为对照,分别稀释10、100倍上样,利用Cannon EOS 60D拍照。
1.2.4 Zj ERF1亚细胞定位 设计亚细胞定位载体构建引物3302Y3-ERF1-F/R(表1),以含有目的基因的质粒为模板扩增目的条带,用In-Fusion连接酶将PCR纯化产物连接入BglⅡ单酶切过的3302Y3载体。构建好的亚细胞定位载体35S::Zj ERF1:YFP转化农杆菌EHA105。采用瞬时表达的方法,将成功转化目的质粒的农杆菌注射本生烟草叶片,暗培养48 h[17]。以3302Y3空载体为对照,利用激光共聚焦显微镜(Leica SP-5)观察YFP荧光在细胞中的分布情况。
1.2.5 ZjERF 1的表达分析 剪取正常生长的日本结缕草成熟植株的根、茎、叶做组织差异分析;剪取幼嫩叶片、成熟叶片、衰老叶片,做不同发育时期的表达分析。选取5盆长势一致的日本结缕草分别喷施200μmol·L-1ET、10μmol·L-1ABA、10μmol·L-1MeJA,浇灌300 mmol·L-1NaCl和20%PEG4000。在处理第0、1、3、6、12、24 h分别剪取不同处理的叶片,液氮速冻后-80℃保存。提取上述样品总RNA,经NanoDrop ND-1000检测合格后反转录为cDNA。设计荧光定量引物qERF1-F/R(表1),以日本结缕草Actin基因(GenBank登录号:GU290546)为内参进行qRT-PCR反应,每个样品设置3个生物学重复,4个技术重复。用2-ΔΔCt法计算基因的相对表达量[18]。
1.3 数据统计与分析
利用Excel 2010计算表达量,SPSS 18.0进行方差分析,SigmaPlot 12.5作图。
2 结果与分析
2.1 Zj ERF 1全长的获得与生物信息学分析
通过RACE方法从日本结缕草中克隆得到目的基因,命名为Zj ERF 1(图1)。该基因开放阅读框为630 bp,编码209个氨基酸(GenBank登录号:MH294481)。保守结构域分析表明,该基因编码的蛋白属于ERF转录因子家族。氨基酸序列同源比对结果显示,ZjERF1与玉米(Zea mays)、高粱(Sorghum bicolor)及水稻同源性均在80%以上(图2A)。一级结构分析表明,该基因编码蛋白分子量为22.48 k D;理论等电点为5.0,其中阴性氨基酸(Asp+Glu)29个,阳性氨基酸(Arg+Lys)21个;亲水性平均系数为-0.285,属于亲水性蛋白。信号肽预测结果表明,ZjERF1不含信号肽;构建系统进化树发现,ZjERF1与粳稻(Oryza sativa)AP2/ERF-like(BAD 19440.1)亲缘关系最近(图2B)。亚细胞定位预测结果显示,ZjERF1定位于细胞核。
2.2 Zj ERF 1启动子的克隆与作用原件分析
染色体步移结束后,将2、3轮PCR产物进行琼脂糖凝胶电泳检测(图3A),条带清晰的PCR产物送公司测序,测序结果经比对分析,最终获得Zj ERF 1基因ATG上游1581 bp序列。根据得到的序列设计引物扩增Zj ERF 1启动子,得到目的条带与预期相符,经测序分析确定为Zj ERF 1启动子序列。PLACE启动子在线预测分析发现,Zj ERF 1启动子序列中除了有CAAT-box、TATA-box等基本顺式作用元件,还含有与光、植物激素等相关的顺式调控元件。该序列上有1个脱落酸响应元件(ABRE:ABA-responsive element,茉莉酸响应元件),8个茉莉酸甲酯响应元件(4个CGTCA-motif,4个TGACG-motif)和1个水杨酸响应元件。此外,还有HSE(heat shock element,热休克元件)、MBS(MYB binding site,MYB转录因子结合位点 )、LTR(low-temperature responsiveness,低温响应元件)和TC-rich repeat等若干与非生物胁迫关的应答元件(图3B)。

图1 Zj ERF 1基因的克隆Fig.1 Cloning of Zj ERF 1 gene

图2 Zj ERF 1同源性比对及遗传进化分析Fig.2 Sequences alignment and phylogenetic analysis of Zj ERF1

图3 启动子克隆的染色体步移及其作用元件分析Fig.3 Genome walking for isolating promoter and cis-elements analysis
2.3 ZjERF1转录激活活性分析
尽管大量研究发现AP2/ERF家族的转录因子具有转录激活或转录抑制的作用,而ZjERF1的转录活性特征并不清楚。为分析ZjERF1是否具有激活活性,将构建成功的p GBKT7-ZjERF1载体转化Y2 HGold酵母感受态细胞,以p GBKT7空载体为对照。结果显示,在SD-Trp培养基上对照和p GBKT7-Zj ERF1均可正常生长。之后,将成功转化目的质粒的菌液分别稀释1、10和100倍后点样在SD-Trp-His-Ade培养基上观察其生长情况。结果表明,对照不能在SD-Trp-His-Ade培养基上生长,而p GBKT7-ZjERF1可正常生长。本试验表明:ZjERF1具有较强的自激活活性(图4)。
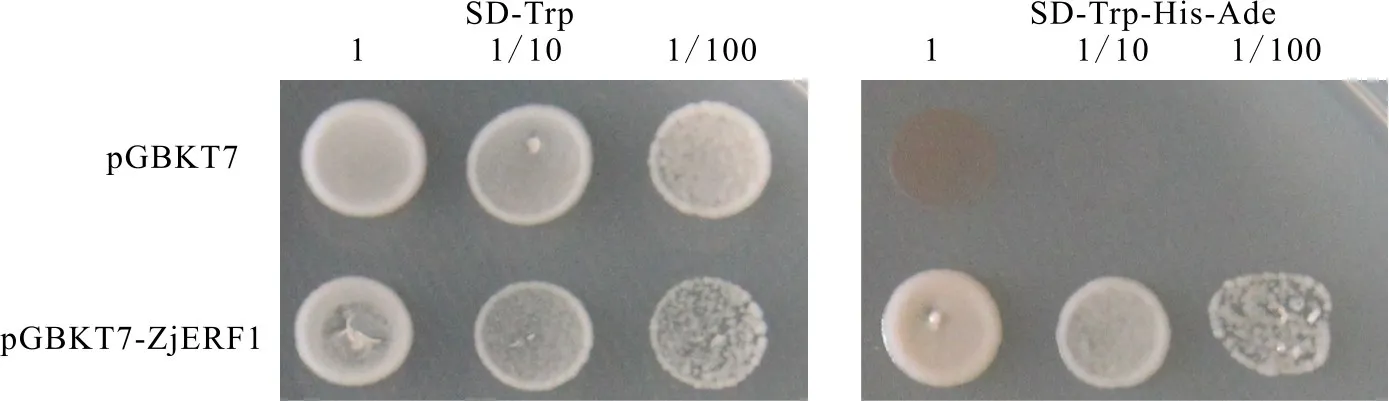
图4 Zj ERF1转录激活验证Fig.4 Auto-transcriptional activation assay
2.4 ZjERF1亚细胞定位
亚细胞定位预测结果显示,Zj ERF1定位于细胞核,为了进一步研究ZjERF1的定位情况,构建35S::ZjERF1:YFP载体,以空载35S::YFP为对照,质粒成功转化农杆菌后注射本生烟草叶片,48 h暗培养后在Leica SP-5激光共聚焦显微镜下观察黄色荧光蛋白分布(yellow fluorescence protein,YFP),结果发现,转35S::YFP的荧光信号分布于整个细胞中,而ZjERF1定位于细胞核(图5)。
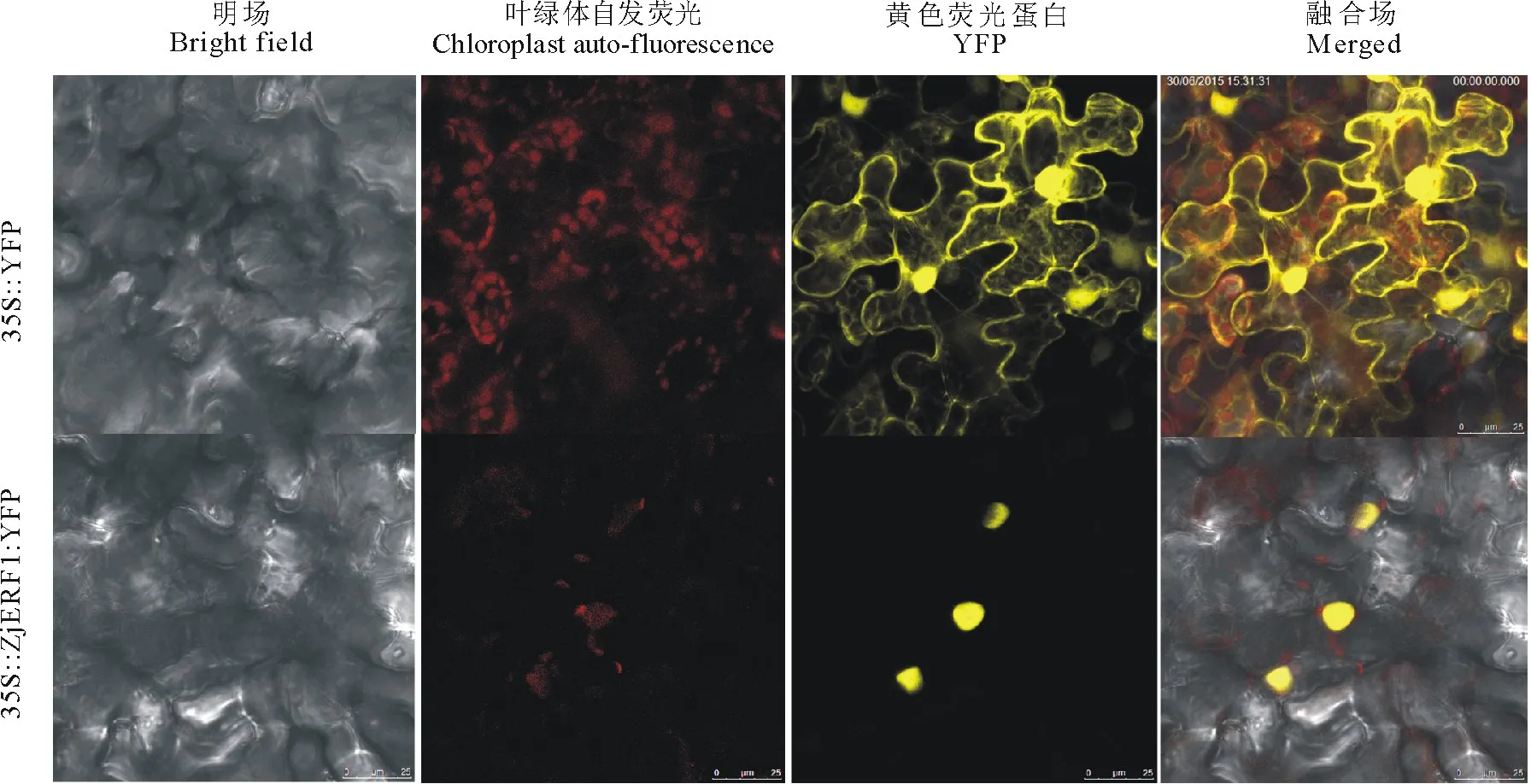
图5 ZjERF1的亚细胞定位Fig.5 Subcellular localization of ZjERF1
2.5 Zj ERF 1表达模式分析
荧光定量结果显示,Zj ERF 1在根、茎、叶中均有表达,但在茎中的表达量显著高于根和叶片,分别是根中的2.37倍,叶片中的1.77倍(图6A);Zj ERF 1在不同发育时期的叶片中表达量也明显不同,与衰老程度呈正相关性,其在衰老叶片中的表达量最高,幼嫩叶片中的表达量最低。其中衰老叶片的表达量分别是成熟叶片的1.41倍,幼嫩叶片的2.59倍(图6B)。
ET、ABA及MeJA激素处理后的荧光定量结果表明:ZjERF 1的表达可以受到ET的诱导,在处理的第6 h达到最高水平,为初始水平的5.12倍(图6C);Zj ERF 1的表达在喷施ABA后的前3 h呈下降趋势,但在处理的第6 h表达量显著升高,为第3 h的20.0倍,之后又表现出显著下降的趋势(图6D);Zj ERF 1的表达总体上受到MeJA的诱导,在处理6 h达到峰值,为初始水平的2.31倍(图6E)。
高盐和干旱胁迫处理后的荧光定量数据显示:在处理的24 h内,300 mmol·L-1的NaCl处理诱导了Zj ERF 1的表达,具体表现为在第3 h开始升高,为第1 h的1.39倍,而在第12 h达到峰值,为处理前的3.99倍(图6F)。而20%的PEG4000处理显著抑制Zj ERF 1的表达,表达量随着处理时间的延长逐渐下降,在6 h达到最低值,为初始水平的1.47×10-3倍(图6G)。
3 讨论
目前关于ERF基因的研究主要集中在拟南芥和水稻等模式植物中,在结缕草上的研究却鲜有报道。本研究利用RACE的方法从日本结缕草中克隆得到ZjERF 1基因,蛋白保守结构域分析表明,ZjERF 1属于ERF转录因子家族。Zj ERF 1拥有1个高度保守的含有65个氨基酸残基的AP2 DNA结构域,具有高度结合GCC-box的潜力,能够调控相关基因的表达[6]。构建系统进化树发现ZjERF1与粳稻AP2/ERF-like(BAD19440.1)的亲缘关系最近。拟南芥中的研究发现,EAR motif对于ERF转录因子发挥转录抑制的作用至关重要[19]。本研究转录激活活性分析表明,ZjERF1具有较强的转录激活活性,可以发挥转录调控的功能,分析这可能与其不含EAR-motif有关。亚细胞定位结果显示,ZjERF1定位于细胞核,这与柑橘CitERF13[20]、小麦(Triticum aestivum)TaERF W17[21]、菜心Br ERF72[9]的定位结果一致。以上结果表明:ZjERF1属于典型的ERF转录因子,具有转录激活活性,定位于细胞核,可调控下游相关基因的表达,能够参与多种转录调控过程。
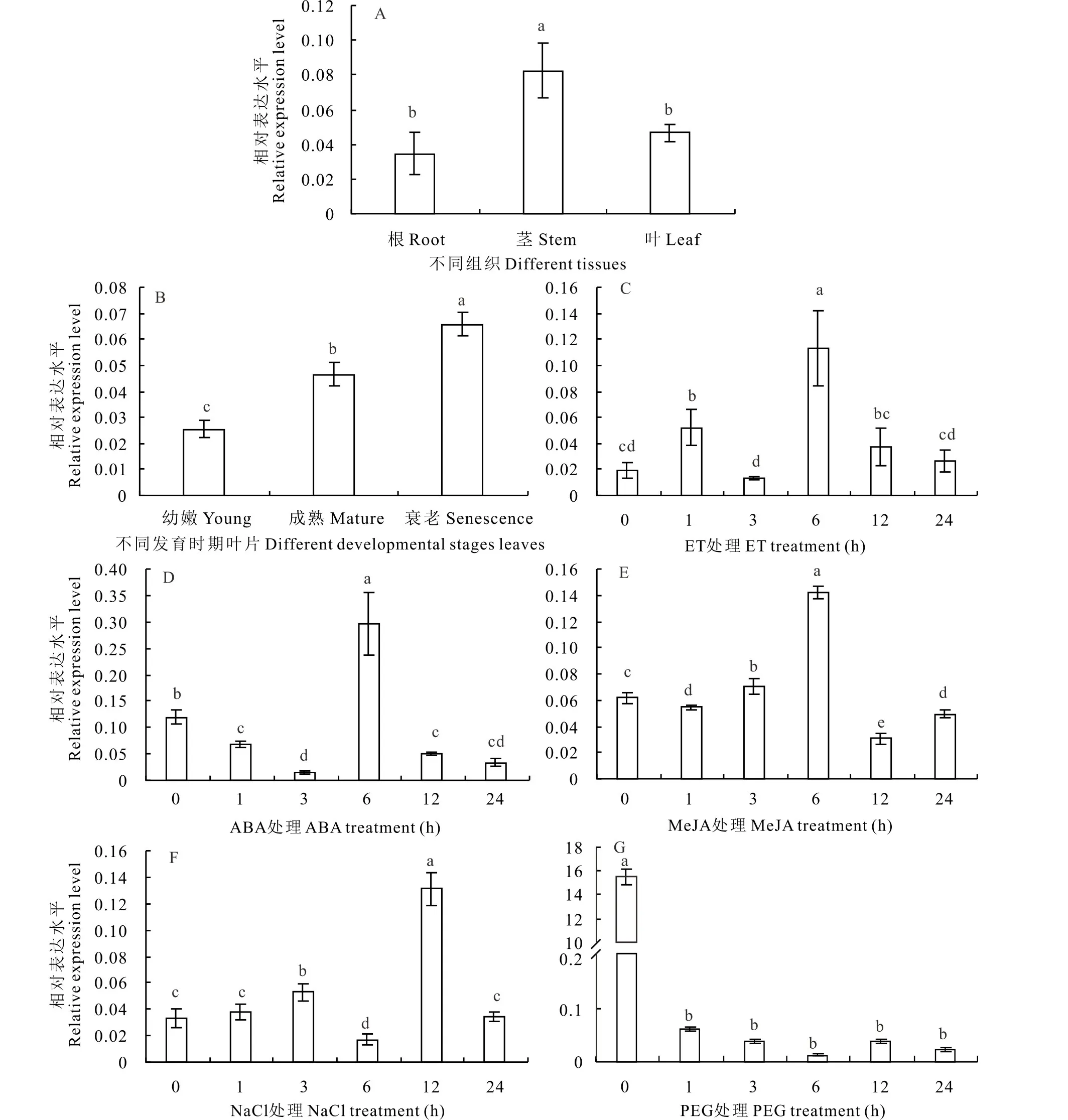
图6 Zj ERF 1表达特征分析Fig.6 Real-time quantitative PCR of Zj ERF1 expression characters
启动子作为基因的组成部分,控制转录起始的过程,它在一定程度上决定了基因表达的时间、部位及强度,启动子的研究是基因表达调控研究的基础[22]。作用元件是RNA聚合酶直接结合的区域,对启动子的活性影响显著[23]。前人研究表明,不同植物中的ERF转录因子可同时响应茉莉酸、脱落酸、非生物胁迫等因素的调节[9,24]。本研究通过染色体步移的方法获得了Zj ERF 1基因ATG上游1581 bp序列,分析发现,该序列上除了含有TA-TA-box、CAAT-box等基本作用元件以外,还存在着多个响应MeJA、ABA和非生物胁迫诱导(干旱、热、冷)的作用元件。据此推断Zj ERF 1是一个非常重要的转录因子,可同时参与激素信号传导和响应非生物胁迫过程,并在其中行使着不同的功能,值得深入开展研究。此外,启动子作用元件分析预测Zj ERF 1可受MeJA等激素和非生物胁迫的调节,为进一步研究ZjERF 1的表达特征提供了依据。
不同组织荧光定量结果显示,Zj ERF 1在根、茎、叶中均有表达,其中茎中的表达量显著高于其在根和叶片中的表达量,这与拟南芥AtRAP 2.6的表达特征一致[24]。不同发育时期的叶片荧光定量结果表明,Zj ERF 1在衰老叶片中的表达量最高,这与菜心BrERF 72的研究结果一致[9]。植物叶片的衰老与乙烯的合成密切相关,而ERF作为乙烯途径中的一个关键转录因子,在叶片衰老过程中发挥着重要功能[25-26]。本研究发现喷施ET可诱导Zj ERF 1的表达,这与ORA 59的表达情况一致[27]。这表明Zj ERF 1可响应乙烯信号,推测可以在乙烯调控的一系列信号转导过程中发挥转录调控功能。研究表明ABA是一种促衰老激素,外源ABA可以诱导衰老相关的基因的表达[28]。本研究发现ABA可调控Zj ERF 1基因的表达,这与拟南芥AtRAP 2.6[24]和柽柳(Tamarix hispida)Th ERF 7[29]的表达情况一致,说明Zj ERF 1可参与ABA调节的叶片衰老过程。菜心中的研究结果表明,BrERF 72可受JA的诱导,并通过直接结合JA合成基因的启动子来调节JA的合成,证明了ERF可参与JA调节的叶片衰老[9]。本研究中发现Zj ERF 1启动子含有多个响应MeJA的作用元件,并且MeJA处理显著诱导ZjERF 1的表达,因此Zj ERF 1可能参与了调控植物衰老的进程,需要进一步的研究挖掘下游靶基因。此外,我们还发现Zj ERF 1的表达在NaCl处理的第12 h急剧升高,这与Th ERF 7的表达情况类似;而Zj ERF 1的表达在PEG处理的24 h内始终表现出受抑制的趋势,与Th ERF 6的情况一致[29]。以上分析说明Zj ERF 1的表达可受多种条件的调控,推测其在激素信号传导和非生物胁迫中发挥着不同的作用。
4 结论
日本结缕草Zj ERF 1基因开放阅读框为630 bp,编码209个氨基酸。保守结构域分析表明,Zj ERF 1属于ERF转录因子家族。同时,通过染色体步移的方法得到Zj ERF 1基因ATG上游1581 bp的启动子序列,该序列含有多个响应MeJA及非生物胁迫的作用元件。转录激活分析表明,Zj ERF1具有较强的转录激活活性。亚细胞定位结果显示,ZjERF1定位于细胞核。荧光定量数据表明,Zj ERF 1在衰老叶片中的表达量最高,且Zj ERF 1的表达受ET、MeJA及盐和干旱处理的调节。本研究表明Zj ERF 1可响应多种因素的调节,并在激素信号传导和非生物胁迫中发挥着不同的作用,为进一步探索Zj ERF 1基因的功能及其转录调控机制奠定了基础。
