不同稀释液中添加十二烷基硫酸钠对吐鲁番黑羊精液冷冻保存的影响
2019-07-17宋玉坤努日比娅姆买买提托合提王旭光刘国世阿布力孜吾斯曼
宋玉坤,张 博,吴 昊,王 辉,郜 宇,努日比娅姆·买买提托合提,赵 茜,王旭光,刘国世,阿布力孜·吾斯曼*
(1.新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2.中国农业大学动物科学技术学院,北京 100193;3.徽商生态牧业有限公司,新疆吐鲁番 838100)
冷冻保存技术作为精液长期保存方法,可以提高种公羊的利用率、隔绝疾病扩散和保种[1],但由于绵羊精子不耐冻,解冻后常常出现精子活率、顶体完整率、受胎率降低等,导致绵羊精液冷冻保存技术未能在生产中广泛推广[2]。绵羊的精液冷冻保存技术研究已取得了许多重要成果,但未得到突破性进展。吐鲁番黑羊是新疆吐鲁番托克逊县农牧民长期自然选育形成的优质地方品种,其对炎热干旱环境适应性强且羔羊肉品质优良[3]。近几年吐鲁番黑羊数量急剧减少,优化吐鲁番黑羊精液冷冻保存技术显得尤为重要。
十二烷基硫酸钠(SDS)是一种表面活性剂,可作为精子冷冻稀释液保护剂。在稀释液中添加SDS 以提高精液冷冻保存效果的研究已在多种动物上开展,解冻后的精液品质得到改善[4-5],而在绵羊精液冷冻稀释液中添加SDS 的研究尚未见报道。本研究比较了在不同稀释液配方Tris-葡萄糖-柠檬酸钠和蔗糖-葡糖糖-柠檬酸钠为基础液中添加不同浓度SDS 对吐鲁番黑羊精液冷冻效果的影响,并与法国卡苏商品化OPtidyl 稀释液做对照,进而筛选出适合吐鲁番黑羊精液冷冻稀释液配方和SDS 添加浓度,为绵羊精液冷冻保存技术的推广及应用提供参考。
1 材料与方法
1.1 实验动物 实验羊为吐鲁番托克逊县徽商生态牧业有限公司的性欲正常、体况健壮、2~4 岁的5 只吐鲁番黑羊种公羊。
1.2 试剂及配制
1.2.1 主要试剂 十二烷基硫酸钠购于法国mofa,青霉素和链霉素购自Amresco 公司,其余药品均采购自Sigma 公司。
1.2.2 稀释液配制 实验采用3 种稀释液,Tris-葡萄糖-柠檬酸钠为I 液,蔗糖-葡糖糖-柠檬酸钠为II 液,法国卡苏商品化OPtidyl 稀释液(REF:020996,500 mL)做对照为III 液。I 液和II 液均为一步法稀释,成分见表1。首先配制基础液,高压消毒后过滤,加20%(v/v)新鲜卵黄,青、链霉素各10 万单位,添加6%(v/v)甘油,配制成冷冻稀释液。III 液为2.5×浓储,用超纯水进行稀释使用。
1.2.3 荧光染料配制 JC-1 为5 mg/mL,生理盐水稀释8 倍后约为1 mmol/mL;PI 为1 mmol/mL,FITC-PNA为0.1 mg/mL。
1.3 精液采集 采用常规的假阴道法采集精液,每只公羊每天采精2 次,采完后迅速送回实验室进行初步的精液品质检查,精液的颜色、气味和密度正常,精子活率在70%以上才可用于实验。将检测合格后的公羊精液混合均匀,放到灭菌试管中备用。
1.4 精液处理 精液常规检查后,在30℃环境下用不同稀释液进行6 倍等温稀释。随即将精液平均分9 份,分别装在15 mL 灭菌离心管中,用3 种冷冻稀释液分别添加不同浓度的SDS(0、1%、2%),共9 管。把精液与稀释液轻轻混匀后分装到0.25 mL 细管中,用封口粉封口,裹上8~10 层纱布放入4℃冰箱,1~1.5 h 后温度降至7~10℃放冰袋降温,3 h 降温至4℃。
1.5 精液冷冻保存 将自制码架置于泡沫盒中,低温温度计探头与码架相连,且探头与细管处于同一高度,往泡沫盒中倒入液氮,使低温温度计显示温度在-80~-120℃,此时码架与液氮面距离约3 cm。将平衡好的细管精液摊放在码架上,熏蒸8 min 后投入液氮。然后装到指型管放到纱布袋内,转移到液氮罐中。
1.6 精液解冻 从液氮罐中取出细管冻精,迅速放到37℃解冻杯中15 s,随后取出细管精液用于样品检测。
1.7 精液品质检测 用微量移液枪取少量平衡后或解冻后的精液滴到精子计数板上,待到精子铺满计数槽,将计数板置于精子分析仪上,用精子分析系统(CASA)进行常规分析。
1.8 精液质膜完整性检测 根据CASA 常规分析后,筛选出在试验组中冷冻复苏后精子活力参数最佳的4组,进行精子的质膜完整性测定。采用HyPo-osmotic swelling test 方法检测精子质膜的完整性,按照精液与低渗液1∶10 的比例37℃混合孵育30 min,孵育结束后取10 μL 滴片,200×相差显微镜下观察,精子尾部形成一个圆环则为精子质膜完整的精子,没有形成圆环的则为质膜损伤的精子。
1.9 精液流式细胞仪检测 选取上述4 个样品,25℃孵育3 h 后离心去除上清液,再用PBS 稀释,每组再取3份十分之一的精液用PBS 稀释至1 000 μL,分别加入PI 和FITC-PNA 用于检测顶体完整率,加入JC-1 用于检测线粒体膜电位(MMP)。其中加入JC-1 后37℃避光孵育30 min,其他处理孵育5 min。孵育完毕后上流式细胞仪检测。
1.10 统计分析 数据采用Excel 2016 进行整理,SPSS 23.0 软件进行t 检验和方差分析,结果均采用平均值±标准差。每组数据重复6 次实验以上。
2 结 果
2.1 不同稀释液添加SDS 对精液冷冻前后运动形态的影响 如表2 所示,各组之间在平衡后活力、畸形率、直线运动速率差异不显著。冷冻后I 液1% SDS 组精子活率最高,与I 液2% SDS 组精子活率无差异,显著高于其他7 组。冷冻后III 液1% SDS 组畸形率显著低于II液0% SDS 组、II 液2% SDS 组 和III 液2% SDS 组,与其他组差异不显著。冷冻后I 液1% SDS 组的直线运动速率最高,显著高于I 液0% SDS 组、II 液2% SDS组和III 液0% SDS 组,与其他组差异不显著。综合形态运动指标,I 液1% SDS 组、I 液2% SDS 组、II 液1%SDS 组和III 液1% SDS 组精液冷冻效果较好,可作进一步检测以确定最优冷冻配方。
2.2 不同稀释液添加SDS 对精液冷冻后质膜完整性的影响 表3 显示,I 液1% SDS 组质膜完整率显著高于I液2% SDS 组和II 液1% SDS 组,与III 液1% SDS 组无显著差异。
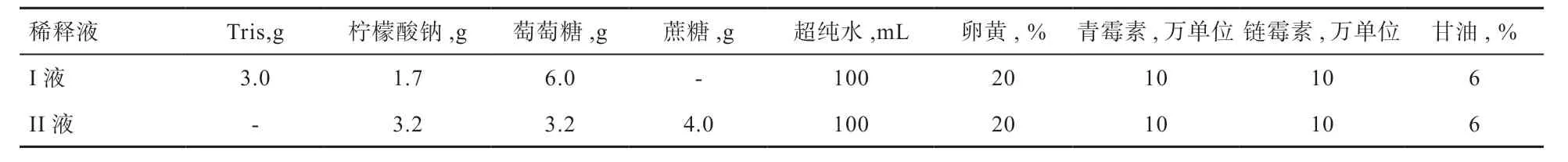
表1 吐鲁番黑羊精液冷冻稀释液成分
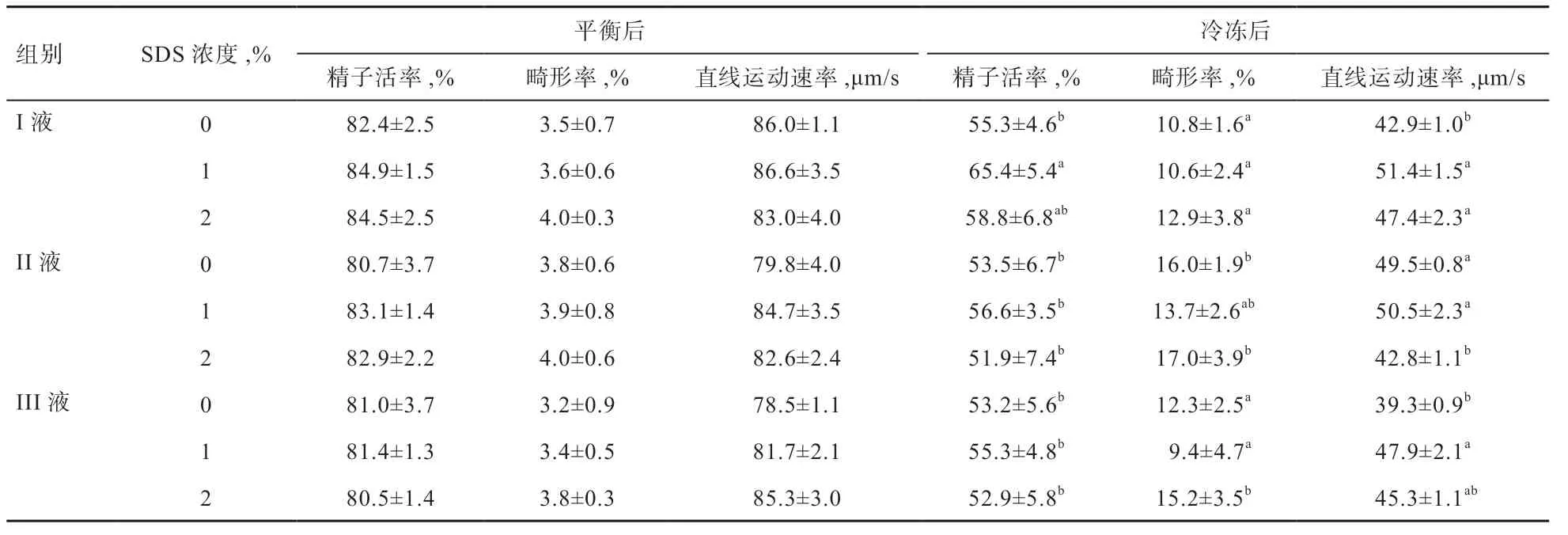
表2 不同稀释液添加SDS 对精液冷冻前后形态运动的影响

表3 不同稀释液添加SDS 对精液冷冻后质膜完整性的影响(n=6) %
2.3 不同稀释液添加SDS 对精液冷冻后顶体完整率的影响 如表4 所示,I 液1% SDS 组的顶体完整活精子比率显著高于II 液1% SDS 组,与其他2 组没有显著差异。各组的活精子顶体完整率没有显著差异。I 液1% SDS组的顶体完整率与III 液1% SDS 组无显著差异,但高于I 液2% SDS 组和II 液1% SDS 组(P<0.05)。
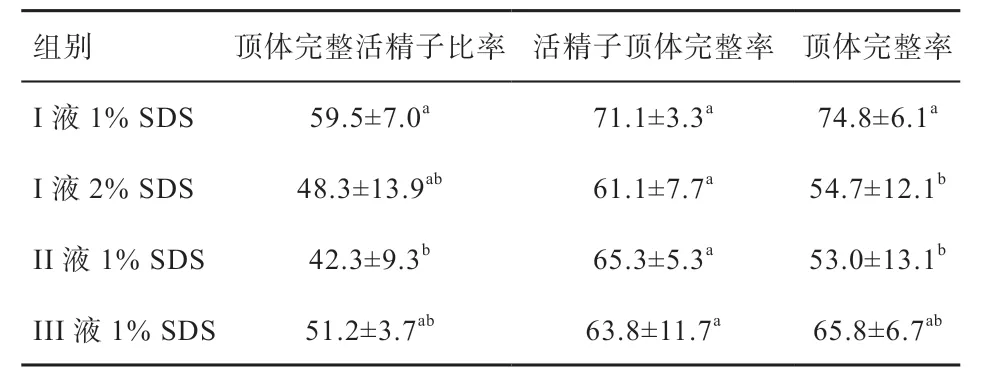
表4 不同稀释液添加SDS 对精液冷冻后顶体完整率的影响(n=6) %
2.4 不同稀释液添加SDS 对精液冷冻后线粒体膜电位的影响 由表5 可知,I 液1% SDS 组高线粒体膜电位精子比率显著高于II 液1% SDS 组,与其他2 组没有显著差异。

表5 不同稀释液添加SDS 对精液冷冻后线粒体膜电位的影响(n=6) %
3 讨 论
3.1 冷冻稀释液对吐鲁番黑羊精液冷冻效果的影响 精液冷冻稀释液主要作用是改善精子外环境的渗透压与pH,防止精子细胞内成分流失,为精子运动提供能量,降低高度稀释对精子产生的损伤并起到冷冻保护作用,给精子适应外界环境创造有利条件[6]。从发现甘油可以作为冷冻保护剂之后,畜禽精液冷冻技术的研究和应用工作广泛开展[7]。由于冷冻过程中带来的机械损伤,冷冻解冻后的精液仍有部分精子死亡和失去运动能力[8]。因此,冷冻后精子活率和膜结构完整性对解冻复苏后的受精能力至关重要[9],所以人们一直在探索有效的稀释液成分来提高冷冻效率。目前研究报道,Tris 具有良好的渗透性和缓冲性,并且添加适量浓度时对精子毒性较低,冷冻稀释液中添加Tris 能提高精子活力以及顶体完整率[10]。绵羊的精液具有相对较高代谢水平的特殊性,在有氧环境下可以致使精子氧化导致中毒死亡[11]。葡萄糖、果糖、蔗糖以及乳糖等均可通过提高冷冻复苏后质膜稳定性保护精子[12-13]。非渗透性保护剂蔗糖可与精子质膜直接发生反应,降低冷冻过程中冰晶对精子造成的损伤[14]。本实验表明,添加相同浓度的SDS 时,Tris-葡萄糖-柠檬酸钠冷冻稀释液冷冻-解冻后精子活率最高,精子畸形率和运动速率也均优于蔗糖-葡糖糖-柠檬酸钠和OPtidyl 稀释液组。3 种稀释液添加1%SDS时,Tris-葡萄糖-柠檬酸钠组在质膜完整性、顶体完整率和高线粒体膜电位上显著优于蔗糖-葡糖糖-柠檬酸钠组,与OPtidyl 稀释液组没有显著差异。造成I 液和II 液效果差异性的原因在于Tris 是渗透性保护剂,使精子能更好地耐受低渗和高渗;而蔗糖是非渗透性,当稀释液的渗透压和pH 不稳定时,可能就会造成精子的损伤以及死亡。
3.2 添加SDS 对吐鲁番黑羊精液冷冻效果的影响 SDS主要作用是防止低温对精子的机械损伤,对精子膜结构有保护、修补作用,能够显著提高冷冻解冻后精子活率、顶体完整率及质膜完整率[15]。在稀释液中添加卵黄可以维持稀释液的胶体渗透压,保护精子质膜完整性和顶体膜减缓阳离子肽造成的损伤[16]。SDS 与卵黄类脂协同完成对质膜及顶体膜结构的保护,减少顶体内营养物质的渗透和流失[17]。本实验结果表明,在3 种冷冻稀释液中添加1%SDS 时,精液冷冻解冻后的精子活率、畸形率和直线运动速率均显著优于不添加SDS 组和添加2%SDS 组;Tris-葡萄糖-柠檬酸钠冷冻稀释液添加1% SDS 组质膜完整性和顶体完整率较2%SDS 组均显著提高,添加1%SDS 组的高线粒体膜电位精子比率与2%SDS 组没有显著差异,但有提高趋势。SDS 是一种对细胞微毒的阴离子表面活性剂,当添加2%SDS 时,过量的SDS 容易对精子造成损伤,进而降低冷冻效果,所以II 液和III 液中添加2%SDS 解冻后精子活率低于不添加和添加1%SDS 组。综合各指标,在稀释液中添加1%SDS 对绵羊精液冷冻效果最佳,这与李新红等[18]在蓝狐冷冻稀释液中添加SDS 时所得的结果相似。在绵羊冻融精子保护效果方面,SDS 与卵黄之间的剂量存在相关性,二者之间充分混合后具有协同作用。SDS 起的保护作用可能是通过卵黄间接实现的,经过SDS 乳化后的卵黄,分解出卵黄中更多的类脂物,这些类脂物更易进入精子质膜,从而更有效保护冻融精子的膜结构。
4 结 论
本实验条件下,在Tris-葡萄糖-柠檬酸钠冷冻稀释液中添加1% SDS 可以显著提高吐鲁番黑羊的精液冷冻保存效果。
