水牛KDM1A/LSD1 基因的克隆分析及真核表达载体的构建
2019-07-17沈朋雷石德顺陆凤花
赵 鑫,俸 云,沈朋雷,石德顺,陆凤花
(广西大学动物科学技术学院,亚热带农业生物资源保护与利用国家重点实验室,广西南宁 530004)
体细胞核移植技术(Somatic Cell Nuclear Transfer,SCNT)在科研、动物育种、转基因动物生产、濒危动物保护、医疗等领域具有非常广阔的应用前景,但极低的克隆效率严重限制了该技术的发展和应用[1]。研究表明,克隆胚胎发育过程中出现的表观遗传修饰异常,是导致克隆胚胎发育效率低下的最主要原因[2],其中组蛋白修饰中的组蛋白甲基化异常是主要因素之一。组蛋白甲基化修饰会在异染色质形成,基因表达调控以及X 染色体失活等过程中发挥作用[3-4]。一般情况下,组蛋白甲基化修饰存在于组蛋白H3/H4 位点N 端的Lysine 和Arginine上,不同的组蛋白甲基化形式对基因表达起到不同的调控作用[5]。其中克隆胚胎中频繁发生的组蛋白H3K4、H3K9 甲基化异常,是导致克隆胚胎发育失败的原因之一[6]。而KDM1A 也被称为LSD1,是最早被发现的组蛋白去甲基化酶[7],属于黄素腺嘌呤二核苷酸依赖酶[8-9],由Tower、SWIRM 和胺氧化酶3 种结构域组成,能够在组蛋白H3K4me/me2 和H3K9me/me2 的调控过程中发挥作用[8-10]。另外,有研究发现,敲除KDM1A 会导致卵母细胞的纺锤体发生损伤,进而影响胚胎的早期发育;还会引起组蛋白H3K9me3 异常升高,表明KDM1A 在卵母细胞发育、受精、组蛋白甲基化调控等方面发挥了关键作用[11]。同时,KDM1A 还被证明对DNA 甲基转移酶Dnmt1 的稳定性以及干细胞的多能性产生影响[12]。以上研究结果都强烈暗示了KDM1A 在表观遗传修饰调控过程中的重要性。
尽管KDM1A 被发现已多年,但关于水牛KDM1A基因的研究目前鲜有报道。故本研究拟对水牛KDM1A基因进行克隆分析,并构建真核表达载体,为进一步研究KDM1A 在水牛SCNT 胚胎发育过程中发挥的作用提供基础。
1 材料与方法
1.1 实验材料 本实验所用水牛卵巢购买自南宁市某屠宰场,卵巢离体后立刻保存于液氮,用于RNA 的提取。pcDNA3.1(+)骨架载体和水牛耳部成纤维细胞(BFFs)由广西大学亚热带农业生物资源保护与利用国家重点实验室提供。
1.2 主要试剂 TRIzol Reagent 购买自Invitrogen 公司;反转录试剂盒HiScript II 1st Strand cDNA Synthesis Kit,基因克隆试剂盒2×Phanta Master Mix,载体构建试剂盒ClonExpress Ultra One Step Cloning Kit,实时荧光定量PCR(Real-Time Quantitative PCR,RT-qPCR)试 剂ChamQ Universal SYBR®qPCR Master Mix 均购买 自 诺 唯赞生物科技有限公司;去内毒质粒提取试剂盒Endo-Free Plasmid Mini Kit 和胶回收试剂盒E.Z.N.A Gel Extraction Kit 购买自OMEGA 公司;感受态细胞购买自全式金生物科技有限公司;限制性内切酶Xho I 购买自日本TaKaRa公司;细胞转染试剂ViaFect ™ 购买自美国Promega 公司。其他试剂均参考《分子克隆与实验指南》进行配制。
1.3 引物设计与合成 参考NCBI 上已公布的水牛KDM1A 序列信息(登录号:XM_025278755.1),使用Oligo 6.0 软件设计引物并交由上海生工生物科技有限公司进行合成,具体信息如表1 所示。
1.4 RNA 提取和第1 链cDNA 的合成 使用TRIzol Reagent提取水牛卵巢和BFFs 的总RNA,使用分光光度计和琼脂糖凝胶电泳检测RNA 的纯度和完整性,符合要求后立刻使用HiScript II 1st Strand cDNA Synthesis Kit 进行第1 链cDNA 的体外合成,反应体系:4×gDNA Wiper Mix 4 μL,RNA 模 板500 ng,RNase free H2O 补 足16 μL,吹打混匀后PCR 仪中42℃孵育2 min;加入5×HiScript II qRT SuperMix II 4 μL,50℃孵育15 min,85℃反应5 s,获得cDNA。产物保存于-20℃冰箱备用。
1.5 水牛KDM1A 片段的克隆 以水牛卵巢cDNA 为模板,使用试剂盒2×Phanta Master Mix 进行KDM1A 片段的扩增。参照试剂说明书,设计反应体系:2×Phanta Master Mix 25 μL,10 nmol/L 上、下游 引 物 各2 μL,cDNA 模 板5 μL,RNase free H2O 补 足50 μL。PCR 扩增程序:95℃预变性30 s;95℃变性10 s,60.5℃,15 s,72℃延伸2 min,循环数为25;72℃延伸5 min 后保存于4℃。反应完成后使用琼脂糖凝胶电泳检测扩增产物的片段大小,确认无误后使用E.Z.N.A Gel Extraction Kit进行目的片段的回收。回收产物保存于-20℃冰箱备用。
1.6 单酶切 使用单酶切的方法线性化骨架载体pcDNA3.1(+)。酶切反应体系:pcDNA3.1(+)载体1 μg,限制性内切酶Xho I 1 μL,反应缓冲液10×Reaction Buffer H 2 μL,RNase free H2O 补足20 μL。PCR 仪中37℃孵育1 h,酶切完成后使用E.Z.N.A Gel Extraction Kit 回收目的片段。回收产物保存于-20℃冰箱备用。
1.7 连接、转化与测序 使用ClonExpress Ultra One Step Cloning Kit 进行目的片段与载体的连接。连接反应体系:将目的片段与线性化载体按照0.06 pmol∶0.03 pmol 的比例混合,加入4 μL 的5×CE Buffer 和2 μL 的Exnase II,RNase free H2O 补足20 μL。PCR 仪中37℃孵育30 min,连接完成后立刻将连接产物转化入感受态细胞,再将菌液涂布于含氨苄青霉素(Amp+)的LB 固体平板上,置于37℃生化培养箱中过夜培养。菌落长出后挑取单个菌落并置于含Amp+的LB 肉汤中,置于37℃摇床中过夜培养。菌液长出后提取质粒并电泳检测质粒大小,符合预期后将质粒送至广州华大生物科技有限公司进行测序鉴定。
1.8 生物信息学分析 使用DNAStar 软件中的MegAlign程序测序比对序列的同源性;使用DNAMAN 软件比对预测编码的氨基酸序列;使用MEGA 6.0 软件构建系统进化树;使用在线程序EXPASY(https://web.expasy.org/protparam/)预测编码蛋白的氨基酸组成、等电点、相对分子质量等;使用DNA star 软件中的Protean 程序预测水牛KDM1A 蛋白的二级结构;最后再使用在线 程 序I-TASSER(https://zhanglab.ccmb.med.umich.edu/I-TASSER/)预测水牛KDM1A 蛋白的三级结构。
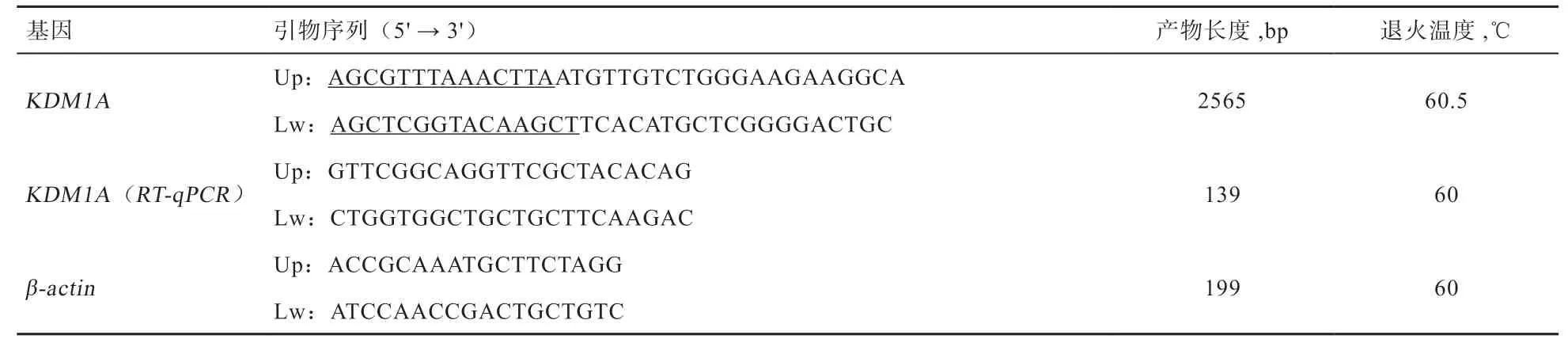
表1 PCR 扩增序列引物
1.9 细胞转染 参考转染试剂ViaFect ™的说明书,将pcDNA3.1(+)-KDM1A转染进BFFs,并将转染pcDNA3.1(+)空载体和未转染组设为对照组。
1.10 实时荧光定量PCR 转染48 h 后提取细胞RNA并将其逆转录为cDNA,再使用RT-qPCR 技术对BFFs中KDM1A 基因的表达水平进行检测。以转染后细胞cDNA 为模板,转染pcDNA3.1(+)空载体和未转染组为对照,β-actin 为内参,使用ChamQ Universal SYBR®qPCR Master Mix,对KDM1A 的表达水平进行测定。反应体系:10 μL 的2×ChamQ Universal SYBR®qPCR Master Mix,0.4 μL 上、下 游 引 物,1 μL 的cDNA,RNase-free H2O 补足20 μL。反应程序:95℃预变性30 s,95℃变性10 s,退火延伸60℃,30 s,反应40 个循环;熔解曲线反应程序为95℃,15 s;60℃,30 s ;95℃,15 s;反应40 个循环。每个样品至少重复3 次,反应结束后使用2-ΔΔCt法对基因的表达情况进行计算。另外,为了研究KDM1A 在水牛GV 期和MII 期卵母细胞中的表达模式,本研究又提取了水牛GV 期和MII 期卵母细胞的cDNA,以BFFs 的cDNA 为对照,运用相同的实验方法对其进行检测。
1.11 统计分析 本实验使用SPSS 17.0 软件,利用其单因素方差分析中的Tukey 检验对数据进行统计学分析,P<0.05 表示差异显著,P>0.05 表示差异不显著。
2 结 果
2.1 水牛KDM1A 编码区的克隆与鉴定 如图1 所示,所提卵巢总RNA 中5S、18S 和28S 条带清晰,结构完整且降解少,可以用于后续实验。随后使用RT-PCR 法扩增水牛KDM1A 基因序列,扩增片段大小与预期一致(图2)。
2.2 水牛pcDNA3.1(+)-KDM1A 真核表达载体的构建利用同源重组技术将上一步中克隆得到的KDM1A 基因片段与线性化的pcDNA3.1(+)骨架载体进行连接并使用琼脂糖凝胶电泳检测其片段大小。如图3 所示,片段大小符合预期。
2.3 水牛KDM1A 基因的序列的生物信息学分析 如图4所示,扩增得到的水牛KDM1A 片段编码区长2 625 bp,预测编码874 个氨基酸。如图5 所示,水牛KDM1A 基因与黄牛、山羊、绵羊、猪、猫、马、犬、黑猩猩的同源性分别为98.9%、97.8%、97.7%、94.0%、93.6%、93.4%、93.3%、93.0%。如图6 所示,水牛与黄牛序列聚为一支,并与绵羊、山羊等哺乳动物的遗传距离相对较近,所得进化树与动物分类学之间存在较高的一致性。
2.4 水牛KDM1A 蛋白的生物信息学分析 如图7 所示,水牛KDM1A 在各个物种间具有较高的保守性。使用EXPASY 服务器对水牛KDM1A 蛋白理化性质进行预测显示,该蛋白质的化学分子式为C2375H3855N805O776S24,理论分子质量为56 872.11,等电点为10.3,呈碱性。预测由874个氨基酸组成,其中丙氨酸的含量最高(17.3%),甘氨酸次之(13.3%),半胱氨酸和色氨酸的含量最低(1.6%)。如图8 所示,蛋白二级结构包含α 螺旋19 个,β 折叠47个,T 转角25 个以及数个无规则卷曲。如图9 所示,在水牛、黄牛、人3 个物种之间,水牛和牛KDM1A 蛋白具有较高的相似性。
2.5 水牛pcDNA3.1(+)-KDM1A 真核表达载体的效率验证 如图10 所示,转染48 h 后,与对照组相比,BFFs 中KDM1A 的表达水平显著升高。
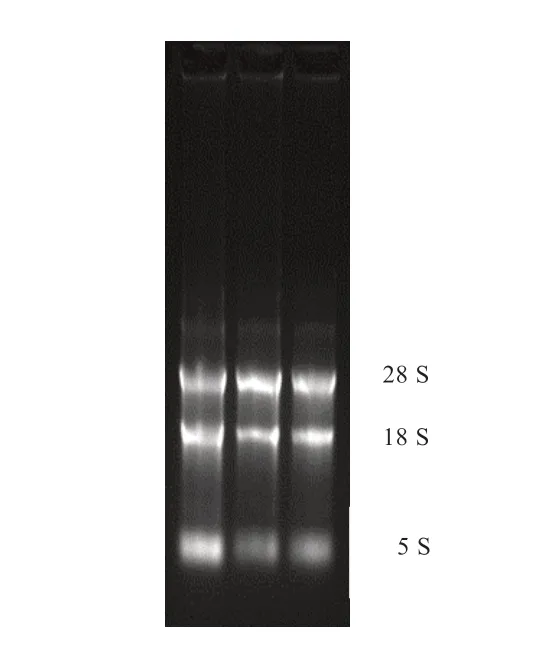
图1 总RNA 电泳图
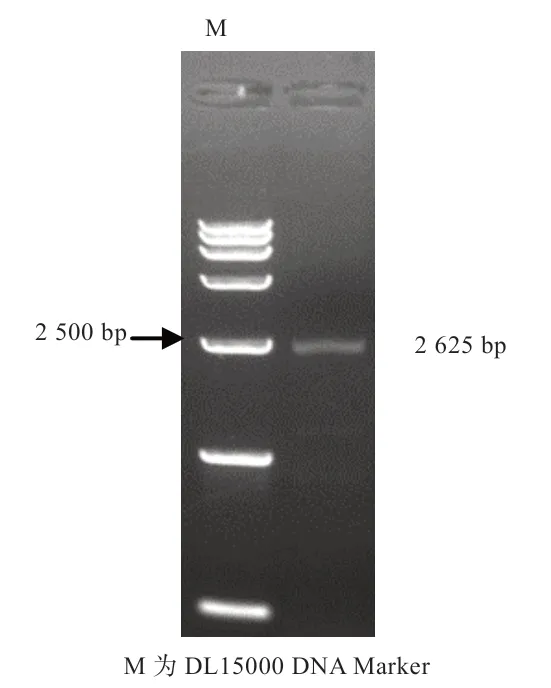
图2 水牛KDM1A 基因片段扩增
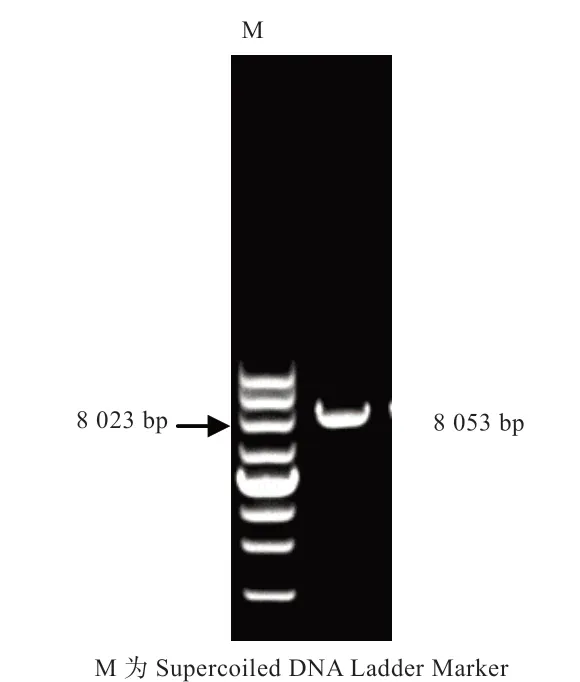
图3 pcDNA3.1(+)-KDM1A
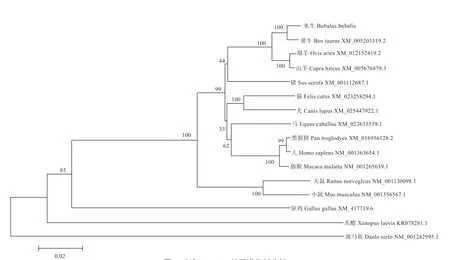
图6 水牛KDM1A 基因进化树分析

图7 水牛与其他物种KDM1A 氨基酸序列比对
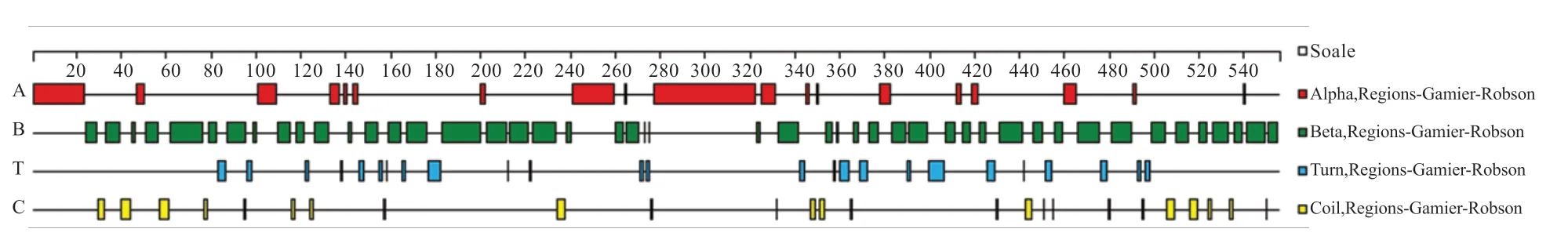
图8 水牛KDM1A 蛋白质二级结构预测
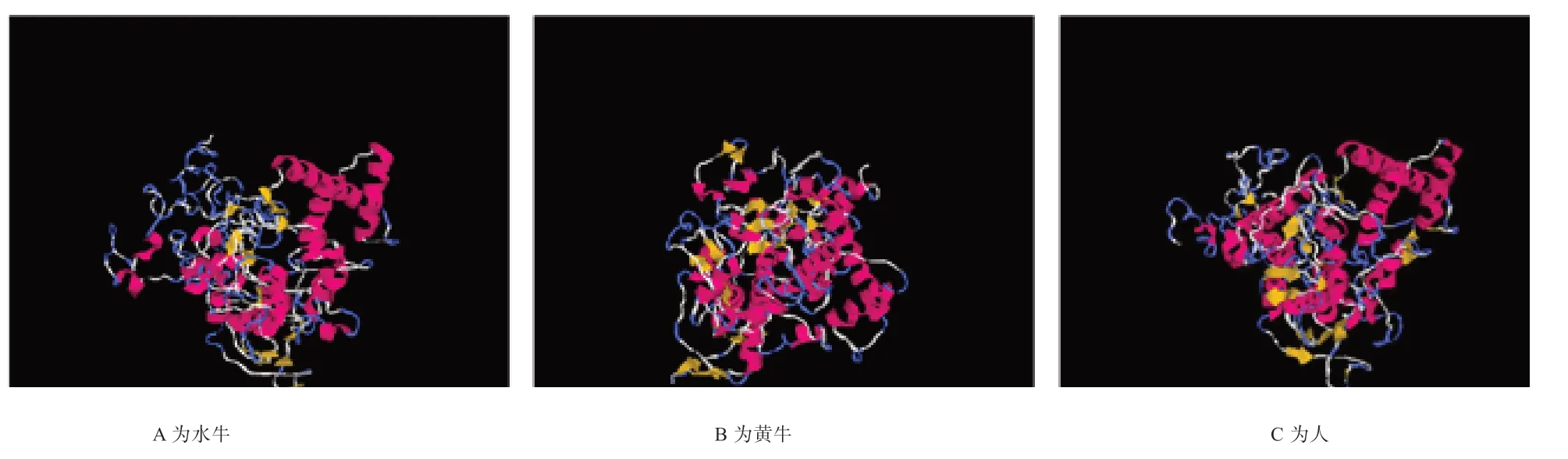
图9 水牛与其他物种的KDM1A 蛋白质高级结构预测
2.6 KDM1A 基因在水牛不同时期卵母细胞中表达水平的检测 如图11 所示, KDM1A 在水牛GV 期和MII 期卵母细胞中的表达水平均要高于BFFs(P<0.05)。
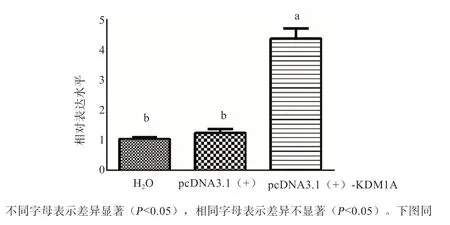
图10 转染pcDNA3.1(+)-KDM1A后KDM1A 的相对表达水平
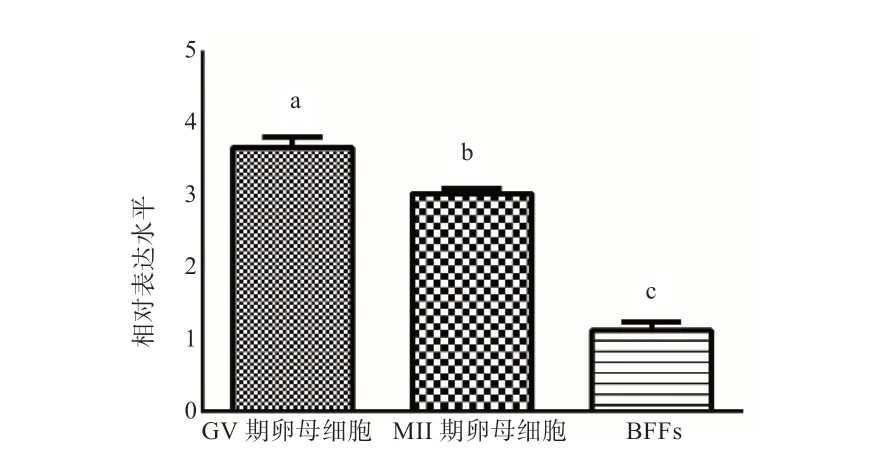
图11 KDM1A 在水牛GV 期/MII 期卵母细胞中的表达模式
3 讨 论
KDM1A 是赖氨酸特异性去甲基化酶家族的成员之一,在催化组蛋白H3K9me/me2 去甲基化的过程中发挥了巨大作用。目前已经证明,组蛋白H3K9 的甲基化状态是影响克隆效率的关键因素之一[6]。下调克隆胚胎中组蛋白H3K9 的甲基化水平,可以提高多能基因Oct4、Sox2 和Nanog 的表达水平,从而提高克隆胚胎的发育效率[13]。为了对水牛KDM1A 基因进行初步了解,本研究首先对水牛KDM1A 进行了克隆分析,获得2 625 bp 的水牛KDM1A 编码区片段。通过进行生物信息学分析可知,水牛KDM1A 基因在各物种间的同源性较高;再结合进化树结果进行分析,表明KDM1A 符合各个物种之间的进化规律。另外,其编码的蛋白在各个物种间也具有较高的相似性。此外,仅从预测所得的氨基酸二级结构并不能对KDM1A 蛋白进行一个全面的预测。蛋白三级结构预测结果表明,水牛、黄牛和人的KDM1A 蛋白存在一定的相似性。综合基因和蛋白分析发现,KDM1A 在多个物种中具有较高的保守性,推测其可能在哺乳动物体内发挥了关键的调控作用。
有研究表明,KDM1A 能够通过调控甲基化的水平来发挥其转录抑制作用[8,14]。通过使用敲除技术发现,KDM1A 蛋白可以与细胞内的AREs 元件相结合,从而诱导组蛋白H3K9 的去甲基化[15]。另外,KDM1A 还能够通过与HKMT 复合体中的HCF-1 相结合,从而下调组蛋白H3K9 的甲基化水平[16]。这些研究表明,KDM1A 是通过一套复杂的调控系统对组蛋白甲基化水平产生调控作用。此外,KDM1A 也参与了神经细胞中自噬以及癌细胞的调控[17-18]。除了在调控组蛋白甲基化过程中发挥了重要作用外, KDM1A 基因在卵母细胞发育的整个过程中均有表达,单细胞测序结果显示KDM1A 缺失会导致卵母细胞纺锤体损伤、发育阻滞、合子基因激活异常等现象,进而引起早期胚胎的死亡[11]。另外,KDM1A 基因也参与了早期胚胎中的母源-合子基因转化[19]。本研究发现,KDM1A 基因在卵母细胞中均呈现高表达状态,且GV 期的表达水平要显著高于MII 期。这不仅暗示了KDM1A 是一个关键的母源因子,由此还推测KDM1A 很有可能在卵母细胞成熟、发育以及早期胚胎发育的调控过程中发挥了重要作用。鉴于KDM1A 在正常生理调控中发挥了关键作用,但其在水牛克隆胚胎的调控过程中的作用鲜有研究。本研究构建了水牛KDM1A 的真核表达载体pcDNA3.1(+)-KDM1A。随后将该载体转染进入BFFs 中,48 h 后对其表达调控能力进行检测,结果显示转染后BFFs 中KDM1A 基因的表达水平显著上调。这一研究结果为后续研究其在克隆胚胎中的功能提供了研究基础。
4 结 论
本研究克隆得到水牛KDM1A 基因序列全长2 625 bp,预测编码874 个氨基酸;水牛KDM1A 与其他物种同源性较高且与生物分类学保持一致;构建了水牛pcDNA3.1(+)-KDM1A 真核表达载体,转染pcDNA3.1(+)-KDM1A可以显著提高水牛耳部BFFs 中KDM1A 的表达水平,且卵母细胞中KDM1A 的表达水平显著高于BFFs。
