CuFe2O4/改性活性炭磁性复合材料表征及其吸附性能
2019-07-17张佳丽罗忆婷李秉轩罗文波刘志雄
张佳丽,罗忆婷,李秉轩,罗文波,刘志雄
(1.吉首大学物理与机电工程学院,吉首 416000;2.吉首大学,湖南省211计划锰锌钒工业技术协同创新中心,吉首 416000;3.吉首大学,化学国家级实验教学示范中心,吉首 416000)
1 引 言
印染废水具有成分复杂、色度高、生物难以降解,具有致突变性和致癌性等特点,对生态环境人类健康构成严重的危害[1-3]。罗丹明(Rhodamine B,Rh B)作为典型的有机染料,广泛应用于印刷,纺织印染,皮革和油漆等行业,已成为污水处理的一个难点,是水体的主要的污染源之一[4]。去除Rh B的主要方法有:膜分离法[5]、混凝沉淀法[6]、离子交换法[7〗、化学氧化法[8]、好氧和厌氧微生物降解法[9]和吸附法[10]等。其中吸附法是一种高效处理含染料废水的常见方法,具有操作方便和低成本等优势[10-11]。
活性炭(AC)具有多孔结构和高比表面面积,是一种吸附性能较好和成本廉价的吸附剂[12-13],但分离吸附剂过程存在过滤器易堵塞、碳损失和耗量大,且容易产生二次污染[14],这些缺陷使AC的应用受到一定程度地影响。
磁性分离是一种快速且有效的分离技术,在废水处理中的研究与应用受到关注[15-16]。在磁性铁氧体中Fe3O4在潮湿的空气或高温环境中易被氧化而失去磁性[16],而磁性材料CoFe2O4的合成原材料钴的价格高且是潜在致癌物质[17];CuFe2O4具有适中的饱和磁化强度、优良的化学稳定性和较好机械强度等特点,也可避免同类型磁性材料的原料价格高和来源少的不足。因此结合CuFe2O4强磁性和活性炭良好吸附性能的优点,拟合成CuFe2O4-活性炭复合材料新型吸附剂。
为了提高活性炭的吸性能及强化活性炭与CuFe2O4结合能力,先酸性氧化得改性活性炭,尝试合成CuFe2O4/MAC复合材料,并研究其吸附脱除水体中的Rh B及其吸附机理。
2 实 验
2.1 试剂与仪器
硝酸铜、硝酸铁、硝酸、活性炭(AC)、硫酸、氢氧化钠、罗丹明B、乙醇、NaOH、均为分析纯,购买于国药集团化学试剂有限公司。实验用水为高纯水。
DF-101S型恒温磁力搅拌器(郑州宝晶电子科技有限公司),JA5003电子天平(上海舜宇恒平科学仪器有限公司),SHA-C型恒温水浴振荡仪(上海昕仪仪器仪表有限公司),SHZ-D循环水式真空泵(上海科兴仪器有限公司),DZF-6050型真空干燥箱(巩义市予华仪器有限公司)和PHS-3C型pH计(上海三信仪表厂) 。
2.2 方 法
2.2.1 吸附剂的制备
活性炭的氧化改性: 在圆底烧瓶中加入5 g活性炭和70 mL质量浓度为20% HNO3,超声处理30 min,然后在水浴锅中搅拌加热回流氧化3 h;反应完毕,固液抽滤分离、滤饼水洗至中性,在80 ℃下干燥12 h,得到改性活性炭(MAC)。
CuFe2O4/MAC的合成: 参考文献[14]采用化学沉淀法合成CuFe2O4/活性炭磁性复合材料。
在未加改性活性炭的条件下,CuFe2O4磁性材料合成同上述方法。
2.2.2 吸附性能实验
取一定pH值和质量浓度的 Rh B溶液100 mL置于250 mL的烧瓶中,加入100 mg CuFe2O4/MAC(质量比1∶1)磁性复合材料作吸收剂,放入振荡器中振荡吸附一定时间,用磁铁将CuFe2O4/MAC与溶液分离,取上清液,并用紫外可见光分光光度计测定Rh B的质量浓度,计算磁性复合材料对 Rh B的吸附量,计算公式如下:
(1)
式中C0为Rh B溶液初始质量浓度(mg/L),Ct为吸附时间t时Rh B溶液的质量浓度(mg/L),qt为吸附量(mg/g),V为溶液体积(L),m为吸附剂的质量(g)。
2.2.3 解吸附和再吸附实验
将100 mg CuFe2O4/MAC加入到100 mL 的150 mg/L 的Rh B 水溶液中,30 ℃下振荡至吸附平衡,用磁铁分离CuFe2O4/MAC,取上清液,运用紫外可见光分光光度计上测定Rh B浓度;将分离后的CuFe2O4/MAC磁性材料用甲醇/乙酸(体积比为9∶1)混合液进行索氏提取,直到紫外可见光度计检测不出Rh B分子为止,测定洗脱液中Rh B的浓度。将洗脱处理后的CuFe2O4/MAC再加入150 mg/L的Rh B水溶液中, 再次进行平衡吸附。重复上述实验多次, 测定CuFe2O4/MAC循环次数对吸附性能的影响。
2.2.4 材料表征
将材料样品经KBr压片后,运用Nicolet IS10傅里叶变换红外光谱仪测定结构;将干燥材料样品运用SIGMA HD扫描电子显微镜测定其形貌结构;运用X'pert MPD Pro型X射线衍射仪鉴定材料的物相组成;运用美国Lakeshore 7407振动样品强磁计检测材料的磁化强度;采用比表面微孔分析仪3H-2000 PM2测定样品的比表面面积。
3 结果与讨论
3.1 材料表征分析
图1为改性活性炭、CuFe2O4、CuFe2O4/MAC的XRD图。从图1可知:合成的CuFe2O4存在尖晶石型结构的CuFe2O4(JCPDS No. 770010)和CuO的衍射峰;而CuFe2O4/MAC磁性复合材料中不仅出现了CuFe2O4和CuO的衍射峰,而且出现了Cu2O的衍射峰,这是改性活性炭中的碳原子和还原性基团还原CuO为Cu2O[18]。
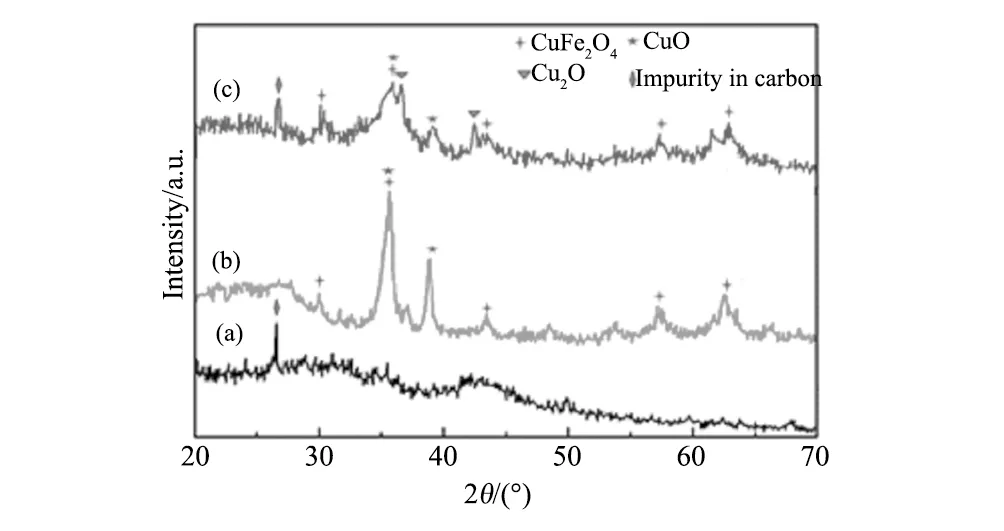
图1 (a)改性活性炭, (b)CuFe2O4和(c)CuFe2O4/MAC(mass ratio 1∶1) composite的XRD图Fig.1 XRD patterns of (a) MAC, (b)CuFe2O4 and (c)CuFe2O4/MAC(mass ratio 1∶1) composite
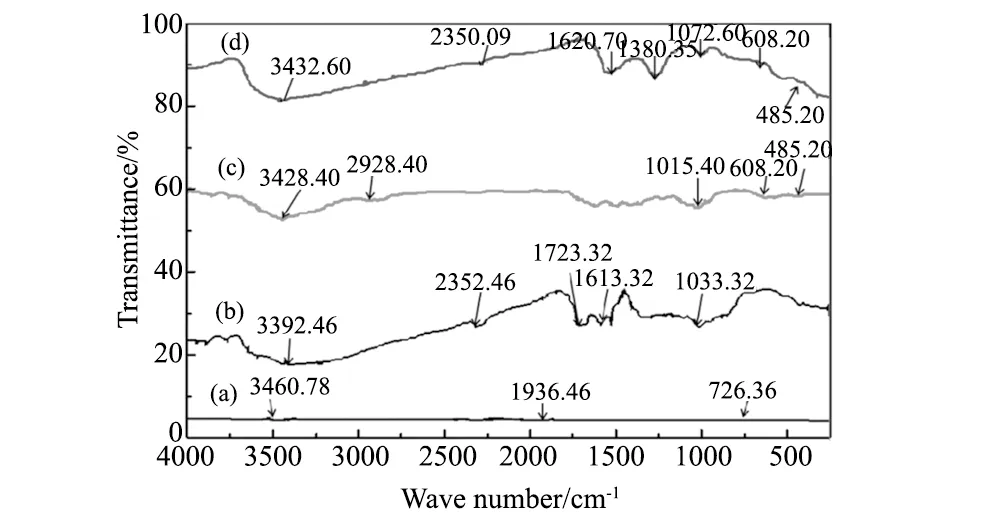
图2 (a)活性炭, (b)改性活性炭, (c)CuFe2O4 and (d)CuFe2O4/MAC (1∶1)的FTIR谱图Fig.2 FTIR spectra of (a)AC, (b)MAC, (c)CuFe2O4 and (d)CuFe2O4/MAC (1∶1)
图2为AC、MAC、CuFe2O4和CuFe2O4/MAC磁性复合材料的红外谱图。从图2可知:AC中没有发现显著的吸收峰值(图2(a))。MAC和CuFe2O4/MAC复合材料在3400 cm-1和1620 cm-1(图2(b)和(d))出现了伸缩振动吸附峰。MAC中其它不同类型氧的吸收峰见图2(b)。CuFe2O4/MAC(图3d)在1380 cm-1处的吸收峰应归属于C=O伸缩振动峰,在1072 cm-1处的吸收峰归属于环氧基和烷氧基中的C-O伸缩振动峰,表明在改性活性炭中存在羧基,环氧基和烷氧基。CuFe2O4/MAC磁性复合材料的红外谱图在608 cm-1和485 cm-1处观测到振动吸收峰,分别为Fe-O和 Cu-O的特征伸缩振动峰,同时在1380 cm-1处出现新的振动吸收峰,证实了CuFe2O4磁性粒子成功地固定在MAC上,且二者发生了键合作用。
图3为AC、MAC、CuFe2O4和CuFe2O4/MAC(质量比1∶1)的SEM图。图3表明AC和MAC的表面形貌呈现“蜂窝”状,具有大量微孔,有堆叠现象;AC的SEM图(图3a表明AC的小孔分布不均,且孔径大小不一,而MAC的SEM图(图3b)呈立体空间网格“蜂窝”状,小孔分布相对均匀,孔径明显增大。CuFe2O4的SEM图(图3c图表明产物呈片层状堆积,具有类“细胞膜”的结构,表面有许多褶皱,一个个小的球形状颗粒镶嵌于片层状“细胞膜”中,粒径分布在50~400 nm区间,颗粒间有团聚现象,这可能由CuFe2O4具有较强磁性所致;从CuFe2O4/MAC的SEM图(图3d)可知,CuFe2O4均匀负载在改性活性炭的表面,复合材料的形貌呈现为细小颗粒状,粒径分布在10~100 nm 间,CuFe2O4/MAC复合材料具有良好的分散性,有效防止了改性活性炭的堆叠和CuFe2O4的团聚。
复合材料的饱和磁化强度和比表面积的测定结果见表1。从表1可知,复合材料的饱和磁化强度随CuFe2O4含量的减小而呈非线性比例显著降低,可能是非磁性氧化物含量如CuO、Cu2O和无定形氧化铁等随炭含量增大而增大,引起复合材料的磁化强度变小。CuFe2O4的比表面面积为124.4 m2/g,而MAC的比表面积为856.4 m2/g;CuFe2O4/MAC复合材料的比表面积随CuFe2O4含量的增大而减小;如假设CuFe2O4比表面积不变时,质量比为1∶2、1∶1.5和1∶1复合材料中的改性活性炭比表面积经计算分别为846.5 m2/g、878.7 m2/g、889.2 m2/g,这表明复合材料中改性活性炭的比表面积似乎随CuFe2O4质量含量增大而增大。从复合材料的SEM图及其磁化强度分析,CuFe2O4负载在改性活性炭的表面,有分散和减小磁化强度的作用,有效防止CuFe2O4颗粒团聚,可生成小粒径的CuFe2O4,引起CuFe2O4比表面积增大,从而MAC比表面积增大,同时也说明CuFe2O4的负载对改性活性炭孔径的阻塞非常小,这些可能有利于复合材料对Rh B的吸附。

图3 (a)AC, (b)MAC, (c)CuFe2O4 和(d)CuFe2O4/MAC (1∶1)的SEM图Fig.3 SEM images of (a)AC, (b)MAC, (c)CuFe2O4 and (d)CuFe2O4/MAC (1∶1)
从磁性分离技术和吸附两个方面考虑, 磁性复合材料CuFe2O4/MAC(1∶1)具有较大的磁化强度和较大比表面积。 因此,选择CuFe2O4/MAC(1∶1)作为吸附剂并研究其对Rh B的吸附。
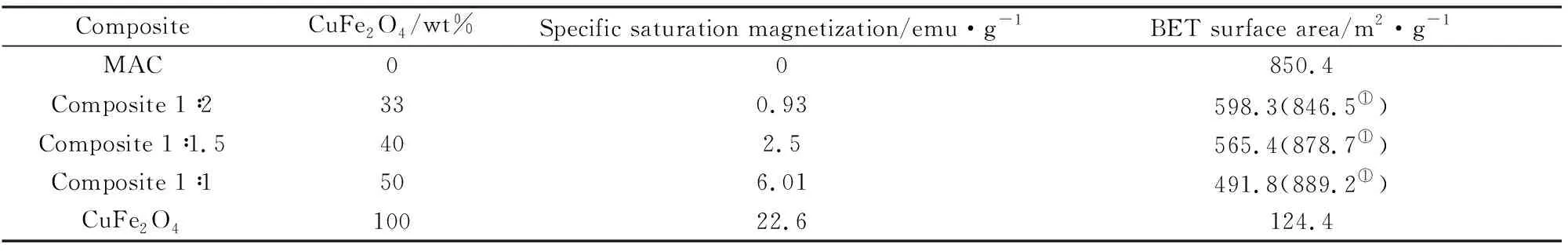
表1 CuFe2O4/MAC的磁化强度和比表面积Table 1 Saturation magnetization and surface area of CuFe2O4/MAC
注:①以改性活性炭物质表示
3.2 CuFe2O4/MAC复合材料对Rh B吸附研究
3.2.1 溶液初始pH值对Rh B吸附的影响
在Rh B的初始浓度为150 mg/L,吸附平衡时间10 h条件下,研究溶液初始pH值对MAC,CuFe2O4和CuFe2O4/MAC(1∶1)复合材料吸附Rh B的影响,见图4。
MAC对Rh B的平衡吸附量随pH值增大而降低,其原因是:pH增大,活性炭表面电荷和Rh B存在形式发生变化,二者综合作用使活性炭表面的活性吸附位点减小[19],从而活性炭对Rh B的吸附性能力降低。CuFe2O4/MAC和CuFe2O4复合材料对Rh B的平衡吸附量呈现为先增大后减小的变化规律,主要是复合材料表面层是负载CuFe2O4,从而呈现出一定程度上相似吸附规律。CuFe2O4的比表积小,但CuFe2O4对Rh B具有较好的吸附能力,可能与CuFe2O4的Fe3+-O2-中的氧负离子具有较大的负电性相关,使其与Rh B中正电性的氮原子易发生键合作用,有利于Rh B的吸附;文献[20] 测定,当pH值为5.2时,化学沉淀法合成的CuFe2O4Zeta电位为零,这表明, 在pH<5.2 时,CuFe2O4带正电;pH>5.2时,CuFe2O4带负电;Rh B的pKa=3[21],当pH<3时,罗丹明B离子带正电荷。当pH<3时,吸附剂CuFe2O4、CuFe2O4/ MAC复合材料表面的带正电荷与带有阳离子的Rh B发生了同性相斥作用,从而对Rh B的平衡吸附量较小;当pH值增大后,吸附剂CuFe2O4或复合材料主要外层的CuFe2O4表面带正电荷易于吸附带有阴离子的RhB,有着较高的平衡吸附量;当pH继续增加到超过吸附剂的Zeta电位时,Rh B分子上的羧基离子化,生成两性离子形式,部分Rh B生成二聚体[22],增大了Rh B与吸附剂结合空间阻力,同时阴离子的Rh B分子与吸附剂表面的负电荷产生了同性相斥的作用,因此Rh B吸附到CuFe2O4或CuFe2O4/MAC磁性材料表面上难度加大。
从图4可知,CuFe2O4/MAC复合材料对Rh B的平衡吸附量比CuFe2O4和MAC的平衡吸附量大。CuFe2O4/MAC磁性复合材料对Rh B的平衡吸附量的最佳pH为6,此时其平衡吸附量为73.54 mg/g; CuFe2O4/MAC复合材料的吸附性能在pH值4~7间呈现“高原”状平台,表明CuFe2O4/AC在较宽pH范围对Rh B保持良好的吸附性能。从单位表面积考虑,CuFe2O4具有较好的吸附性能,而复合材料的SEM图(图3d)表明复合材料颗粒粒径较小,同时改性活性炭上的CuFe2O4颗粒的粒径更小,从而增大了CuFe2O4的比表面积,因此CuFe2O4/MAC对RhB的平衡吸附量高于MAC和CuFe2O4。
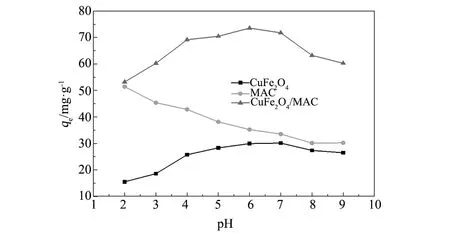
图4 溶液初始pH值对吸附Rh B的影响Fig.4 Effect of initial pH of solution for the adsorption of Rh B
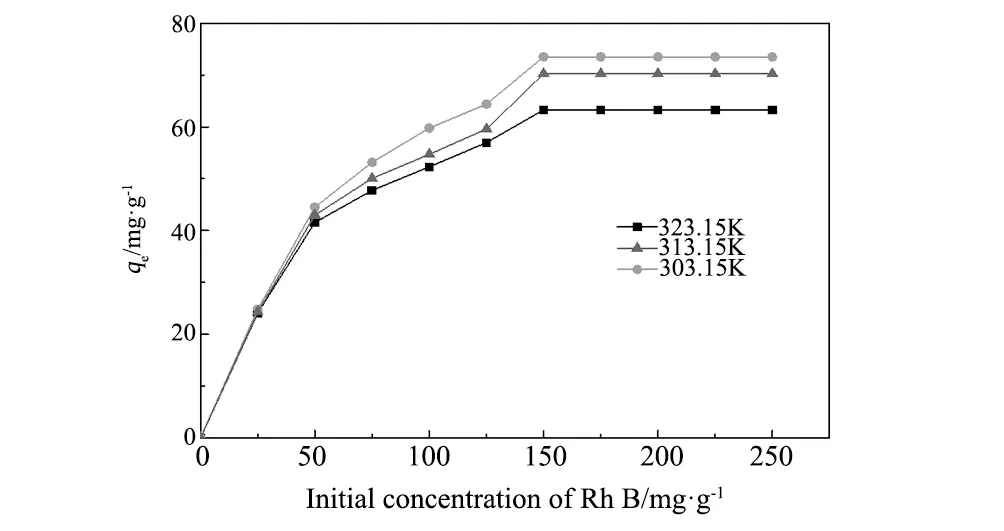
图5 CuFe2O4/MAC吸附罗丹明的等温曲线Fig.5 Isothermal curves of the adsorption of CuFe2O4/MAC for Rh B
3.2.2 吸附热力学
图5为CuFe2O4/MAC磁性复合材料的吸附等温线。在pH为6,平衡时间为10 h时,CuFe2O4/MA对Rh B的饱和吸附量随温度升高而下降,表明升高温度不利于CuFe2O4/MAC复合材料对Rh B的吸附。
为探讨CuFe2O4/MAC复合材料对Rh B的吸附机理,拟利用Langmuir模型(式2)[23]和Freundlich模型(式3)[24]对实验数据进行拟合,拟合参数见表2。
(2)
(3)
式中:qe为平衡吸附量,mg/g;qm为最大吸附量,mg/g;Ce是平衡浓度,mg/L;KL是Langmuir常数;Kf和1/n是Freundlich模型常数。
从表2可知,Langmuir模型的相关系数(R2≥0.987)明显优于Freundlich模型的相关系数(R2≤0.895),而且不同温度下的Langmuir模型计算的最大吸附量qm与实验测定值非常接近,因此Langmuir模型适合描述磁性CuFe2O4/MAC复合材料对Rh B的吸附过程,Rh B在CuFe2O4/AC材料表面以单分子吸附为主[23]。
由表2可知,CuFe2O4/MAC对Rh B吸附热力学更好地符合Langmuir模型,将表2数据代入方程(4)和(5)[25],求出吸附过程热力学状态函数的变化(见表4),如标准吉布斯自由能变ΔGθ、吸附焓变ΔHθ及吸附熵变ΔSθ,以进一步考察温度对吸附过程的影响。
ΔGθ=-RTlnb(b=KL×qm)
(4)
(5)
从表3可知,ΔGθ为负,表明吸附过程可以自发进行,ΔGθ的绝对值越大,吸附的推动力越大;ΔHθ为负值,说明吸附过程是一个放热过程,升温不利于吸附,高温分子热运动加剧,吸附质容易从吸附位点上解吸下来[26];ΔS为负值,表明Rh B的吸附过程自由度减小,混乱度降低。
CuFe2O4/MAC吸附Rh B的最大吸附量与文献报道的吸附剂的比较,见表4。从表4可知,CuFe2O4/MAC吸附量处于较高的水平。
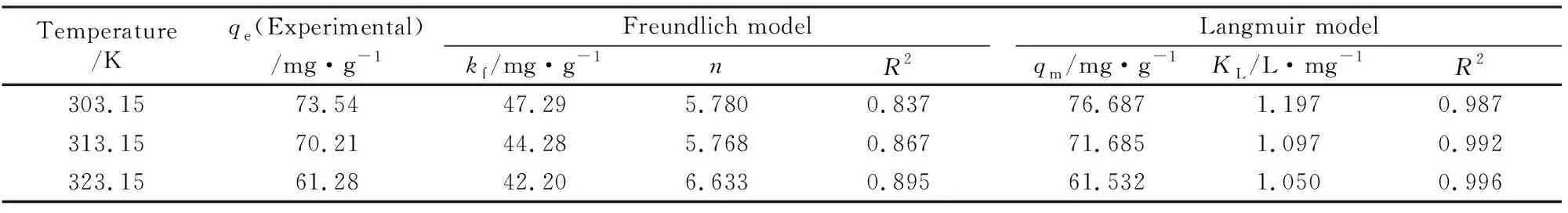
表2 拟合Freundlich模型和Langmuir模型的参数Table 2 Fitting parameters of Freundlich model and Langmuir model

表3 吸附热力学的拟合参数Table 3 Fitting parameters of adsorption thermodynamics
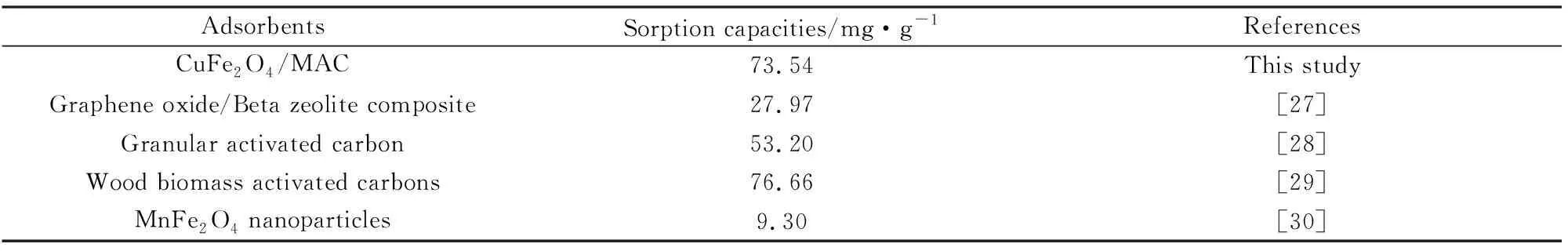
表4 CuFe2O4/MAC与其它吸附剂对罗丹明吸附量的比较
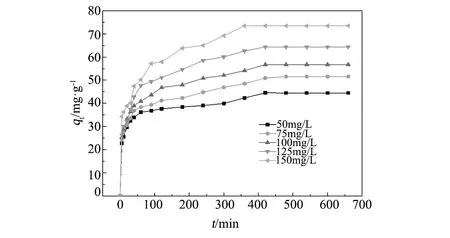
图6 时间与浓度对吸附Rh B的影响Fig.6 Effect of time and concentration on the adsorption of Rh B
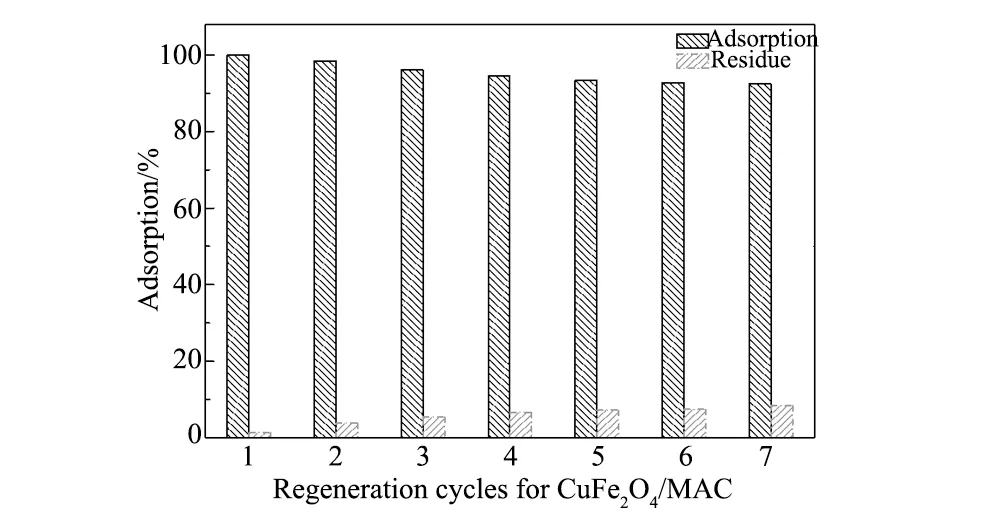
图7 CuFe2O4/MAC 循环使用次数对吸附性能的影响Fig.7 Effect of cycle number on the adsorption
3.2.3 吸附动力学
在303.15 K,溶液初始pH为6条件下,研究了不同浓度下CuFe2O4/MAC复合材料对Rh B的吸附随时间变化曲线,如图6。由图6可知,在初始2 h内,CuFe2O4/MAC复合材料对Rh B的吸附量迅速增加,随时间延长,吸附增长速率变缓;吸附7 h后吸附量不随时间的延长而增大,这时表明吸附达到平衡。
以准一级动力学模型和准二级动力学模型描述该吸附过程,方程分别为式(6)和式(7):
ln(qe-qt)=lnqe-k1t
(6)
(7)
其中:t为吸附时间,min;k1为准一级动力学速率常数,min-1;k2为准二级动力学速率常数g/(mg·min);qe为吸附剂的平衡吸附量,mg/g;qt为t时刻吸附剂的吸附量,mg/g。
分别以准一级动力学模型作ln(qe-qt)-t曲线和准二级动力学模型作t/qt-t直线,得动力学拟合参数见表5。
从表5可知,准二级动力学模型的相关系数R2(R2>0.995)明显优于准一级动力学模型的相关系数R2(0.897 表5 吸附动力学拟合参数 3.2.4 CuFe2O4/MAC复合材料再生 图7为循环使用次数对CuFe2O4/MAC(1∶1)吸附性能的影响。以复合材料的第一次饱和吸附量为100%, 通过7次的重复吸附与解吸附过程,CuFe2O4/MAC对Rh B的吸附量有所降低, 但吸附率仍保持在92.0%以上,表明吸附剂使用过程中具备良好的稳定性和具有优良的吸附性能。因此,CuFe2O4/MAC是一种可循环利用的优良的吸附材料, 在含染料的废水处理领域具有应用前景。 (1)以硝酸氧化的改性活性炭(MAC)、Fe(NO3)3·9H2O和Cu (NO3)·3H2O为原料,采用化学沉淀法制备了CuFe2O4/MAC(质量比为1∶1)磁性复合材料,利用SEM、XRD、FT-IR、BET和VSM等手段对其进行表征。研究表明复合材料为纳米材料,粒径在10~100 nm,其比面积为491.8 m2/g,饱和磁化强度6.01 emu/g。 (2)研究了CuFe2O4/MAC磁性复合材料对水体中罗丹明B的吸附过程。考察了温度、溶液初始pH值和罗丹明B的初始浓度等因素对磁性复合材料吸附性能的影响。结果表明:在pH值为6,温度30 ℃条件下,CuFe2O4/MAC对罗丹明B的饱和吸附容量为73.54 mg/g。 (3)CuFe2O4/MAC对Rh B的吸附过程可用Langmuir模型和准二级动力学模型进行描述,属于单层分子吸附的放热自发过程。CuFe2O4/MAC复合材料使用过程性质稳定,经过甲醇/乙酸混合溶液解吸,重复利用7次之后,对Rh B保持较高的吸附容量,具有潜在应有前景。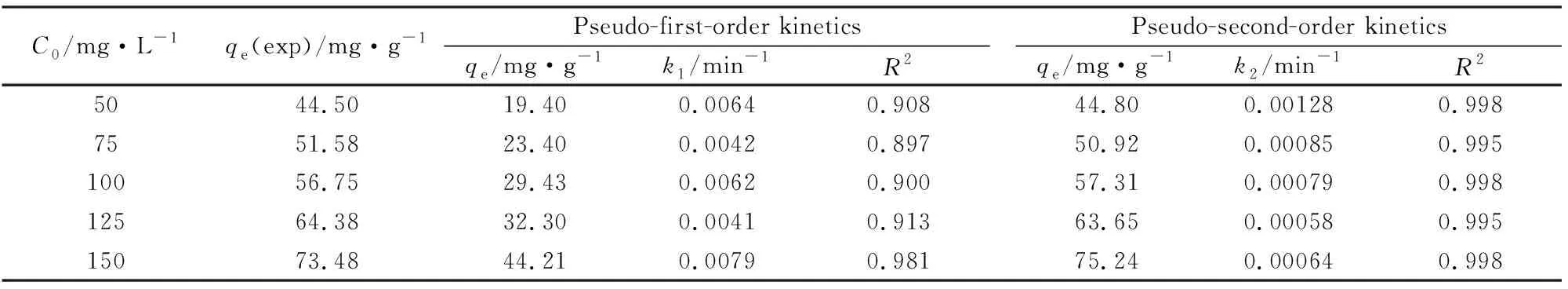
4 结 论
