形貌可控FeTiO3基光催化材料制备及晶面效应
2019-07-17方鹏飞王忠川王卫伟
方鹏飞,王忠川,王卫伟
(山东理工大学材料科学与工程学院,淄博 255091)
1 引 言
钛铁矿(FeTiO3)是地壳中一种常见的矿物,带隙约为2.8 eV,具有良好的吸附性、光催化性和反铁磁性,在新能源开发、环境处理、光电子学等领域具有潜在的应用价值[1-3]。但是仍存在一些问题制约着FeTiO3在实际中的应用,如作为光催化剂,光生电子空穴易复合,光催化活性有待进一步提高;作为磁性材料,磁性较弱。为了改善FeTiO3的性能,常将FeTiO3与其他材料复合,如Kim等[4]制备了FeTiO3/TiO2异质结,有利于光生电荷的转移,提高了FeTiO3的光催化活性;Ding等[5]将FeTiO3和C复合提高了电极材料的循环稳定性;Gao等[6]将FeTiO3和Fe2O3复合,提高了FeTiO3的光催化活性和铁磁性能。
材料的形貌不同,其表面组成晶面往往不同,晶面稳定性和反应活性不同,影响着材料的吸附、电子传输、光催化反应等性能[7]。如Yuan等[8]研究了不同形貌Mn掺杂α-Fe2O3对重金属离子的吸附性能,研究发现:碟形α-Fe2O3存在着{116}面的取向生长,对Cd2+、Hg2+表现出优异的吸附性能;六角形α-Fe2O3存在着{001}面的取向生长,对Pb2+表现出较高的吸附性能。谢垚[9]发现菱形十二面体型磷酸盐中存在着(110)的取向生长,对甲基橙和罗丹明表现出良好的降解效果;秦邦等[10]发现八面体形貌的Cu2O中存在大量的(111)晶面,能够提高还原Cr离子的催化速率。材料的形貌与其晶面有关,组成晶面不同,材料的性能不同。因此,研究形貌变化即组成晶面对提高光催化活性具有重要意义。目前有关FeTiO3的形貌研究报道不多[11],对于形貌对FeTiO3及其复合材料性能的影响规律仍不清晰。本文采用水热法制备了多种形貌的FeTiO3和FeTiO3/g-C3N4复合材料,研究了反应时间和NaOH用量对形貌的作用规律,从而研究了晶面对FeTiO3和FeTiO3/g-C3N4复合材料光催化性能的影响。此外,可以利用FeTiO3的磁性能回收光催化剂,解决光催化剂不易回收的问题。
2 实 验
2.1 试 剂
实验药品:三聚氰胺,四水合氯化亚铁(FeCl2·4H2O),硫脲,氢氧化钠,二氧化钛(粒,锐钛矿),无水乙醇,盐酸(质量分数37.5%),均为分析纯。
2.2 样品制备
(1)烧结法制备g-C3N4:称取5 g三聚氰胺放入坩埚,置于马弗炉中,升温速度为3°/min,520 ℃下保温4 h,自然冷却到室温,研磨得最终样品。
(2)水热法制备FeTiO3:(1)水热处理TiO2:将0.5 g TiO2分散到50 mL 10 mol/L 氢氧化钠水溶液中,转移到50 mL反应釜中,150 ℃保温6 h,自然冷却到室温。用0.1 mol/L HCl水溶液调节pH为7,离心,用去离子水和无水乙醇洗涤三次,室温下干燥,备用。(2)将0.792 g FeCl2·4H2O、0.04 g硫脲、0.8 g氢氧化钠和0.318 g TiO2(步骤(1)水热法处理后的二氧化钛)分散到4 mL去离子水中,混合均匀后转移到10 mL反应釜中,180 ℃保温5 h,自然冷却到室温,离心,用去离子水和无水乙醇洗涤三次,室温干燥,得到的样品记为F-1。改变NaOH用量和延长保温时间,分别制备F-2(0.64 g NaOH,保温8 h,其他条件不变)和F-3(0.32 g NaOH,保温10 h,其他条件不变)。
(3)水热法制备FeTiO3/g-C3N4复合材料:将0.618 g g-C3N4和0.318 g TiO2(水热处理后的样品)分散到30 mL去离子水中,超声分散20 min。再加入0.792 g FeCl2·4H2O、0.04 g硫脲和0.8 g氢氧化钠,混合均匀后转移到50 mL反应釜中,180 ℃保温5 h,其他处理方法与步骤2)一致,得到的样品记为FCN-1。改变NaOH用量和延长保温时间,分别制备FCN-2(0.64 g NaOH,保温8 h,其他条件不变)和FCN-3(0.32 g NaOH,保温10 h,其他条件不变)。
2.3 分析表征
X-射线衍射分析(XRD)使用D8 ADVANCE多晶X- 射线衍射仪,以Cu Kα为衍射源(λ=0.15406 nm)。用FEI-Sirion 200 F场发射扫描电镜(SEM)对样品形貌进行表征。用JEM-2100透射电镜(TEM)和高分辨透射电镜(HRTEM)对样品的形貌和结构进行表征。用紫外-可见分光光度计(日立3900H)检测样品的漫反射率和甲基橙溶液的吸光度。磁滞回线使用美国Quantum Design公司物理性能测试系统(PPMS-9T)进行测试。
2.4 光催化性能研究
将20 mg样品均匀分散在40 mL 甲基橙(20 mg/L)水溶液中,在暗处鼓泡30 min,达到吸附-脱附平衡。再进行光照,每0.5 h取样,离心,取上层清液,用紫外-可见光分光度计测定溶液中甲基橙的浓度。
3 结果与讨论
3.1 结构分析
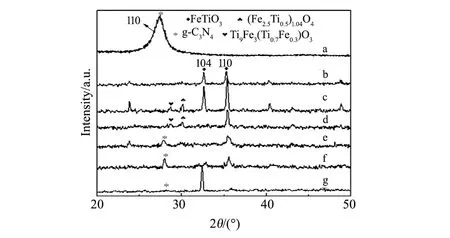
图1 g-C3N4、FeTiO3和FeTiO3/g-C3N4复合材料的XRD图谱(a)g-C3N4;(b)F-1;(c)F-2;(d)F-3;(e)FCN-1;(f)FCN-2;(g)FCN-3 Fig.1 XRD patterns of g-C3N4, FeTiO3 and FeTiO3/g-C3N4 compositions(a)g-C3N4;(b)F-1;(c)F-2;(d)F-3;(e)FCN-1;(f)FCN-2;(g)FCN-3
三聚氰胺煅烧后,在2θ=27.4°出现了g-C3N4(110)的特征峰,与标准卡片(JCPDS file No.87-1522)一致,没有观察到其他杂质峰,说明得到单一物相的g-C3N4(图1a)。与标准卡片(JCDPS file No.71-1140)相比,三种制备条件下均得到了刚玉衍生结构的FeTiO3(图1b~d)。制备条件不同,FeTiO3衍射峰的相对强度不同,其中(104)面和(110)面变化最为显著,用(104)面和(110)面衍射峰强度比描述FeTiO3生长随制备条件变化的情况。随着NaOH用量的减少和保温时间的延长,I(104)/I(110)逐渐降低,FeTiO3中以(110)晶面为主,即I(104)/I(110)分别为0.96(F-1)、0.72(F-2)、~0(F-3),没有检测到(104)晶面的衍射峰。样品F-1没有观察到杂质峰的生成;减少碱用量和延长反应时间,样品(F-2和F-3)在2θ=28.7°和30.1°分别出现了Ti9Fe3(Ti0.7Fe0.3)O3和(Fe2.5Ti0.5)1.04O4杂质相的衍射峰(JCDPS file No.61-368和51-1587)。
与g-C3N4复合后,XRD图谱中出现了FeTiO3(JCDPS file No.71-1140)和g-C3N4(JCPDS file No.87-1522)的衍射峰(图1e~g),没有观察到其他物相的衍射峰,说明g-C3N4的存在有利于FeTiO3的生长。与g-C3N4相比(图1a),复合后由于FeTiO3与g-C3N4之间相互作用,导致g-C3N4片层之间的距离被压缩,晶面间距减小[12],g-C3N4的(110)面衍射峰向高角度略微偏移。用复合材料中FeTiO3的I(104)/I(110)强度比描述制备条件对样品生长的影响情况。与FeTiO3相比,复合后I(104)/I(110)变化趋势截然相反,即随着NaOH用量的减少和反应时间的延长,I(104)/I(110)的强度比逐渐升高,依次为0(没有检测到(104)晶面的衍射峰,FCN-1)、0.44(FCN-2)、∞(没有检测到(110)晶面的衍射峰,FCN-3)。复合过程中,g-C3N4的加入影响了FeTiO3的生长习性。

图2 FeTiO3和FeTiO3/g-C3N4的SEM照片 (a)F-1;(b)F-2;(c)F-3;(d)FCN-1;(e)FCN-2;(f)FCN-3;(g)~(i)为FCN-1~FCN-3的放大图 Fig.2 SEM images of FeTiO3 and FeTiO3/g-C3N4 (a)F-1;(b)F-2;(c)F-3;(d)FCN-1;(e)FCN-2;(f)FCN-3;(g-i)are high magnification of FCN-1-FCN-3
3.2 形貌分析
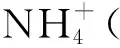

SC(NH2)2+2H2O=CO2+2NH3+H2S
(1)
NH3+H2O=NH3·H2O
(2)
2NH3·H2O+FeCl2=2NH4Cl+Fe(OH)2↓
(3)
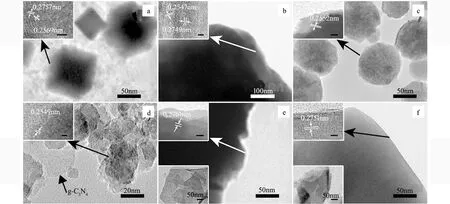
图3 FeTiO3和FeTiO3/g-C3N4复合材料的TEM和HRTEM照片 (a)F-1;(b)F-2;(c)F-3;(d)FCN-1;(e)FCN-2;(f)FCN-3图中左上角插图:对应的HRTEM,标尺为2 nm;图中左下角插图:FeTiO3/g-C3N4复合材料中g-C3N4的TEM照片 Fig.3 TEM and HRTEM images of FeTiO3 and FeTiO3/g-C3N4 compositions (a)F-1;(b)F-2;(c)F-3;(d)FCN-1;(e)FCN-2;(f)FCN-3; Insets of the upper left corner: HRTEM images, scale bar: 2 nm; Insets of the lower left corner: TEM images of g-C3N4 in FeTiO3/g-C3N4
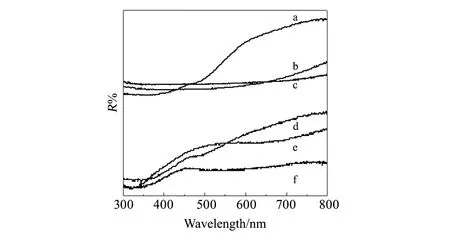
图4 FeTiO3和FeTiO3/g-C3N4的DRS图谱 (a)F-3;(b)F-2;(c)F-1;(d)FCN-2;(e)FCN-3;(f)FCN-1 Fig.4 DRS spectra of FeTiO3 and FeTiO3/g-C3N4(a)F-3;(b)F-2;(c)F-1;(d)FCN-2;(e)FCN-3;(f)FCN-1
利用TEM和HRTEM进一步研究FeTiO3和FeTiO3/g-C3N4的形貌和结构(图3)。与SEM分析结果一致,随着反应时间的延长和NaOH用量的减少,FeTiO3的形貌从立方(F-1)、八面体(F-2)变化为盘状(F-3)形貌,而FeTiO3/g-C3N4的形貌从盘状(FCN-1)、八面体(FCN-2)变化为立方(FCN-3)形貌。此外,复合后FeTiO3/g-C3N4还观察到g-C3N4片层形貌(图3d中箭头所示,图3e和3f左下角插图)。样品F-1的HRTEM照片(图3a左上角插图)显示的晶格条纹间距为0.2757 nm和0.2569 nm,分别对应着FeTiO3的(104)和(110)晶面。样品F-2八面体边缘的HRTEM照片表明其晶面也为FeTiO3的(104)和(110)晶面(图3b左上角插图)。样品F-3的HRTEM中可以观察到间距为0.2552 nm的晶格条纹,对应着FeTiO3的(110)晶面(图3c左上角插图)。复合后,FCN-1的表面晶面为(110)(图3d左上角插图)。利用HRTEM照片分别观察样品FCN-2中八面体和FCN-3中立方体边缘,均对应着FeTiO3的(104)晶面(图3e和3f左上角插图)。HRTEM分析样品的结构与XRD分析结果一致。
3.3 光催化性能研究
从紫外-可见光漫反射光谱可以看出样品的形貌对带隙影响不大(图4)。根据Kubelka-Munk 函数,用(αhν)0.5对hν作图,利用直线部分外推至横坐标交点估算F-1、F-2、F-3、FCN-1、FCN-2和FCN-3的带隙,分别为2.0 eV、2.2 eV、2.4 eV、1.5 eV、1.9 eV和1.7 eV。FeTiO3和FeTiO3/g-C3N4复合材料均能吸收可见光。复合后样品的带隙降低。
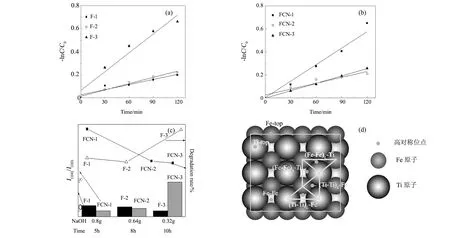
图5 (a,b)FeTiO3和FeTiO3/g-C3N4复合材料光催化降解甲基橙动力学曲线;(c)制备条件、I(104)/I(110)和降解率关系图;(d)(110)面的Fe、Ti原子分布图,“L”代表长键,“S”代表短键,“-”代表桥键 Fig.5 (a,b)Kinetic curves of photocatalytic degradation of methyl orange by FeTiO3 and FeTiO3/g-C3N4 composites;(c)relationship diagram among experimental conditions, I(104)/I(110) and degradation rate;(d)atomic distribution of Fe and Ti on (110), "L" stands for the long bond, "S" stands for the short bond, "-" stands for the bridge bond
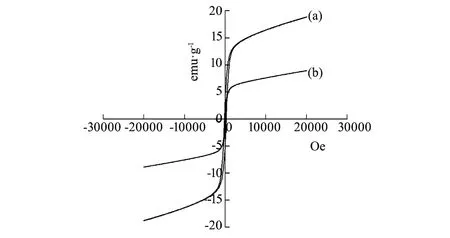
图6 室温磁滞回线 (a)F-3;(b)FCN-1 Fig.6 Room temperature hysteresis loops (a)F-3;(b)FCN-1
采用Langmuir-Hinshlwood 动力学模型[16](-ln(C/C0)=kt)分析了 FeTiO3和FeTiO3/g-C3N4光催化降解甲基橙的过程。随着光照时间的延长,甲基橙溶液的浓度逐渐降低(图5(a)和5(b))。复合前后,样品的光催化降解效果主要受到FeTiO3形貌,即晶面(110)的影响。形貌不同,光催化降解效果不同:FeTiO3的光催化降解能力F-3>F-2>F-1;FeTiO3/g-C3N4复合材料的光催化能力FCN-1>FCN-3>FCN-2(图5(a)~5(c))。光催化性能最好的F-3和FCN-1均为盘状形貌,(110)晶面含量最高,带隙窄,吸光性能好。这与FeTiO3(110)面原子排列有关,(110)面中Fe原子和Ti原子相间分布,在(Ti-Ti)S-Fe接触部位吸附能最低,驰豫后离表面最近,Fe-Fe桥键次之[15],有利于离子吸附和活性物质的生成,为光催化降解甲基橙提供了更多的活性物质,提高光催化活性(图5(d))。由光催化实验结果可知:具有盘状形貌(即(110)晶面相对含量最大)的FeTiO3(F-3)和FeTiO3/g-C3N4(FCN-1)均表现出最优的光催化性能,且二者的光催化性能相似;而其他形貌(即(110)晶面相对含量较低)的FeTiO3和FeTiO3/g-C3N4光催化性能均较差。进一步说明在制备复合材料时,g-C3N4主要影响FeTiO3的生长习性,对光生电子空穴对的分离影响较小。
图6为复合前后盘状形貌样品(F-3、FCN-1)的磁滞回线。复合前,F-1的饱和磁化强度为18.65 emu/g,复合后FCN-1的饱和磁化强度降低,为8.91 emu/g,这与复合后样品中引入非磁性物质g-C3N4有关。文献报道:样品的饱和磁化强度只需要大于5 emu/g,就可以利用外加磁场从溶液中回收光催化剂[17]。复合前后样品均可利用外加磁场实现光催化剂的回收。
4 结 论
采用水热法,通过改变NaOH用量和反应时间,调控(110)晶面生长,制备了不同形貌的FeTiO3和FeTiO3/g-C3N4复合材料。随着(110)晶面含量的增加,FeTiO3和FeTiO3/g-C3N4复合材料趋向形成盘状形貌。形貌对FeTiO3和FeTiO3/g-C3N4复合材料光催化降解甲基橙的作用规律一致,盘状形貌的FeTiO3和FeTiO3/g-C3N4复合材料对甲基橙的降解效果最好,即复合前后样品中FeTiO3以(110)面为主,光催化降解效果最好。
