儿童多形性黄色瘤型星形细胞瘤的影像学特征
2019-07-17武文浩左鹏程李春德
武文浩,左鹏程,宫 剑,李春德
儿童多形性黄色瘤型星形细胞瘤(pleomorphic xanthoastrocytoma,PXA)为颅内少见的星形细胞瘤,常发生于儿童及青年群体,总体发生率低,临床罕见,诊断较难。根据WHO 2016年中枢神经系统肿瘤分类,PXA属于其他星形细胞瘤,区别于弥漫性星形细胞和少突胶质细胞肿瘤[1],表明其可能具有独特的临床影像及病理特点。目前,针对儿童PXA影像学分析的报道非常少,国内文献检索仅有1篇对其MRI特点的报道[2]。本研究旨在通过对PXA病例的临床及影像学资料进行分析,以期提高对该病的认识,为临床正确诊断提供参考。
1 资料与方法
1.1 资料选取 收集2009-07至2018-12我院小儿神经外科病房收治的儿童PXA患者的临床及影像资料,共17例。入选标准:(1)年龄≤15岁;(2)在我科行开颅手术,病理诊断明确为PXA;(3)具有完整的术前及术后CT、MRI检查资料。排除临床及影像学资料不完善、患儿不配合检查或图像质量欠佳者。
1.2 影像学检查 所有患儿术前及术后均行CT、MRI检查,为使患儿配合检查,保证成像质量,必要时给予水合氯醛(0.5 ml/kg)镇静催眠。应用德国西门子128层螺旋CT机常规行头颅CT平扫检查;MRI扫描采用3.0 T超导型磁共振成像系统(西门子),使用头部线圈,常规行轴位T1WI FLAIR(TR 2000 ms,TE 9.8 ms)及轴位T2WI(TR 4500 ms,TE 84 ms)扫描,层厚为5 mm,层间距1 mm;平扫后再行T1WI增强扫描,参数同平扫,对比剂Gd-GTPA经肘静脉注射,剂量为0.1 mmol/kg,注射后行轴位、矢状位和冠状位扫描。

1.4 观察指标 (1)分析患者的一般资料;(2)分析病变的影像学特征:CT上病变密度高低及有无钙化,MRI上T1WI与T2WI信号表现,注药后肿瘤实质部分及囊壁有无增强,病变大小,周围有无水肿,及病变影像学类型;(3)分析HE及免疫组化染色病理学检查结果。
2 结 果

2.2 影像检查结果 术前CT显示肿瘤实性部分为高密度或等密度,囊性部分表现为低密度,钙化为高密度,本组有5例可见点片状钙化。根据肿瘤MRI特点,可将肿瘤分为4种影像学类型。肿瘤实性部分T1WI扫描往往表现为等信号,T2WI扫描呈高信号或等信号,肿瘤囊性部分均表现为T1WI低信号,T2WI高信号。增强扫描后肿瘤实质部分均可见不同程度的强化,4例(33.3%)肿瘤囊壁可见强化,并且均为囊内伴附壁结节类型(表2)。此外,T2WI上本组有9例可见不同程度的水肿;肿瘤最大直径15~109 mm,平均55.6 mm(图1、2)。
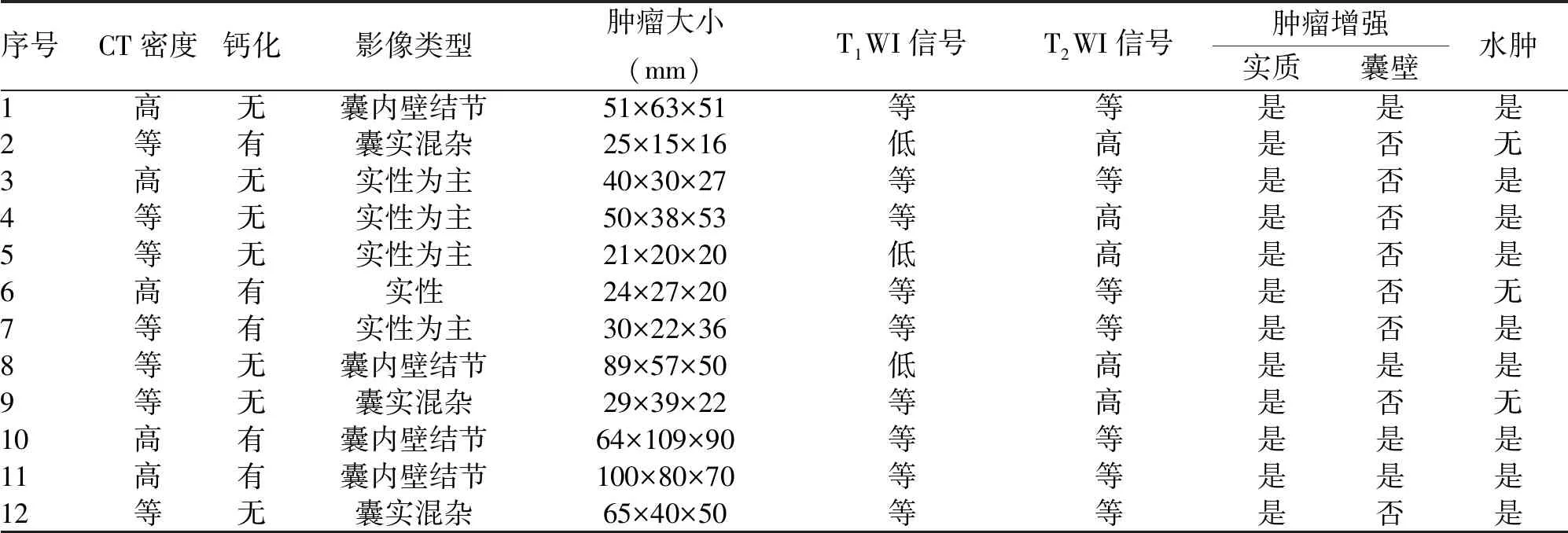
表2 12例儿童PXA患者的影像学资料
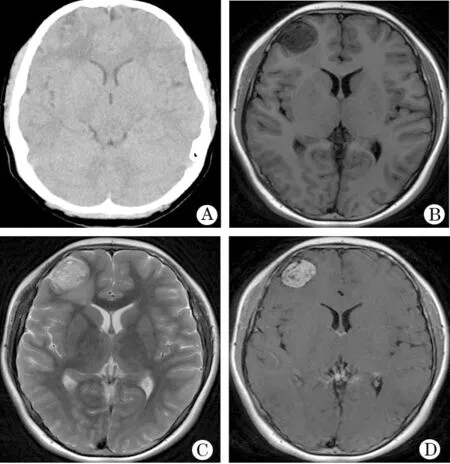
图1 实性为主儿童PXA患者影像
A.CT显示右额等密度病变,内含小低密度灶,病变未见明显钙化;B.T1WI示肿瘤呈低信号,位于右额表浅位置;C.T2WI示肿瘤呈高信号,周边可见水肿;D.增强后显示肿瘤强化明显,内含多个小囊变
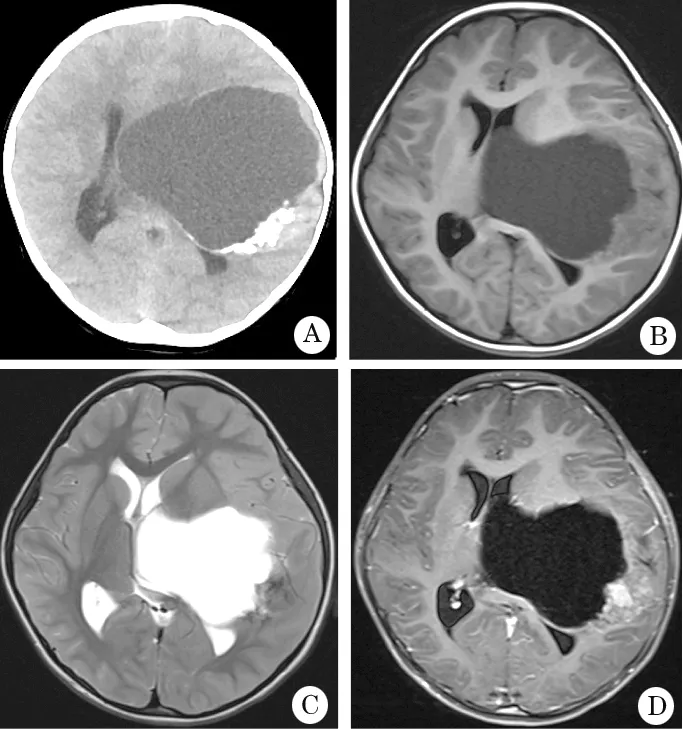
图2 囊内伴附壁结节类型儿童PXA患者影像
A.CT显示瘤在囊内,典型的“大囊小结节”,肿瘤可见片状钙化;B.T1WI示肿瘤位于左额颞顶及丘脑底节区,实性部分呈等信号;C.T2WI示肿瘤实性部分呈等信号,内含低信号钙化灶;D.增强后显示肿瘤实性部分强化,囊壁亦有强化
2.3 手术及病理结果 所有患儿均行开颅手术治疗,10例行全切除(其中1例肿瘤为实质全切,囊壁近全切),另外2例分别为近全切及大部分切除。术后病理证实均为PXA,其中4例局灶间变或生长活跃伴坏死,定义为WHO Ⅱ~Ⅲ级;另有1例局灶可见大量巨大胶质细胞,呈室管膜下巨细胞星形细胞瘤形态,定义为WHO I~II级(图3)。
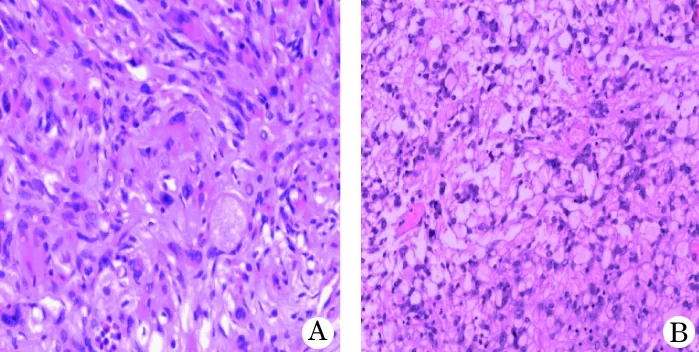
图3 儿童PXA 患者病理结果(HE,×100)
3 讨 论

PXA实性部分在CT中的表现常为等密度或高密度病灶,囊性部分为低密度;文献[5,6]报道PXA总体上钙化少见,但本组有5例(41.6%)可见钙化,提示儿童PXA可能具有不同的影像学特征。T1WI上PXA实性部分往往呈低信号或等信号,T2WI上常为等信号或高信号,囊性部分为长T1长T2信号;增强后实性部分均可见不同程度的强化,而囊壁有时亦强化,提示囊壁亦为肿瘤组织,手术中应尽量切除,以减少复发。Byun等[7]报道在成人PXA中,瘤周水肿可影响无进展生存期及总体生存期,与不良预后相关;儿童PXA水肿较为常见,本组9例(75.0%)均可见不同程度的水肿,但水肿与预后的相关性还需进一步研究。此外,根据肿瘤MRI形态学特点,儿童PXA可分为完全实性、实性为主、囊实性混杂、囊内伴附壁结节4种类型,总体上儿童PXA易出现不同程度囊性改变,囊壁一般无强化,囊壁强化在本组仅见于囊内伴附壁结节类型。
儿童PXA具有自身的临床及影像学特征,其诊断时需与以下颅内占位病变鉴别,防止误诊。(1)与脑膜瘤、血管外皮细胞瘤鉴别:脑膜瘤具有脑外肿瘤特征,密度大多均匀,强化均一明显,可伴脑膜尾征;血管外皮细胞瘤血供丰富,易出现瘤内坏死,相邻骨质可见破坏性改变;(2)肿瘤常为囊实性,需与胶质母细胞瘤、室管膜瘤鉴别:胶质母细胞瘤占位及水肿效应明显,典型花环状强化,内可见坏死及出血改变;幕上室管膜瘤常位于顶叶,水肿通常不明显,肿瘤实质和囊壁均可强化;(3)肿瘤可为大囊伴附壁结节,需与血管网织细胞瘤、毛细胞型星形细胞瘤鉴别:血管网织细胞瘤多发生于小脑半球,可见血管流空影;毛细胞型星形细胞瘤常位于幕下,水肿往往不明显;(4)肿瘤可伴钙化,且常位于大脑半球表浅位置,需与少枝胶质细胞瘤、节细胞胶质瘤鉴别:少枝胶质细胞瘤常位于额叶,条索样钙化具有一定的特征性;节细胞胶质瘤鉴别亦好发于幕上,颞叶多见,但由于肿瘤恶性程度低,强化及水肿不及PXA。
PXA于1993年进入WHO中枢神经系统肿瘤分类,定义为WHO Ⅱ级肿瘤;最新的2016年WHO分类增加了间变PXA(WHO Ⅲ级)分类,表明PXA亦有恶性倾向及不良预后,本组有1例为间变PXA,另有4例局灶间变,生长活跃,介于WHO Ⅱ~Ⅲ级之间,有研究报道病理级别的高低是影响患者预后的重要因素[8]。PXA的临床治疗首选外科手术,应全部切除病变,全切除与良好预后相关[9,10];PXA术后行放疗及化疗目前仍有争议,有待进一步验证[4,11]。

