全氟化碳对脂多糖致A549细胞损伤的细胞形态学和增殖能力的影响
2019-07-16朱强叶树鸣杨震梁志欣李春笋陈良安
朱强 叶树鸣 杨震 梁志欣 李春笋 陈良安
1解放军总医院呼吸科,北京100853;2武汉市第一医院呼吸科430022
ARDS是临床常见且难治的急性危重症,病死率高达50%左右[1],严重感染是ARDS最常见的原因之一,约有40%~50%的ARDS患者与感染或脓毒症有关[2]。脂多糖 (lipopolysaccharide,LPS)是临床感染中占大多数的革兰阴性杆菌外膜上的主要成分。当LPS入侵肺部时,它能结合细胞表面的CD14受体,与宿主细胞相互作用后使细胞产生大量的细胞因子与炎性介质直接损伤肺泡细胞,引起肺泡上皮屏障的破坏,导致肺水肿,从而促进ARDS的发生、发展。
全氟化碳 (perfluorocarbon,PFC)是碳氢化合物中的氢原子被氟原子取代后形成的一类化合物,常温下为无色、无味、无毒的透明液体,黏度低于血液而稍高于水,不溶于血液、水、脂类及其他介质,密度高,表面张力低,化学性质稳定,在体内不发生代谢。由于PFC分子间吸引力小,分子不易聚集,分子间的疏松堆积使它有较大空间供气体分子自由进出,因此它具有良好的呼吸气体运载能力。对氧的溶解和释放可在10 ms内完成,并且这个过程是可逆的,比人血红蛋白所需要的30 ms要快得多;其对二氧化碳的溶解和释放的时间更短,为4 ms,并且也是可逆过程。PFC溶氧能力是水的20~25倍,血液的2倍,其溶解二氧化碳的能力是水的3倍多。目前,有研究表明PFC通过液体通气、雾化吸入及气化通气可显著改善ARDS的氧合,减轻炎症反应,降低死亡率[3-4],然而其具体机制尚不明确。本研究应用LPS作用于人肺上皮样A549细胞模仿ARDS体外细胞模型,观察PFC对LPS致A549细胞损伤的生物学影响,以期为ARDS的防治提供更多的理论基础。
1 材料与方法
1.1 实验材料 (1)细胞系:传代培养人肺上皮样A549细胞由本实验室收藏。 (2)主要试剂:DMEM培养基、胎牛血清、LPS(E.coli 026:B6)、DMSO、PFC、PBS、无水乙醇、RNAiso Plus(总 RNA提取试剂盒)、PrimeScript®RT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTMII、RNA free dd H2O、三氯甲烷、异丙醇、DEPC。 (3)实验仪器:CO2恒温培养箱、IX-81显微镜、超净工作台、低速离心机 (TDZ4-WS)、流式细胞仪FACS Callibur、-20℃低温冰箱、-80℃超低温冰箱、6孔细胞培养板、12孔细胞培养板、24孔细胞培养板、XSZ-D2型倒置显微镜、JY92-2D型超声细胞粉碎仪、电热恒温水浴锅、血细胞计数板 (XB-K-25型)、液氮罐、移液器、高压灭菌锅、微型离心机、高速低温离心机、PCR仪 (MJ Mini)、荧光定量RCR仪 (BIORAD iQ5)、核酸蛋白定量分析仪。
1.2 主要溶液配制 (1)0.25%胰蛋白酶的配制:称取胰蛋白酶干粉2.5 g加入1 000 ml D-Han's液中,将其置于37℃水浴下使其完全溶解,在无菌条件下,使用0.45μm和0.22μm双层滤膜过滤除菌,将配置好的胰蛋白酶分装于100 ml无菌瓶中,-20℃保存备用。(2)PBS的配制:称取粉剂6 g置于500 ml灭菌水中,配制成0.01 mol/L的溶液,高压灭菌,4℃保存备用。 (3)LPS溶液:将LPS 10 mg加10 ml无血清培养液溶解,使其浓度为1 g/L,-20℃备用。
1.3 方法
1.3.1 A549细胞系的培养
1.3.1.1 冻存细胞的复苏 从液氮罐中取出装有A549细胞的冻存管,将其迅速置于37℃的水浴中,使冻存细胞快速融化,无菌条件下将2 ml冻存管中的细胞悬液移入10 ml无菌离心管中,向离心管中加入含10%胎牛血清的DMEM培养液4 ml,离心半径15 cm,1 000 r/min离心5 min(其目的为洗去冻存液中的DMSO),弃去上清液,重复洗涤离心1次,细胞沉淀用4 ml含10%胎牛血清的DMEM培养基重悬后,无菌条件下转移入培养皿中,置于37℃含5%CO2的饱和湿度细胞培养箱中进行培养。12 h和24 h后分别于倒置显微镜下观察细胞是否贴壁生长。
1.3.1.2 细胞培养 A549细胞置于37℃含5%CO2的饱和湿度细胞培养箱中进行培养,细胞贴壁生长,每次细胞换液时直接弃去培养液,再加入新的含10%胎牛血清的DMEM培养液。
1.3.1.3 细胞传代 倒置显微镜下观察细胞生长情况,待细胞长满培养皿底后进行传代。弃去DMEM培养液,向培养皿中加入约1 ml 0.25%含EDTA的胰蛋白酶溶液,将细胞放入培养箱,约2~5 min后于倒置显微镜下观察到贴壁胞质回缩、细胞间隙变大。细胞变为圆形后,弃去培养瓶中的胰蛋白酶,迅速加入约2~3 ml含有10%胎牛血清的DMEM培养液,终止胰蛋白酶消化作用。用吸管反复吹打瓶底使贴壁细胞悬浮,尽量将细胞吹打为单细胞悬液,将悬浮的单细胞悬液等量移入2~3个培养皿中,向每个培养皿中加入含10%胎牛血清的DMEM培养基约7~8 ml,置于37℃含5%CO2的饱和湿度细胞培养箱中进行培养。
1.3.1.4 细胞冻存 取对数生长期细胞,弃去培养液,0.25%的胰蛋白酶消化后,加入含10%胎牛血清的DMEM培养基,吸管反复吹打贴壁细胞使细胞悬浮,将细胞悬液移入10 ml离心管中,离心半径15 cm,1 000 r/min离心5 min,加入配制好的含10%DMSO的冻存培养液,使冻存液中细胞的最终浓度为5×106~1×107/ml,用吸管移入冻存管中,标记后,-20℃放置1 h,-70℃放置5 h后,移入液氮罐中保存。
1.3.1.5 细胞计数 将盖玻片盖在血细胞计数板上,取10μl细胞悬液加入90μl PBS中稀释后,滴加少量稀释液于盖玻片边缘,静置1 min。于倒置显微镜下计数4大格的细胞总数。细胞数(个/ml)=4大格细胞总数/4×10×104。
1.3.2 LPS致A549细胞损伤模型的建立
1.3.2.1 细胞分组及培养 将A549细胞接种于细胞培养板中,待其生长达80%融合度时,对照组加入完全培养基,LPS组加入LPS及完全培养基,使LPS终浓度为100 mg/L。分别于加入LPS后0、1、2、4、6、8、10、12、24 h检测A549细胞相关损伤指标。
1.3.2.2 提取细胞总RNA 采用TAKARA公司的RNAiso Plus试剂盒提取A549细胞总RNA。具体步骤:(1)去除培养基,PBS清洗1次。按每10 cm2生长细胞中加入1 ml RNAiso Plus,轻轻摇晃,使裂解液均匀分布于细胞表面。(2)将含有细胞的裂解液转移至离心管中,移液枪反复吹打至裂解液中无明显沉淀,室温静置5 min。(3)向裂解液中按1∶5体积比加入氯仿,用力混合至溶液乳化呈乳白色,室温静置5 min。(4)4℃,离心半径15 cm,12 000 r/min离心15 min。取出离心管,此时匀浆液分为3层:无色上清液 (含RNA)、居于中间的白色蛋白层及下层的红色有机相。(5)转移上清液至另一离心管中,同时计算产量。(6)上清液中加入等体积异丙醇,上下轻轻颠倒离心管,充分混匀后,室温静置10 min。 (7)4℃,离心半径15 cm,12 000 r/min离心10 min。(8)小心弃去上清。加入75%乙醇1 ml,轻轻震荡洗涤离心管管壁,4℃,离心半径15 cm,7 500 r/min离心5 min,小心弃去上清。(9)打开离心管盖,室温干燥沉淀。待沉淀干燥后,加入适量的RNase-free dd H2O溶解沉淀。(10)RNA溶解后置于冰上继续下一步实验。
1.3.2.3 RNA纯度测定 RNase-free dd H2O稀释RNA,其后应用核酸蛋白质定量分析仪测定吸光度以及RNA浓度,OD260/OD280比值应介于1.7~2.1之间。
1.3.2.4 反转录反应 采用TAKARA公司PrimeScript®RT reagent Kit进行反转录反应合成cDNA。(1)祛除基因组DNA。反应体系:总RNA 1.0μg,5×gDNA Eraser Buffer 2.0μl,gDNA Eraser 1.0μl,RNase-free dd H2O 6μl。反应条件:42℃2 min。(2)反转录反应。反应体系:第一步反应液10μl,5×PrimeScript®Buffer2 4μl,PrimeScript®RT Enzyme Mix I 1μl,RNase-free dd H2O 4μl,RT Primer Mix4 1μl。反应条件:37℃15 min,85℃5 s。反应合成的c DNA直接进行下一步实验。
1.3.2.5 引物设计 搜索Genebank,对IL-6(ACCESSION: NM_000600.3) 及 β-actin(ACCESSION:NM 001101.3)的基因序列应用Primer BLAST进行引物设计。IL-6上游引物:5'-CCAGAGCTGTGCAGATGAGT-3',下 游 引物:5'-AGTTGTCATGTCCTGCAGCC-3',扩增产物长度为155 bp。β-actin(内参)上游引物:5'-CAAAGACCTGTACGCCAACACAGT-3',下游引物:5'-ACTCCTGCTTGCTGATCCACATCT-3',扩增产物长度为215 bp。
1.3.2.6 荧光实时定量PCR 采用TAKARA公司SYBR®Premix Ex TaqTMII进行实时定量PCR反应。反应体系:DNA模板1.5μmol/L,dd H2O 6.9μl,SYBR®Premix Ex TaqTMII 10μl,上游引物 (10μmol/L)0.8μl,下游引物 (10μmol/L)0.8μl。
反应条件:两步法PCR扩增程序。Stage 1(预变性):95℃30 s,20℃/s,1 Cycle。Stage 2(PCR反应):95℃5 s,20℃/s;60℃20 s,20℃/s,40 Cycles。Stage 3(融解曲线分析):95℃30 s,20℃/s;65℃15 s,20℃/s;95℃30 s,0.1℃/s。
1.3.3 观察指标
1.3.3.1 细胞分组 实验用细胞均处于对数生长期。细胞分为4组。(1)对照组:不作任何干预;(2)PFC组:按10%体积比 (PFC∶培养液)加入全氟辛烷,使用超声波将PFC与培养液混匀,转入培养皿中;(3)LPS组:干预时以100 mg/L的终浓度加入相应剂量的LPS; (4)LPS+PFC组:以LPS的终浓度为100 mg/L、PFC的体积比为10%加入DMEM培养基,通过超声波混匀,加入培养皿 (表1)。
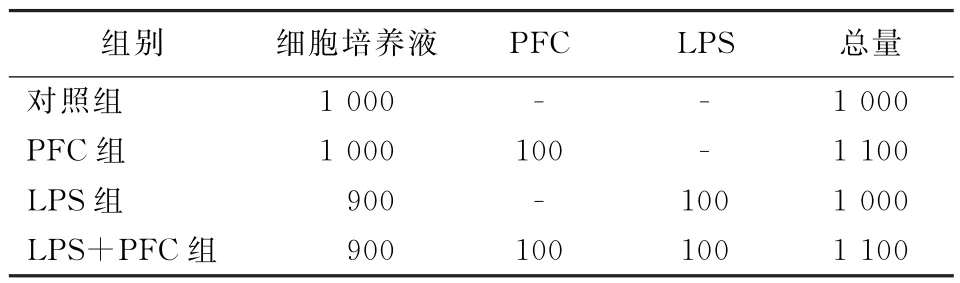
表1 实验细胞分组及处理方法(加入相应试剂剂量,μl)
1.3.3.2 显微镜下观察细胞形态 取对数生长期细胞,消化后将细胞悬液平均接种于12孔细胞培养板中,24 h后按以上分组给予相应处理。继续培养24、48、72 h,在倒置显微镜下观察形态改变并拍照记录。
1.3.3.3 细胞生长曲线的绘制 细胞分组同形态学观察实验。采用细胞计数法检测各组A549细胞的增殖能力:(1)胰蛋白酶消化A549细胞制成单细胞悬液;(2)细胞计数后以每孔4×104接种于12孔板中; (3)37℃,5%CO2培养箱中常规培养;(4)24 h后按不同分组给予相应处理; (5)从加药后第1天开始,每组每天计数细胞3个复孔,连续6 d;(6)实验重复3次,绘制细胞生长曲线。
1.4 统计学分析 荧光实时定量PCR结果使用2-ΔΔCt方法计算。其余统计分析采用SPSS 17.0软件包,所有数据均经正态分布性检验 (Klmogorov-Smirnov test),以确定数据是否呈正态分布;并进行方差齐性检验 (Bartle法)以确定总体方差是否相等。将所得数据分别进行方差分析 (正态方差齐者用Bonferroni法,正态方差不齐者用Tamhane法),数据以±s表示,P≤0.05为差异有统计学意义。
2 结果
2.1 IL-6 m RNA表达水平 LPS刺激A549细胞后,各时间点LPS组与对照组 (0 h)IL-6 m RNA表达的差异均有统计学意义 (P<0.05),见表2、图1。
表2 脂多糖刺激A549细胞后各时间点IL-6 m RNA相对表达量的变化 (±s,n=3)
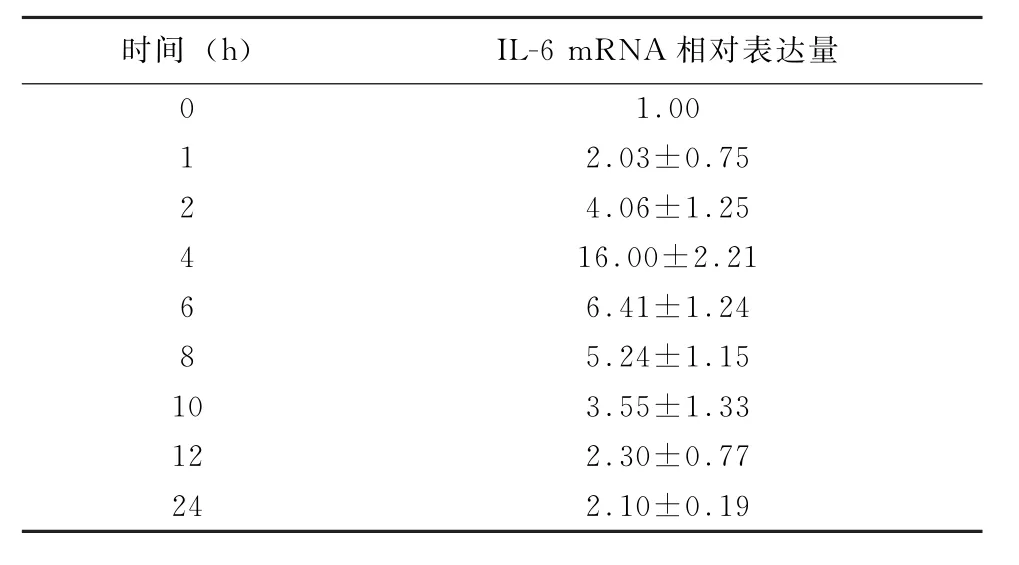
表2 脂多糖刺激A549细胞后各时间点IL-6 m RNA相对表达量的变化 (±s,n=3)
时间 (h) IL-6 mRNA相对表达量0 1.00 2.03±0.75 2 4.06±1.25 4 16.00±2.21 6 6.41±1.24 8 5.24±1.15 10 3.55±1.33 12 2.30±0.77 24 2.10±0.19 1

图1 脂多糖刺激A549细胞后不同时间点IL-6 m RNA相对表达水平的变化
2.2 各组A549细胞形态学变化 各组A549细胞均呈上皮样细胞贴壁生长。对照组、PFC组及LPS+PFC组细胞形态饱满,排列紧密,生长状态良好。LPS组细胞明显稀疏,细胞形态皱缩,体积变小,部分细胞呈圆形,生长状态变差。见图2~4。
2.3 各组A549细胞增殖能力的变化 从加药后第4天起,LPS组与其他组细胞数目的差异均有统计学意义 (P<0.05),即LPS明显抑制了A549细胞的增殖能力,而PFC明显减弱了LPS的抑制效应。PFC组与对照组的细胞数目差异无统计学意义,因此PFC本身对A549细胞的增殖无影响。见表3、图5。
3 讨论
ARDS是临床上常见的危重症,目前临床治疗尚未取得突破性进展,机械通气仍是其最主要的治
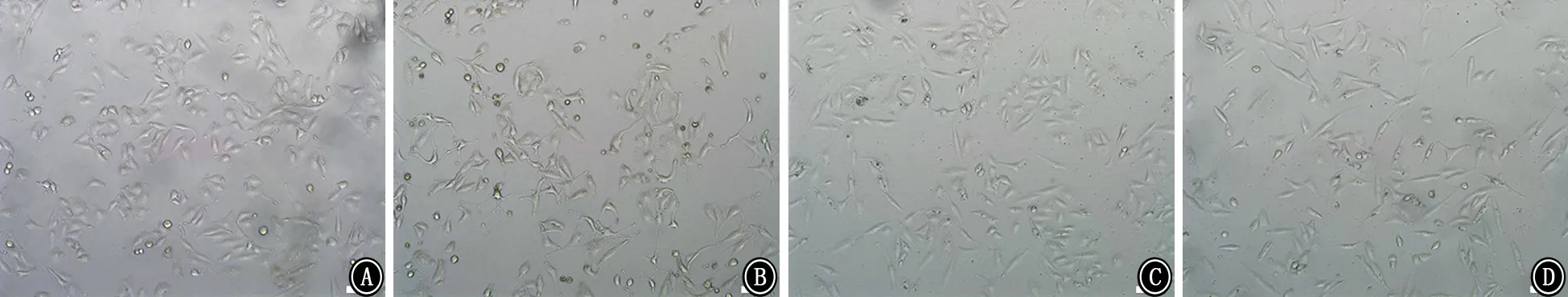
图2 加入LPS或PFC后24 h各组A549细胞形态 ×100 A:对照组;B:LPS组;C:PFC组;D:LPS+PFC组
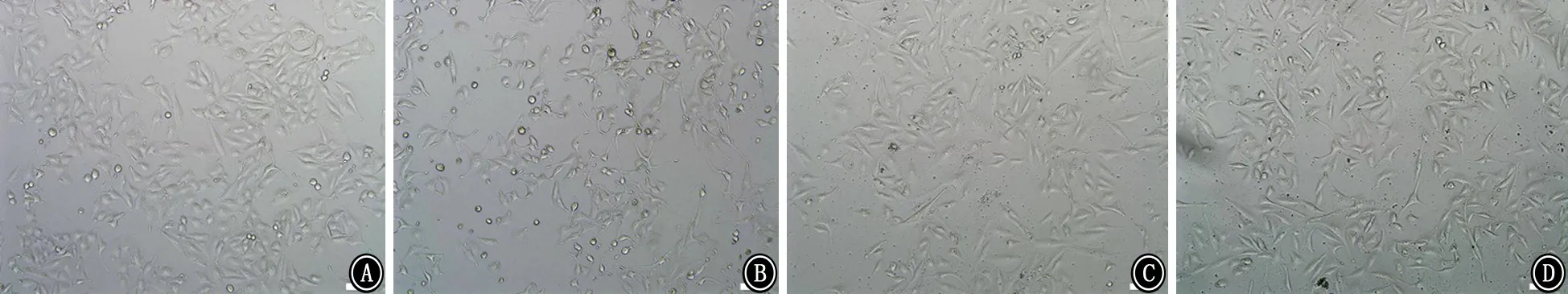
图3 加入LPS或PFC后48 h各组A549细胞形态 ×100 A:对照组;B:LPS组;C:PFC组;D:LPS+PFC组
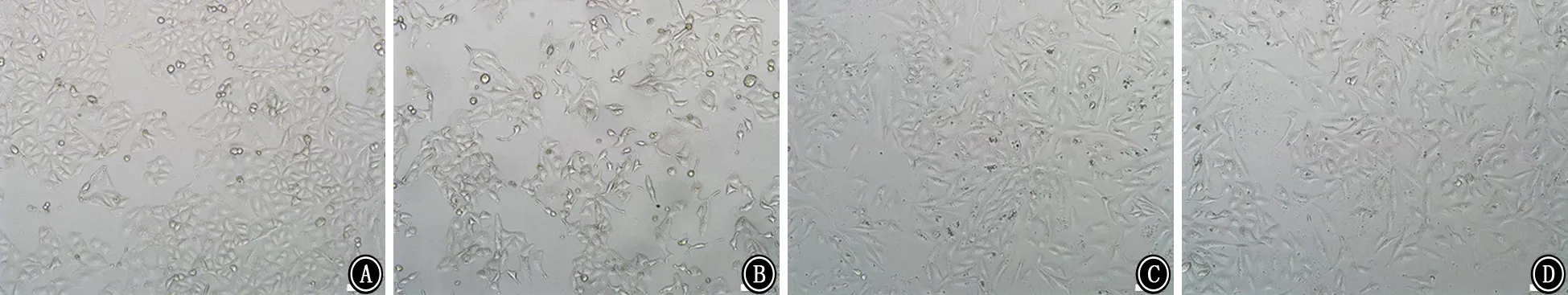
图4 加入LPS或PFC后72 h各组A549细胞形态 ×100 A:对照组;B:LPS组;C:PFC组;D:LPS+PFC组
表3 各组A549细胞的数目 (±s)
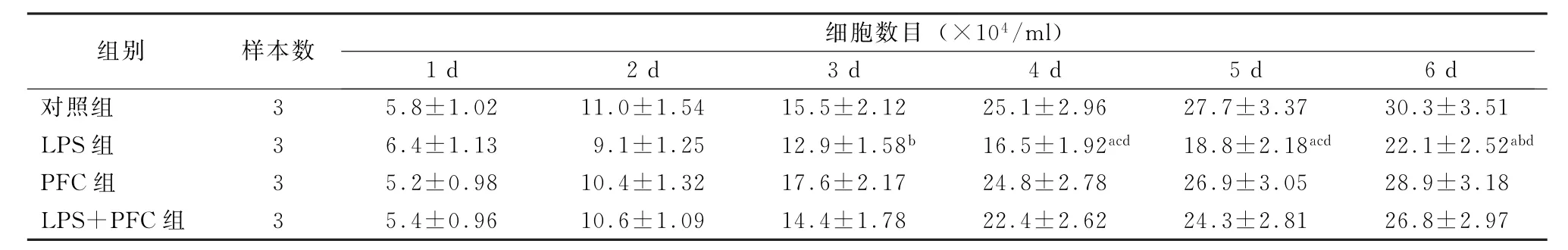
表3 各组A549细胞的数目 (±s)
注:LPS为脂多糖;PFC为全氟化碳;与对照组比较,a P<0.01;与PFC组比较,b P<0.05,c P<0.01;与LPS+PFC组比较,d P<0.05
组别 样本数细胞数目 (×104/ml)1 d 2 d 3 d 4 d 5 d 6 d对照组 3 5.8±1.02 11.0±1.54 15.5±2.12 25.1±2.96 27.7±3.37 30.3±3.51 LPS组 3 6.4±1.13 9.1±1.25 12.9±1.58b 16.5±1.92acd 18.8±2.18acd 22.1±2.52abd PFC组 3 5.2±0.98 10.4±1.32 17.6±2.17 24.8±2.78 26.9±3.05 28.9±3.18 LPS+PFC组 3 5.4±0.96 10.6±1.09 14.4±1.78 22.4±2.62 24.3±2.81 26.8±2.97
疗措施。在药物治疗方面,大部分治疗措施着重于控制炎症反应[5]。尽管肺损伤的发展取决于炎症介质对内皮细胞的损伤[6],其严重程度及恢复却依赖于上皮细胞的功能[7]。事实上,肺损伤最为显著的病理学改变是弥漫性肺泡上皮损伤[8-9];生理学上亦发现肺泡上皮结构与功能的完整性是肺损伤严重程度的重要决定因素[10];此外,肺泡上皮也是肺泡水肿液再吸收的位点,其在与ARDS相关的肺纤维变性中扮演重要角色[11-13],当肺泡上皮细胞未能有效修复时,缺损部位便被纤维细胞替代,从而导致肺纤维化。因此,以改善肺泡上皮细胞功能为目标的治疗措施可能是加速肺损伤的修复及降低ARDS病死率的关键因素。
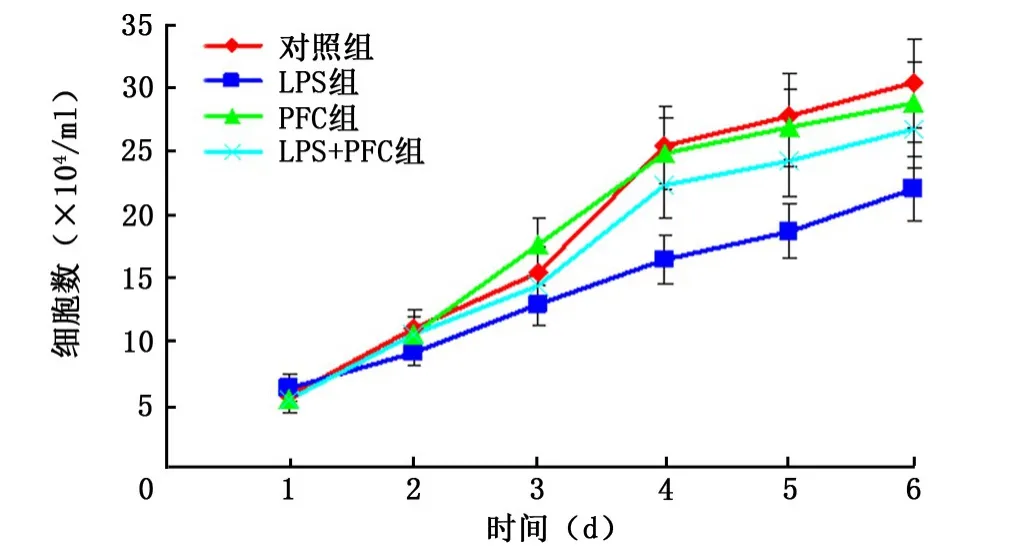
图5 各组A549细胞生长曲线
目前,由于PFC的理化和生物学特性,它已经广泛应用于完全液体通气及部分液体通气治疗ARDS,并取得良好效果[14-15]。国内外多项研究报道[16-18]PFC治疗ARDS可能有以下机制:(1)具有较高的携氧及二氧化碳能力,在肺内起着气体转运的作用;(2)在肺泡内形成PFC薄层,通过其低表面张力的特性发挥表面活性物质样作用,从而复张萎陷的肺泡,提高肺顺应性;(3)由于PFC的重力作用,其主要进入重力依赖区,压迫肺血管,使肺下垂部位的血流相对减少,从而改善肺内通气/血流比;(4)促进肺内源性肺泡表面活性物质产生;(5)有利于肺泡及小气道分泌物的排出;(6)抑制肺组织的炎性反应,防止或减轻肺损伤;(7)有稳定细胞膜及抑制肺内炎性介质及细胞因子释放的作用;(8)一定程度上抑制呼吸道细菌生长繁殖[19]。但目前国内外尚无PFC治疗ARDS的细胞生物学研究报道。
PFC治疗ARDS的细胞生物学研究主要关注的是细胞形态、增殖、迁移及凋亡等方面的变化,而肺泡上皮细胞的以上生物学功能在肺损伤的修复中发挥重要作用。鉴于此,本研究从细胞生物学角度探讨了PFC对LPS诱导A549细胞损伤的保护作用,试图为临床应用PFC治疗ARDS提供细胞生物学理论依据。
细胞形态学是反映细胞生长状态最为直观的指标。本研究通过形态学观察,发现LPS作用于A549细胞使其形态皱缩,生长状态变差,PFC本身对其形态无明显影响,当PFC与LPS共同孵育A549细胞时,能够显著改善LPS对其形态及生长状态的不良影响。
细胞生长曲线是测定细胞绝对生长数的常用方法,也是判定细胞活力的重要指标,是细胞生物学特性的基本参数之一。本研究应用细胞计数法绘制生长曲线,发现LPS能够明显抑制A549细胞的增殖能力,而PFC本身对其增殖能力没有影响,当PFC与LPS共同孵育A549细胞时,能够显著改善LPS对其增殖的抑制作用。
综上所述,本研究证实LPS作用于A549细胞能够使其形态皱缩,生长状态变差,且能够明显抑制其增殖能力及迁移能力,并因此抑制其损伤的修复,而PFC能够明显减轻LPS诱导的以上损伤改变,进而促进A549细胞的损伤修复能力。PFC对LPS导致的A549细胞损伤产生的以上保护作用,可能是其在既往的临床研究及动物实验中发挥保护作用的机制之一,其分子机制尚有待进一步的研究。
利益冲突所有作者均声明不存在利益冲突
