基因芯片技术在快速诊断肺结核中的应用价值
2019-07-16
2016年,全球估计有170万患者死于结核病,约有新发结核病例1 040万,其中半数集中在中国、印度等5个国家[1]。早期、快速、准确诊断结核,是结核防治的关键。
结核病的确诊主要依靠病原学,传统病原学检测以抗酸染色及培养为主。抗酸染色简便、价廉,是目前使用最广的结核诊断方法,但阳性率不高,多在9.8%~35.5%[2-3],且无法鉴别结核分枝杆菌(Mycobacteriumtuberculosis,MTB)与非结核分枝杆菌。本研究采用液基夹层杯涂片法检测MTB,与直接抗酸染色相比,标本经消化、离心、浓缩等处理后,阳性率可提高至23.5%~66.67%[3-7]。MTB培养是诊断活动性肺结核的“金标准”,但周期长,罗氏培养至少需4~8周[8],液体培养如BACTEC-MGIT 960系统虽耗时更短,仍需1~2周[9-10],均难以满足临床需求,新的诊断技术亦应运而生。近年来,基因芯片技术逐渐广泛应用于结核诊断,有研究报道基因芯片法诊断MTB的敏感性为82.3%~99.5%,特异度可达100%[11-13]。
本研究对648例疑似肺结核患者的临床标本同时采用基因芯片法、改良罗氏培养法、液基夹层杯涂片法(以下分别简称“芯片法”、“培养法”、“夹层杯法”)进行MTB检测,通过对3种方法的阳性率、敏感性、特异度等指标进行比较,评价基因芯片技术在快速诊断肺结核中的应用价值。
1 材料与方法
1.1 材料
1.1.1研究对象 2016年2月-2017年9月重庆医科大学附属第一医院呼吸科住院的疑似肺结核患者648例,其中男性409例,女239例,年龄14~95岁,平均50±18.5岁。所有患者均进行胸部影像学检查,同时留取体液标本,包括痰331例、支气管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)243例、胸水74例,同时送检芯片法、培养法及夹层杯法检测MTB。
1.1.2诊断标准及筛选结果 肺结核诊断标准参照《肺结核诊断标准 WS288-2008》[14],非结核的其他肺部疾病诊断参照《临床诊疗指南-呼吸病学分册》[15]。648例患者,最终有435例诊断为肺结核,213例为非结核病(肺癌106例,社区获得性肺炎48例,肺脓肿32例,支气管扩张伴感染27例)。
1.1.3主要实验仪器及试剂 夹层杯II,载玻片、自动离心涂片机、快速干片机、染色液,均购买于湖南天气医学新技术有限公司;改良罗氏培养基(中性)由贝索公司提供;普通PCR扩增仪,高速离心机,核酸提取仪,SlideWasherTM芯片洗干仪,BioMixerTMII芯片杂交仪。LuxScanTM10K/B微阵列芯片扫描仪、晶芯分枝杆菌菌种鉴定试剂盒以及试剂购于博奥生物有限公司。
1.2 实验方法
1.2.1液基夹层杯涂片 取痰标本3~5 mL、胸水和BALF标本10~20 mL于夹层杯II,进行消化、震荡、离心、烘干;加入染色剂,以60 ℃左右染色5 min,冲洗、沥干;脱色;再次加入染色剂染色1~3 min,洗净、沥干。取出封片、镜检。读片参照《肺结核诊断标准 WS288-2008》[14]。
1.2.2改良罗氏培养 痰标本3~5 mL进行消化、离心、浓缩;胸水和BALF标本10~20 mL以3 000 g离心、浓缩,均匀接种于培养基。将培养基水平置于37 ℃培养箱24 h后改竖直放置;于第3 d、7 d观察细菌生长情况,以后每周观察1次,连续8周。报告标准参照《肺结核诊断标准 WS288-2008》[14]。
1.2.3基因芯片检测 标本内加入消化液,涡旋震荡2 min,室温液化60 min后离心。取1 mL液化后标本于1.5 mLEP离心管内,于沉淀内加入50~80 μL核酸提取液,并转移到核酸提取管内震荡5 min,后95 ℃金属浴5 min,10 000 r/min离心1 min,提取核酸备用。将模板DNA和对照品2 μL分别加入PCR管行PCR扩增;将PCR产物在95 ℃下变性5 min、骤冷冰浴。以9 μL杂交缓冲液、6 μL PCR产物的比例制杂交混合物。取混合物13.5 μL加入芯片并密封杂交盒;放入芯片杂交仪以50 ℃、5 r/min杂交2 h。洗涤、甩干,于芯片扫描仪判读结果。
结果判读:在质控探针信号正常的情况下,若某一探针信噪比≥3,且其信号值≥其对应的临界值,则该探针结果为阳性;否则为阴性。菌种鉴定结果根据探针阴阳性结果判断,若只有1条探针为阳性结果,则表示待测样品为该探针所对应的分枝杆菌种或群;若有1条以上探针为阳性结果,则通过组合来确定待测样品所对应的分枝杆菌种或群。
1.3统计学方法 采用SPSS 20.0软件进行统计分析,用Kappa检验对不同方法检测结果的一致性进行评价,即Kappa≥0.75,两者一致性好;0.75>Kappa≥0.4,两者一致性中等;Kappa<0.4,两者一致性较低。所有结果均采用χ2检验进行差异性分析,以P<0.05为差异有统计学意义。
2 结 果
2.13种方法的阳性率 芯片法最高(58.30%),其次为培养法(51.40%),夹层杯法最低(36.70%)(见表1)。
表1 3种检测方法的阳性检出来
Tab.1 Positive rates of the 3 detection method

方法总 数(例)阳性数(例)阳性率(%)χ2P值芯片法64837858.306.310.012a培养法64833351.4028.25<0.05b夹层杯法64823836.7060.64<0.05c
注:a对比芯片法、培养法 ; b对比培养法与夹层杯法 ; c对比芯片法与夹层杯法。
2.23种方法的敏感度和特异度 以培养法为金标准,芯片法的敏感度、阳性预测值以及与培养法结果的一致性均高于夹层杯法,特异度较夹层杯法稍低(见表2)。
2.3与临床诊断的比较 以临床诊断结果为金标准,在非结核患者中,3种方法均无阳性结果,故特异度为100%,误诊率为0;芯片法与临床诊断一致性较好;培养法一致性一般;夹层杯法一致性较低。芯片法敏感度高,漏诊率低,特异度好,结果具有较高的准确性,见表3。
表2 芯片法及夹层杯法检测结果与培养法的对比分析
Tab.2 Comparative analysis of results from the gene chip technique and Liquid-based interlayer vessel technique and Roche culture results

方法培养法敏感度/%特异度/%符合率/%PPV/%NPV/%KappaP值+-芯片法+3186095.58188.4384.1394.440.767<0.05-15255夹层杯法+2172165.293.378.8691.1871.70.623<0.05-116294
注:PPV是阳性预测值;NPV是阴性预测值。
表3 3种方法检测结果与临床诊断的对比分析
Tab.3 Comparison of test results and clinical diagnosis of the 3 methods
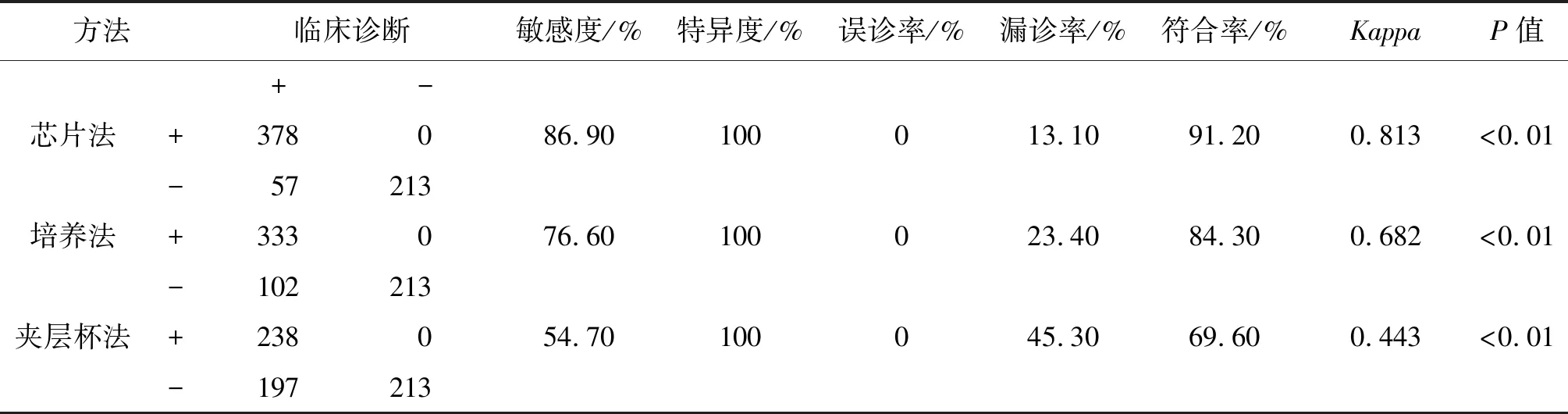
方法临床诊断敏感度/%特异度/%误诊率/%漏诊率/%符合率/%KappaP值+-芯片法+378086.90100013.1091.200.813<0.01-57213培养法+333076.60100023.4084.300.682<0.01-102213夹层杯法+238054.70100045.3069.600.443<0.01-197213
2.4不同标本的阳性率 3种标本使用芯片法检测,阳性率最高为BALF 72.0%(175/243),其次为痰54.4%(180/331),胸水最低31.1%(23/74);使用培养法阳性率由高到低依次为BALF 62.6%(152/243),痰48.6%(161/331),胸水 27%(20/74);夹层杯法阳性率为BALF 51.8%(126/243),痰30.8%(102/331),胸水 13.5%(10/74)。差异均具有统计学意义 (见图4)。

图4 不同标本的阳性率对比分析Fig.4 Comparison of positive rates of different specimens
2.5胸水用不同方法检测MTB的阳性率 使用芯片法、培养法、夹层杯法检测胸水MTB,阳性率依次为31.1%(23/74)、27%(20/74)、13.5%(10/74)。芯片法高于夹层杯法,差异具有统计学意义(χ2=6.591,P<0.05);芯片法阳性率高于培养法,但差异不具有统计学意义(χ2=0.295,P>0.05)(见表5)。
表5 胸水使用不同检测方法阳性检出率比较
Tab.5 Comparison of positive rates of pleural effusion using different detection methods

阳性率/%χ2值P值芯片法31.10(23/74)0.2950.587a培养法27(20/74)4.181<0.05b夹层杯法13.51(10/74)6.591<0.05c
注:a对比芯片法与培养法; b对比培养法与夹层杯法; c对比芯片法与夹层杯法。
3 讨 论
基因芯片通过检测固定于特殊载体上的多种探针与待测样本核酸的杂交信号强度而获取样本信息[16]。由于MTB的16S rRNA和rpoB基因是具有种属特异性的高度保守序列,故可直接将分枝杆菌鉴定到种[17]。该方法具有高通量、高效快捷(6 h)、灵敏度高、自动化等优势[18]。2017年11月新发布的肺结核诊断标准[19]已增加分子生物学结果作为确诊依据。本研究所使用的基因芯片能够检测出结核分枝杆菌(MTB)及包括鸟分枝杆菌、戈登分枝杆菌、胞内分枝杆菌、堪萨斯分枝杆菌等在内的常见的16个种、群的NTM,快速进行分枝杆菌菌种鉴定,为迅速诊断肺结核提供依据。
3种方法检测MTB,以芯片法的阳性率最高(58.3%),其次为培养法(51.4%),夹层杯法最低(36.7%);其中,芯片法阳性而培养阴性的患者共60例,这些患者均符合肺结核诊断标准[14],且抗结核治疗后随访症状好转和(或)病灶吸收。其芯片法阳性而培养阴性的原因,可能与标本类型有关。该60例标本中,以BALF和痰为主(31例BALF、21例痰、8例胸水),且芯片法灵敏度高(1×103个菌/反应),故芯片法阳性而罗氏培养阴性。
以培养法为标准,芯片法灵敏度(95.5%)、阴性预测值(94.44%)以及一致性均显著高于夹层杯法(65.2%、71.7%);但特异度(81%)较夹层杯法(93.3%)低,分析其原因,可能与基因芯片法能够进一步将分支杆菌鉴定到种,区分NTM和MTB有关。
BALF、痰、胸水标本用同时使用3种方法检测MTB,阳性率由高到低依次均为BALF、痰、胸水。提示MTB检出率与标本类型有关。
BALF直接取自病变支气管内或靠近病变区域,且检查等机械刺激后,标本获得MTB的机会增大,故阳性率高。常占平[20]等发现BALF快速培养阳性率(83.6%)显著高于纤支镜术后痰培养(57.2%)。尤其对于痰少、病灶局限、引流支气管欠通畅、非活动性肺结核患者,使用BALF检测MTB优势明显[21]。
痰MTB检测阳性率不高,且易受到多种因素的干扰,标本质量、涂片技术以及读片准确性等都可影响痰检结果。宋红焕[5]报道,脓性痰的阳性率(47.5%)高于非脓性痰(13.5%)。而增加送检标本数可提高阳性检出率[22]。
胸水是胸膜对MTB抗原的免疫反应所产生的,故MTB含量极少,加上胸水的稀释、取材、送检等影响,其涂片、培养阳性率均不高[23],导致结核性胸膜炎确诊困难。其直接涂片阳性率在10%左右[24],培养阳性率也仅15.9%~36.6%[25-26]。本研究同时上述3种方法检测胸水MTB,阳性率依次为芯片法(31.1%)、培养法(27%)、夹层杯法(13.51%)。芯片法高于夹层杯法,差异有统计学意义;芯片法与培养法相比,虽然差异不具有统计学意义,但芯片法耗时(6 h)显著低于培养法(4~8周),且具准确率高、污染率低、生物安全性高等优势,能够早期、快速、准确诊断结核性胸膜炎。因此,建议考虑诊断结核性胸膜炎,送检胸水行MTB检测时,可优先选择或同时送检基因芯片法检测,以辅助诊断。
综上所述,基因芯片技术诊断肺结核的敏感度高、特异度好,准确性高,其对于胸水MTB检测的阳性率并不低于培养法,且耗时显著缩短,并能将分枝杆菌鉴定到种。能够为早期、快速、准确诊断肺结核提供重要依据,具有良好的应用前景。此方法还可作为结核治疗效果评价的指标,但尚需进一步的临床试验证实。
