不同慢性阻塞性肺疾病全球倡议分级慢性阻塞性肺疾病稳定期患者外周血辅助性T细胞17、调节性T细胞含量的对比分析
2019-07-15金晶王晶荆晶李风森
金晶 ,王晶 ,荆晶 ,李风森
长期气道慢性炎症持续状态是导致慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者急性加重的主要原因[1],近年来辅助性T细胞17(T helper 17 cells,Th17)/调节性T细胞(regulatory T cells,Treg)失衡所致免疫应答反应过度或免疫抑制作用过强在COPD发病机制中的作用逐渐受到关注[2-3]。Th17与Treg共同维持机体免疫平衡,其中Th17可在一定程度上评估COPD患者病情严重程度及预后[4],而Treg可反映有害气体或颗粒等所致气道炎症严重程度,并具有一定抑制炎症作用[5]。本研究旨在对比不同慢性阻塞性肺疾病全球倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)分级[6]COPD 稳定期患者外周血Th17、Treg含量,以期为临床有效治疗COPD稳定期患者提供新的靶点,现报道如下。
1 对象与方法
1.1 研究对象 选取2017年6—12月于新疆医科大学附属中医医院接受门诊随访的COPD稳定期患者96例,年龄45~80岁,均符合2013版GOLD中的COPD稳定期诊断标准[6],排除标准:(1)伴有气胸、胸腔积液、活动性肺结核等其他肺部疾病者;(2)伴有严重心、脑血管疾病,肝、肾功能不全,造血系统疾病等者;(3)伴有精神异常者;(4)妊娠期或哺乳期妇女;(5)伴有恶性肿瘤者;(6)存在先天或后天性免疫缺陷者。参照2013版GOLD分级标准将所有患者分为B级组40例、C级组23例、D级组33例;另选取同期于新疆医科大学附属中医医院体检中心体检且年龄匹配的健康者30例作为对照组。本研究经新疆医科大学附属中医医院医学伦理委员会审核批准(审批号:20170214-116),4组受试者对本研究知情同意并签署知情同意书。
1.2 2013 版GOLD分级标准 2013版GOLD分级标准涉及肺功能、慢性阻塞性肺疾病评估测试(COPD Assessment Test,CAT)评分、入组前12个月内急性加重次数及住院次数4项,以症状少病情轻为A级,症状多病情轻为B级,症状少病情重为C级,症状多病情重为D级。
1.3 仪器及试剂 流式细胞检测仪(guava easy Cyte8HT,MILLIPORE公司生产,中国),Multiskan Spectrum全波长酶标仪(德国 Thermo Fisher公司生产),流式上样管(12 mm×75 mm,5 ml,Falcon);Treg抗 体:CD4( 美国BD公司生产,生产批号:555346),CD25(美国BD公司生产,生产批号:555434),CD127(美国BD公司生产,生产批号:557938);Th17抗体:CD4(美国BD公司生产,生产批号:555346),CD183(美国BD公司生产,生产批号:550967),CD196(美国BD公司生产,生产批号:559562);人白介素17a(IL-17a)、白介素10(IL-10)酶联免疫吸附试验(ELISA)试剂盒(武汉基因美生物科技有限公司生产,生产批号:96T48TCY40067、96T48TCY40062)。
1.4 观察指标
1.4.1 一般资料 比较4组受试者性别、年龄、身高、体质量。
1.4.2 外周血IL-17a、IL-10水平 采集4组受试者外周血5 ml,3 000 r/min(离心半径3 cm)离心10 min,采用EP管留取血清并保存于-80 ℃冰箱;采用ELISA双抗夹心法检测外周血IL-17a、IL-10水平,严格按照试剂盒说明书进行操作。
1.4.3 外周血Th17、Treg含量及Th17/Treg比值 采集4组受试者外周血2 ml,加入100 μl肝素钠抗凝,Th17的检测依次加入表面标记抗体CD4 FITC 20 μl、CD3 PCP5.5 5 μl、CD183 APC 20 μl、CD196 PE 5 μl,混匀;Treg的检测依次加入表面标记抗体 CD4 FITC 20 μl、CD25 APC 20 μl、CD127 PE 5 μl、CD4 FITC 20 μl、CD3 PCP5.5 5 μl、CD183 APC 20 μl、CD196 PE 5 μl,混匀;避光孵育30 min后加入溶血素裂解红细胞,300×g离心5 min,弃上清并加入磷酸盐缓冲液(PBS)2 ml,300×g离心5 min,弃上清并加入PBS 500 μl,混匀后上机检测,将测得的数据存盘后采用CELL Quest软件进行分析,并计算Th17/Treg比值。
1.5 统计学方法 采用SPSS 18.0软件进行数据分析,年龄、身高、体质量、外周血IL-10及IL-17a水平、外周血Th17及Treg含量、Th17/Treg比值均符合正态分布,以(±s)表示,多组间比较采用单因素方差分析,两两比较采用q检验;性别以相对数表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 4组受试者性别、年龄、身高比较,差异无统计学意义(P>0.05)。4组受试者体质量比较,差异有统计学意义(P<0.05);B级组、C级组、D级组患者体质量小于对照组,C级组、D级组患者体质量小于B级组,D级组患者体质量小于C级组,差异有统计学意义(P<0.05,见表1)。

表1 4组受试者一般资料比较Table 1 Comparison of general information in the four groups
2.2 外周血IL-17a、IL-10水平 4组受试者外周血IL-17a、IL-10水平比较,差异有统计学意义(P<0.05);B级组、C级组、D级组患者外周血IL-17a水平高于对照组,C级组、D级组患者外周血IL-17a水平高于B级组,D级组患者外周血IL-17a水平高于C级组,差异有统计学意义(P<0.05);B级组、C级组、D级组患者外周血IL-10水平低于对照组,C级组、D级组患者外周血IL-10水平低于B级组,D级组患者外周血IL-10水平低于C级组,差异有统计学意义(P<0.05,见表2)。
表2 4组受试者外周血IL-17a、IL-10水平比较(±s,ng/L)Table 2 Comparison of peripheral blood IL-17a and IL-10 levels in the four groups
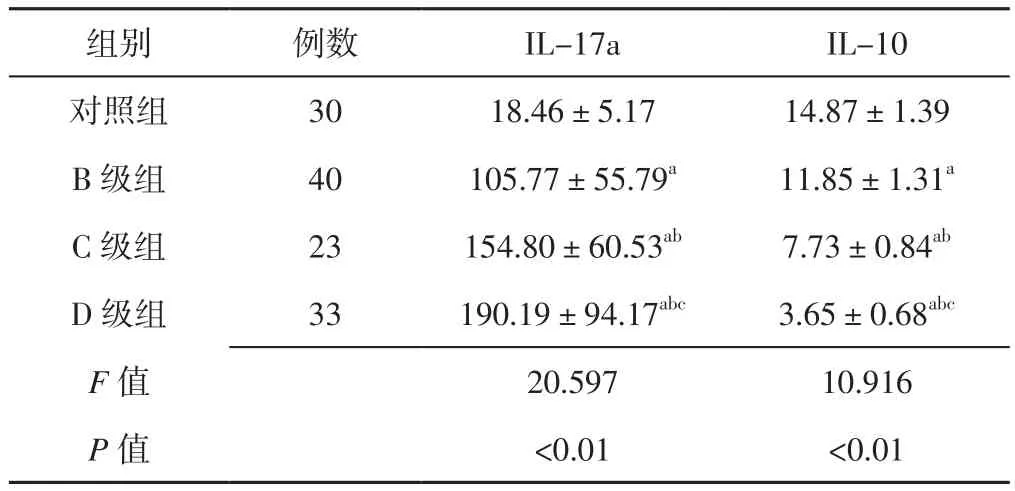
表2 4组受试者外周血IL-17a、IL-10水平比较(±s,ng/L)Table 2 Comparison of peripheral blood IL-17a and IL-10 levels in the four groups
注:IL-17a=白介素17a,IL-10=白介素10;与对照组比较,aP<0.05;与B级组比较,bP<0.05;与C级组比较,cP<0.05
组别 例数 IL-17a IL-10对照组 30 18.46±5.17 14.87±1.39 B级组 40 105.77±55.79a 11.85±1.31a C级组 23 154.80±60.53ab 7.73±0.84ab D级组 33 190.19±94.17abc 3.65±0.68abc F值 20.597 10.916 P 值 <0.01 <0.01
2.3 外周血Th17、Treg含量及Th17/Treg比值 4组受试者外周血Th17、Treg含量及Th17/Treg比值比较,差异有统计学意义(P<0.05);B级组、C级组、D级组患者外周血Th17含量及Th17/Treg比值高于对照组,C级组、D级组患者外周血Th17含量及Th17/Treg比值高于B级组,D级组患者外周血Th17含量及Th17/Treg比值高于C级组,差异有统计学意义(P<0.05);B级组、C级组、D级组患者外周血Treg含量低于对照组,C级组、D级组患者外周血Treg含量低于B级组,D级组患者外周血Treg含量低于C级组,差异有统计学意义(P<0.05,见表3)。
表3 4组受试者外周血Th17、Treg含量及Th17/Treg比值比较(±s)Table 3 Comparison of peripheral blood Th17 and Treg contents,and Th17/Treg ratio in the four groups
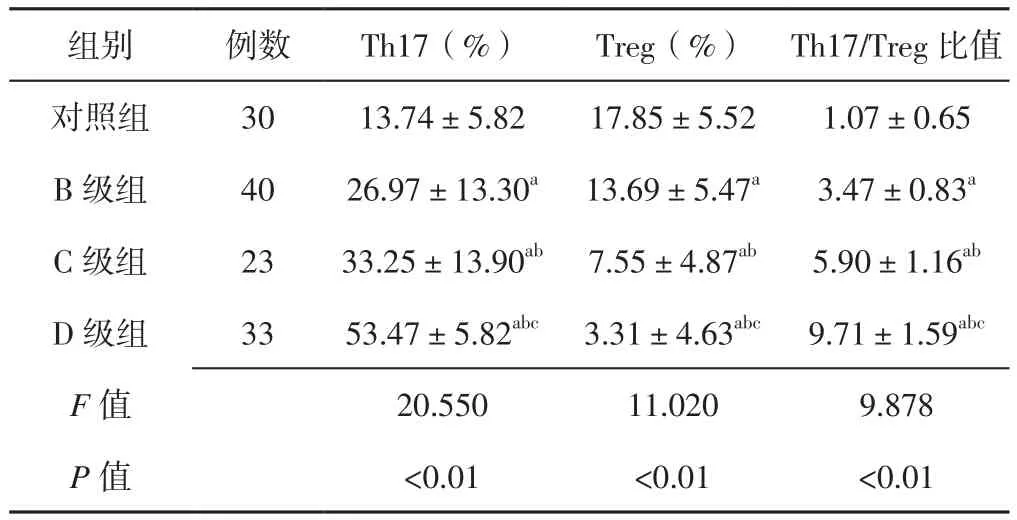
表3 4组受试者外周血Th17、Treg含量及Th17/Treg比值比较(±s)Table 3 Comparison of peripheral blood Th17 and Treg contents,and Th17/Treg ratio in the four groups
注:Th17=辅助性T细胞17,Treg=调节性T细胞;与对照组比较,aP<0.05;与B级组比较,bP<0.05;与C级组比较,cP<0.05
组别 例数 Th17(%) Treg(%) Th17/Treg比值对照组 30 13.74±5.82 17.85±5.52 1.07±0.65 B 级组 40 26.97±13.30a 13.69±5.47a 3.47±0.83a C 级组 23 33.25±13.90ab 7.55±4.87ab 5.90±1.16ab D 级组 33 53.47±5.82abc 3.31±4.63abc 9.71±1.59abc F值 20.550 11.020 9.878 P值 <0.01 <0.01 <0.01
3 讨论
近年来,炎症/免疫机制在COPD发病机制中的作用备受关注[7-8],Th17、Treg均属 CD4+T淋巴细胞亚群,二者分化过程及功能相互对抗,生理条件下保持着动态平衡,有利于维持机体免疫状态稳定,在免疫应答及免疫抑制方面具有重要作用[9]。中医辨证论治体系认为,疾病的发生与阴阳失衡有关,需通过“调和阴阳”而达到“阴平阳秘,邪不可干”的治疗疾病目的[10],Th17与Treg的关系犹如中医学阴阳关系,此消彼长、协调平衡[11]。
本研究结果显示,B级组、C级组、D级组患者体质量小于对照组,C级组、D级组患者体质量小于B级组,D级组患者体质量小于C级组,提示COPD稳定期患者体质量较低,且随着GOLD分级增加,COPD稳定期患者体质量逐渐降低,提示体质量可能与COPD稳定期患者病情严重程度有关[12];但由于COPD稳定期患者长期慢性炎症不仅局限于肺组织,还常伴有全身系统性炎症,因此不能排除全身系统性炎症所致COPD患者体质量降低。
研究表明,炎性反应和免疫功能紊乱在COPD发生、发展过程中具有重要作用[13]。本研究结果显示,B级组、C级组、D级组患者外周血IL-17a水平、Th17含量及Th17/Treg比值高于对照组,C级组、D级组患者外周血IL-17a水平、Th17含量及Th17/Treg比值高于B级组,D级组患者外周血IL-17a水平、Th17含量及Th17/Treg比值高于C级组,而B级组、C级组、D级组患者外周血IL-10水平、Treg含量低于对照组,C级组、D级组患者外周血IL-10水平、Treg含量低于B级组,D级组患者外周血IL-10水平、Treg含量低于C级组,提示COPD稳定期患者存在炎性反应、免疫功能紊乱,且随着GOLD分级增加,COPD稳定期患者炎性反应、免疫功能紊乱程度逐渐加重,分析其可能原因为:Th17可通过IL-17a而促进免疫应答并促使中性粒细胞聚集、活化及分泌多种炎性因子,而Treg介导免疫抑制,可通过释放IL-10而抑制T细胞及抗原呈递细胞功能,Th17/Treg失衡可导致促炎性因子分泌增多及机体抑制炎性反应作用不足,继而加重COPD患者炎性反应及病情严重程度[14-16]。
综上所述,随着GOLD分级增加,COPD稳定期患者外周血Th17含量逐渐升高、Treg含量逐渐降低,炎性反应、免疫功能紊乱程度逐渐加重,而有效控制Th17/Treg失衡、升高Treg含量对于改善COPD稳定期患者病情严重程度可能具有重要意义,并有可能成为中医宏观、西医微观防治稳定期COPD的新靶点。
