大剂量甲氨蝶呤治疗血液肿瘤的临床现状分析Δ
2019-07-15谈志远赵荣生
谈志远,陈 恳,刘 维,万 伟,胡 凯,赵荣生#
(1.北京大学第三医院药剂科,北京 100191; 2.北京大学药学院药事管理与临床药学系,北京 100191; 3.北京大学第三医院血液内科,北京 100191)
甲氨蝶呤(methotrexate,MTX)为临床常用的叶酸拮抗剂,小剂量(≤50 mg/m2)时应用于免疫相关疾病如类风湿关节炎。当给药剂量>500 mg/m2应用时为大剂量甲氨蝶呤(high-dose methotrexate,HDMTX),可单独应用或与其他化疗药联合应用,适用于急性白血病、高风险淋巴瘤(中枢、睾丸侵犯或难治者)、骨肉瘤和支气管肺癌等[1]。目前,HDMTX的应用面临着如下问题:(1)个体差异较明显。血药浓度受诸多因素影响,如患者的年龄、肝肾功能、尿的酸碱度、肿瘤类型、联合用药情况及其他体质因素等,且相关代谢酶的基因存在基因多态性,故理论上需要进行治疗药物监测(therapeutic drug monitoring,TDM)。(2)用药风险极高。HDMTX治疗指数低,毒性较大,可能引发肾毒性、肝毒性、黏膜毒性、胃肠道损伤、肺毒性、血液毒性、神经毒性、皮肤毒性和超敏反应等严重药品不良事件(adverse drug event,ADE)。(3)用药较复杂。HDMTX应用时的随行医嘱较多,涉及水化、碱化、尿液pH监测、输注时间、血药浓度监测、亚叶酸钙解救及出入量记录等。由此可见,HDMTX的给药相关环节复杂,在给药前后均需密切监测。文献检索结果显示,目前的临床研究主要集中于血药浓度/基因型与疗效、不良反应发生风险之间的关系[2-5]以及HDMTX个体化给药模型构建[6-8]等,尚无针对药物使用全流程进行完整分析的相关研究。本研究对某三级甲等医院(以下简称“该院”)血液肿瘤患者的HDMTX使用情况进行回顾性分析,以期对HDMTX用药全流程进行更高效的管理,规范HDMTX用药前评估、辅助用药、常规给药方法、TDM与解救等,提高HDMTX及其辅助药物临床应用的有效性及安全性。
1 资料与方法
1.1 资料来源
研究对象为2015年4月至2017年4月该院血液内科的住院患者。纳入标准:病理诊断为血液系统恶性肿瘤(需有细胞形态学、免疫组织化学、细胞遗传学或分子生物学诊断),中枢淋巴瘤/白血病患者需有明确的肿瘤中枢侵犯证据(如脑脊液检出肿瘤细胞、正电子发射计算机断层显像提示中枢存在高代谢病灶等);接受HDMTX单药治疗或联合化疗。本研究对象不限年龄及种族。
1.2 方法
1.2.1 设计研究的病例报告表(case report form,CRF):按照患者基本情况、治疗信息、用药前评估、碱化及维生素B、水化、亚叶酸钙解救、TDM和ADE等8个模块设计CRF,初稿经血液内科临床医师和临床药师审定修改,并随机选取3例患者的治疗信息进行预填,确定CRF终稿。
1.2.2 填写CRF:从血液内科临床药师工作记录中获取使用HDMTX治疗的患者病历号及姓名,在医院信息系统(hospital information system,HIS)中调取患者住院病历。采用单人录入(谈志远)、双人核对(陈恳、谈志远)的方式填写CRF。如有争议,寻求第三者(刘维)解决。
1.2.3 设计并录入电子数据库:采用Epidata 3.1软件建立HDMTX治疗血液肿瘤回顾性研究电子数据库,信息记录内容与CRF一致,变量类型包括数值型、字符型和布尔逻辑。单人录入(谈志远)CRF中的内容,在进行双人审核(陈恳、谈志远)校对后,保存,锁定。录入完毕后,数据导出为Excel表格。
1.2.4 数据统计与分析:按照病例基本信息、治疗信息、用药前评估、碱化水化、亚叶酸钙解救及漱口水、复合维生素B使用情况、TDM情况以及ADE情况,分模块统计该院血液内科HDMTX应用现状。
2 结果
2.1 患者的基本信息及治疗方案
本研究共纳入19例(31例次)患者,年龄12~69岁,中位年龄40岁;男性患者14例(占73.7%)。HDMTX共使用31例次,MTX输注剂量范围为0.81~3.36 g/m2,10例次(占32.3%)达到了原化疗方案要求的MTX剂量;18例次(占58.1%)采用24 h持续输注,其中15例次使用了负荷剂量;另外,10例次(占32.3%)采用3 h持续输注。患者的基本信息及治疗方案见表1。

表1 患者的基本信息及治疗方案Tab 1 Basic information and treatment plan of the patient
2.2 用药前评估
19例患者中,12例(占63.2%)进行了基因检测。其中,亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)677及1298位点均为野生型的病例数为0;MTHFR 677野生型1例,占8.3%;MTHFR 1298野生型8例,占66.7%;ATP结合盒B亚家族成员1转运蛋白基因(ATP-binding cassette subfamily B member 1,ABCB1)3435 CC型3例,占25.0%。所有化疗周期的患者均非胸腹水蓄积的病例;5例次(占总例次数31例次的16.1%)在化疗前或化疗期间使用了维生素C;所有患者在化疗前或化疗周期内均未使用磺胺类药物、非甾体抗炎药、环丙沙星、奥美拉唑或青霉素类抗菌药物。
2.3 碱化及水化
2.3.1 碱化:所有化疗周期的患者都在化疗前和(或)化疗期间进了碱化处理;96.8%(30例次)的化疗周期都持续碱化至MTX消除完毕。31例次患者中,29例次(占93.5%)在化疗当日(D1)使用了静脉碳酸氢钠;21例次(占67.7%)在MTX给药前1日(D0)开始碱化。碱化合格的标准是D1及化疗期间尿液pH≥7.0,在此标准下,共15例次患者(占48.4%)在D1测定了pH,达标11例次,达标率为73.3%;D1后,共2例次患者(占6.5%)出现尿液pH异常。
2.3.2 水化:31例次患者中,27例次(占87.1%)在化疗前和(或)化疗期间执行了医嘱记录出入量,D0记录出入量4例次(占12.9%)。水化合格的标准是D0至MTX清除完毕期间日入量应≥2.5 L/m2。对于未记录出入量的患者,日入量按照其静脉入量+饮食摄入液体量2 L计算。12例次患者(占38.7%)在D1至MTX清除完毕期间水化量达标,1例次患者(占3.2%)在D0水化量达标。
2.4 亚叶酸钙解救及漱口水使用情况
2.4.1 亚叶酸钙解救:31例次患者在HDMTX给药后接受了亚叶酸钙解救;其中,21例次(占67.7%)在给药后36 h内解救,7例次(占22.6%)在给药后24 h内解救,1例次(占3.2%)在给药后16 h内解救;30例次(占96.8%)起始时采用静脉亚叶酸钙解救;20例次(占64.5%)解救达标;28例次(占90.3%)持续至MTX消除完毕。
2.4.2 漱口水使用情况:29例次患者(占总例次数31例次的93.5%)使用了漱口水预防和治疗口腔黏膜炎,其中28例次(占96.6%)的漱口水配方中都使用了亚叶酸钙,仅1例次(占3.4%)的漱口水中加入了粒细胞-巨噬细胞集落刺激因子。
2.5 TDM情况
31例次使用HDMTX的患者都进行了TDM,15例次患者(占48.4%)监测了MTX峰浓度;24 h输注患者峰浓度监测比例为61.1%(11/18),3 h为30.0%(3/10);24 h输注后的MTX中位峰浓度为25.26 μmol/L(9.20~38.72 μmol/L),3 h输注后的MTX中位峰浓度为260 μmol/L(260~298 μmol/L),见表2。需要说明的是,23例次患者在开始给药后42或48 h进行了血药浓度监测,其中19例次MTX血药浓度≤1 μmol/L,由于另有1例次患者未测定42或48 h血药浓度,而其60 h时MTX血药浓度>1 μmol/L,故48 h时MTX血药浓度达标率为79.2%(19/24);8例次患者在开始给药后72 h进行了血药浓度监测,其中4例次MTX血药浓度≤0.1 μmol/L,由于另有2例次患者在42/48 h的MTX血药浓度就已≤0.1 μmol/L,且未测定72 h血药浓度,故72 h时MTX血药浓度达标率为60.0%(6/10)。

表2 TDM情况Tab 2 Statistics of therapeutic drug monitoring
2.6 ADE发生情况
ADE发生情况见表3。
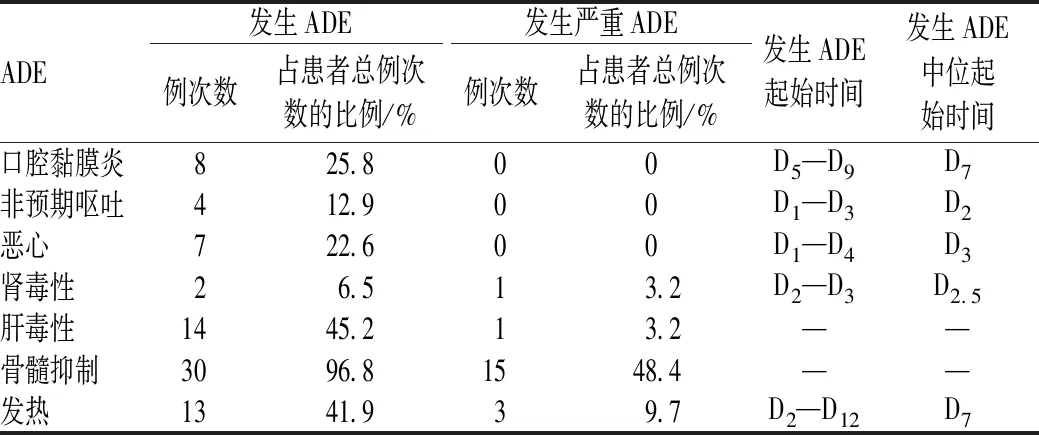
表3 ADE发生情况Tab 3 Incidence of adverse events
注:“—”表示肝毒性及骨髓抑制指标不单一,不同指标不能合并统计
Note:“—”means that indicators of hepatotoxicity and myleosuppression are not single, and different indicators cannot be combined for statistics
3 讨论
大量研究结果表明,MTHFR 677基因突变与不良反应风险增加相关[9]。本研究中,仅8.3%的患者MTHFR 677为野生型,提示大部分患者存在突变,临床应用HDMTX时需密切监测肝肾功能及口腔黏膜炎情况。
对于24 h持续输注,推荐采取负荷剂量,可以更快地达到稳态血药浓度以发挥效应[9]。本研究中,24 h持续输注的患者中,83.3%(15例次/18例次)的患者使用了负荷剂量。由于给予负荷剂量在临床上较容易实现,故后期应进一步提高24 h持续输注时负荷剂量的使用率。
本研究中,在HDMTX给药前,4项血常规指标均正常的患者占41.9%;5项肝功能指标均正常的患者占51.6%,指标异常的患者均为轻度异常。HDMTX具有血液毒性和肝脏毒性[1],应在血常规及肝功能指标正常后再进行给药。
酸性药物影响HDMTX的排泄[10],故HDMTX应避免与该类药物合用。本研究中,5例次患者在使用HDMTX过程中联合应用了注射用维生素C或水溶性维生素,但未见联合应用其他影响HDMTX排泄的药物(如质子泵抑制剂[11]、左乙拉西坦[12]及复方磺胺甲唑[13]等),可能的原因是维生素C在化疗患者中使用广泛,易被医护人员忽视。因此,在使用HDMTX化疗期间应加强对于维生素C或水溶性维生素使用的关注。
本研究中,所有的病例都进行了碱化且96.8%的患者持续至MTX消除完毕,93.5%的患者在D1使用了静脉碳酸氢钠,但仅67.7%的病例在D0使用了碳酸氢钠。尿液pH是判断碱化效果的指标,但在给药前51.6%的患者未进行尿液pH检测,进行检测的15例次患者中,达标率为73.3%。可见,在D0的碱化以及给药前尿液pH的测定等方面仍需要加强。本研究结果显示,87.1%的患者进行了出入量的监测,但仅38.7%的患者在化疗期间水化量达标,仅1例患者在D0水化量达标。最终发生急性肾损伤的2例患者中,1例患者在D0未进行水化,另1例患者在D2—D3水化量不达标。故在HDMTX使用过程中,应从D0开始加强水化并记录出入量。
本研究结果显示,亚叶酸钙解救率达100%,其中96.7%的患者起始采用静脉亚叶酸钙解救,90.3%的患者在24~36 h内进行了解救,但仅64.5%的患者解救剂量达标;漱口水使用率为93.5%,其中90.3%的患者使用的漱口水中含亚叶酸钙,但从D1即开始使用漱口水的患者仅占12.9%,故应协助临床医师提高D1漱口水的医嘱开具率。
监测42/48 h及72 h MTX血药浓度的意义在于提示MTX是否清除完毕[1]。很多患者没有在上述时间点监测MTX血药浓度,其原因在于上述时间点在非工作日,无法及时监测MTX血药浓度。因此,建议优化MTX给药时间,确保能够及时获得MTX血药浓度数据。
4 结论
本研究结果提示,血液内科临床药师在HDMTX使用过程的多个环节均应进行更多的主动干预,如维生素C的联合应用、碱化时机、水化时机与水化量、尿液pH监测、出入量监测、漱口水使用时机及血药浓度监测等。
本研究收集了HIS系统中HDMTX相关患者数据,但仍存在样本量较小的问题;部分指标获取存在困难,如口腔黏膜炎、恶心及呕吐的常见不良反应事件评价标准分级缺乏数据支持;未针对不同干预措施对患者结局指标的影响进行统计和分析。未来应运用真实世界研究的方法,收集更多患者的治疗信息,并开展队列研究和病例对照研究,为国内患者合理应用HDMTX提供更多的科学依据。
目前,HDMTX的规范使用在国内外没有定论,尽管各医院均有相应的院内用药规范,但外推性欠佳。因此,为进一步规范HDMTX的临床合理应用,确保HDMTX的疗效与安全性,药师不仅应加强临床实践能力,更应使用诸多方法进一步优化,如针对该类用药复杂的医嘱制订医嘱模板,甚至承担起药物相关临床指南制定的责任(如本课题组已在中国药理学会TDM研究专业委员会牵头下制定HDMTX临床用药指南),将证据与临床实践有机结合,最大程度改善患者的临床结局。
