丹参酮ⅡA通过调控巨噬细胞极化抗动脉粥样硬化的机制研究
2019-07-14陈文娜
陈 萍 陈文娜
1.辽宁中医药大学研究生学院 (辽宁 沈阳 110032);2.辽宁中医药大学医学检验学院(辽宁 沈阳 110032)
动脉粥样硬化是心脑肾等多种血管相关性疾病的主要病理基础,近年来,随着人类生活方式的改变和生活水平的改善,其发病逐渐呈现年轻化,发病率逐年升高,已经成为研究的热点问题之一[1]。目前研究认为,动脉粥样硬化的发病主要是由于长期的高脂饮食,加之运动减少,导致脂质代谢紊乱,低密度脂蛋白、胆固醇等异常沉积于血管内皮,导致血管内皮功能紊乱,血管内斑块形成,管壁增厚,弹性降低而发展成为动脉粥样硬化[2]。现代研究认为,血管内皮沉积导致的炎症损伤在动脉粥样硬化进程中发挥着重要作用,而巨噬细胞为体内重要的免疫细胞,在炎症反应中发挥着重要作用,巨噬细胞主要存在两种亚型,即经典激活的M1型巨噬细胞和替代性激活的M2型巨噬细胞,研究表明,不稳定斑块组织中主要以M1 型巨噬细胞为主,而稳定斑块组织中M2 型巨噬细胞比例增加,M1 与M2 型巨噬细胞处于动态平衡中[3]。因此,我们认为调控巨噬细胞适度的分化不仅可以减轻M1型巨噬细胞造成的血管损伤,同时亦可增强M2型巨噬细胞的抗炎反应,有助于血管的修复。丹参酮ⅡA是活血祛瘀中药丹参的主要有效成分,具有抗氧化、抗凋亡等药理学作用,被广泛应用于心血管疾病的治疗[4-5]。本研究从巨噬细胞极化为切入点,深入探讨丹参酮ⅡA抗动脉粥样硬化的作用机制。
1 材料与方法
1.1实验动物 SPF级ApoE-/-小鼠20只,相同遗传背景的C57BL/6J小鼠10只,8周龄,购自于北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001。饲养于我校SPF级动物中心。
1.2主要试剂与仪器 丹参酮ⅡA磺酸钠购于上海第一生化药业有限公司(国药准字H31022558,生产批号1411105),TG、TC、LDL、HDL检测试剂盒购于四川迈克生物科技有限公司。
1.3动物分组、造模及干预 20只ApoE-/-小鼠随机分为模型组和丹参酮ⅡA干预组(简称“干预组”),均给予高脂饲料喂养,复制动脉粥样硬化模型;10只C57BL/6J作为对照组,予普通小鼠维持饲料喂养。喂养8周后,干预组予腹腔注射丹参酮ⅡA磺酸钠,10 mg·kg-1·d-1,模型组和空白组给予等量生理盐水腹腔注射。12周后,0.5%戊巴比妥钠腹腔麻醉后,心脏穿刺收集血液并分离血清,分离小鼠腹主动脉至主动脉,分别固定于4%多聚甲醛和冻存于-80 ℃超低温冰箱中待测。
1.4检测指标及方法
1.4.1 血脂水平检测 采用全自动生化分析仪分析各种小鼠血清血脂水平变化。
1.4.2 主动脉组织形态学检测 分别采用HE染色法观察各组小鼠主动脉组织形态学变化。将4%多聚甲醛溶液中固定的主动脉组织取出进行包埋切片,切片厚度为5μm,烘片后进行脱蜡、复水,苏木素-伊红染色,最后使用中性树胶进行封片,普通光学显微镜下观察主动脉组织形态学变化,并采集图像。
1.4.3 Western Blot法检测相关蛋白磷酸化水平变化 采用Western Blot法检测各组小鼠主动脉NF-κB、STAT1、STAT6蛋白水平变化。取小鼠主动脉20mg,采用RIPA蛋白裂解液提取蛋白,BCA法测定蛋白浓度,loading Buffer与提取后的蛋白裂解液混合后,100℃金属液加热5分钟。采用SDS-PAGE凝胶电泳法分离蛋白,并将蛋白转移至PVDF膜上,5%脱脂奶粉室温下封闭1h后,一抗孵育,4℃过夜,次日回收一抗,TBST洗膜3次,每次5~10分钟,室温下二抗孵育1h,弃去二抗,TBST洗膜3次,每次5~10分钟,洗膜后采用ECL发光液进行发光,化学法学发光仪下进行曝光并拍摄图像。
1.4.4 RT-PCR法检测相关mRNA水平变化 采用RT-PCR检测各组小鼠主动脉TNF-α、IL-6、TGF-β1和IL-10 mRNA表达水平。取50mg主动脉组织液氮低温研磨后加入1 mL Trizol,加入氯仿μL,离心后,取上层水相,加入等量异丙醇沉淀RNA,离心,加入75%乙醇洗涤,离心,风干后加入无RNA 酶水溶解。紫外吸收测定法测定RNA浓度和纯度。逆转录成cDNA 模板,采用SYBR Green 进行实时荧光PCR,反应参数为95℃ 30s,1个循环;95℃ 5s,55℃10 s,40个循环反应,采用△△Ct法计算各组表达差异。全部引物有大连Taraka生物科技有限公司合成。引物序列见表1。
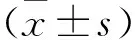

表1 引物序列表
注:F,forward;R,reverse
2 结果
2.1各组小鼠血脂水平变化情况 血脂水平检测结果显示,与对照组比较,模型组小鼠血清TG、TC和LDL水平明显升高(P<0.01 或P<0.05),血清HDL水平降低,但无统计学意义(P>0.05),与模型组比较,丹参酮干预组小鼠血清TG、TC、LDL水平降低(P<0.01或P<0.05)。

图1 注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.2各组小鼠主动脉组织形态学变化 HE染色结果显示,与对照组比较,模型组小鼠主动脉内有明显斑块形成;与模型组比较,丹参酮ⅡA干预组主动脉内斑块明显减小。

图2
2.3各组小鼠主动脉蛋白水平变化 Western Blot结果显示,与对照组比较,模型组小鼠主动脉与M1极化相关的信号通路NF-κB、STAT1磷酸化水平明显升高(P<0.05),与M2极化相关的信号通路STAT6磷酸化水平降低(P<0.05);与模型组比较,干预组小鼠主动脉NF-κB、STAT1磷酸化水平降低(P<0.05),STAT6磷酸化水平明显升高(P<0.05),见图3。
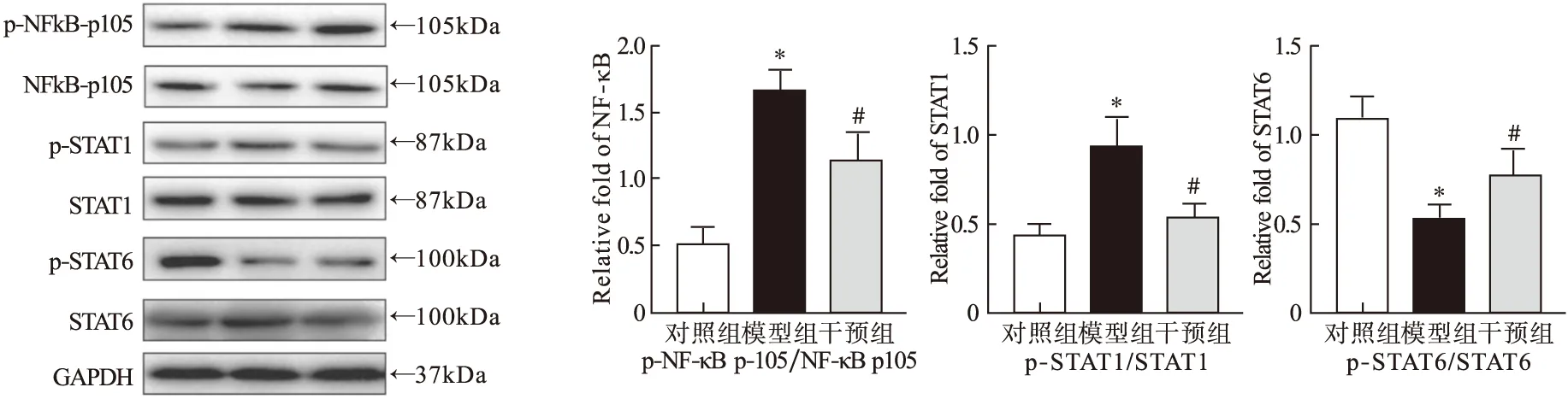
图3 各组小鼠主动脉蛋白表达情况 注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.4各组小鼠主动脉mRNA水平变化 qRT-PCR结果显示,与对照组比较,模型组小鼠主动脉与M1型细胞活化相关的基因(促炎因子)TNF-α、IL-6 mRNA水平升高(P<0.05),而与M2型细胞活化相关的基因(抗炎因子)TGF-β、IL-10 mRNA水平降低(P<0.05);与模型组比较,干预组小鼠主动脉TNF-α、IL-6 mRNA水平降低(P<0.05),TGF-β、IL-10 mRNA水平升高(P<0.05),见图4。

图4 各组小鼠主动脉基因mRNA表达情况 注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
3 讨论
动脉粥样硬化是一种慢性炎症引发的疾病,最终导致动脉壁增厚及斑块形成,是诱发心肌梗塞及中风等心血管疾病的主要因素。目前研究认为动脉粥样硬化的发生为一个慢性的炎症反应过程,主要为脂质沉积于血管内膜,导致单核细胞募集并被刺激分化为巨噬细胞吞噬脂滴形成泡沫细胞逐渐发展成为动脉粥样硬化斑块[6-7]。巨噬细胞的分型是根据其极化后所发挥的功能进行命名的,即以分泌促炎因子为主、发挥促炎活性的为M1型巨噬细胞;分泌抗炎因子、发挥抗炎及组织修复作用的细胞为M2型巨噬细胞[8-9].既往研究发现不稳定斑块组织中主要以M1 型巨噬细胞为主,而稳定斑块组织中M2 型巨噬细胞比例增加,M1 与M2 型巨噬细胞处于动态平衡[10]。M1型巨噬细胞可以产生大量一氧化氮(NO)、活性氧等中间产物,在血管内皮损伤过程中发挥着重要作用,而M2型巨噬细胞可产生大量IL-10及少量IL-12,参与组织重塑、血管发生和肿瘤发展等过程,同时有研究发现,M2型巨噬细胞的活化能有效减轻M1 型巨噬细胞引发的血管免疫损伤,对于炎症反应后期的组织损伤具有修复和重塑作用[11-12]。
中医学认为,动脉粥样硬化为本虚标实之证,气虚血亏,脾虚痰湿不化,内生痰浊、血瘀,加之感受外邪、饮食失调、情志不畅等因素为诱因导致本病的发生,认为心主血脉功能失司,血脉失于濡养,气血运行不畅,加之肥甘厚味,脾虚痰浊内生,瘀血阻滞,痰瘀互结,而导致本病发生的主要病机[13-14]。中医学对于本病的治疗多采用活血化瘀法进行干预[15],中药丹参是治疗心血管疾病常用的中药,临床疗效确切,课题组既往研究发现中药丹参的有效成分丹参酮II A能够有效改善动脉粥样硬化硬化小鼠血脂水平及主动脉斑块形成情况,但其具体机制尚不明确,本次研究以巨噬细胞极化在动脉粥样硬化斑块稳定性及炎症反应为切入点,深入探讨丹参酮II A抗动脉粥样硬化的机制。本研究结果显示,与对照比较,模型组小鼠血清TG、TC和LDL水平明显升高,主动脉内有明显斑块形成,巨噬细胞分泌的促炎因子水平明显升高,而经丹参酮II A干预后,与模型组比较,干预组小鼠血清TG、TC、LDL水平明显降低,主动脉内斑块明显减小,巨噬细胞分泌的促炎因子水平明显减低,抗炎因子水平明显升高。研究结果表明,丹参酮ⅡA可有效诱导动脉粥样硬化斑块中巨噬细胞从M1型向M2型极化的过渡,降低斑块内的炎症反应,从而延缓动脉粥样硬化斑块的进展。同时,我们发现通过上调p-STAT1/NF-κB信号通路可诱导巨噬细胞向M1型极化,而丹参酮ⅡA可有效激活p-STAT6磷酸化,诱导巨噬细胞向M2型极化,从而降低炎症反应,提高动脉粥样硬化斑块的稳定性。
