HER2靶向聚合物超声造影微泡的制备及其体外实验
2019-07-12程跃跃余方芳杨琰吴森敏李佳萍
程跃跃,余方芳,杨琰,吴森敏,李佳萍
(1.温州医科大学附属第二医院育英儿童医院 超声影像科,浙江 温州 325027;2.温州医科大学 眼视光学院 生物医学工程学院,浙江 温州 325035)
超声分子成像是一种极具前景的新型非侵入性生物分子显像技术。而靶向超声造影剂微泡(microbubbles,MBs)的研制是超声分子成像的基础与关键[1]。聚丙烯酸丁酯(poly n-butylcyanoacry-late,PBCA)是一种常见的生物医学材料,由于其良好的生物相容性和体内可降解性,可用来构建多种粒子,用于药物的负载、体内输送和持续释放。近年来,用聚丙烯酸酯制备的硬壳微泡因其非免疫原性、体内稳定性和耐受性好、易于进行生物靶向化学修饰等优点而受到越来越多的关注[2]。之前已有研究将聚合物微泡(MBs-0)用于超声成像[3],但是将PBCA及其衍生物用于肿瘤成像与治疗的研究尚不多见。本研究以自制MBs-0为载体,利用生物素-亲和素法将生物素化HER2抗体偶联于MBs-0上,并通过体外实验验证其对HER2(+)细胞的靶向结合能力及超声显像能力,为高表达HER2受体的恶性肿瘤的无创早期诊断提供前期基础。
1 材料和方法
1.1 材料
1.1.1 主要试剂:氰基丙烯酸丁酯(BCA)(美国Sigma-Aldrich公司),生物素化的抗HER2 Affibody(美国Abcam公司),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)(上海阿拉丁公司),Triton X-100(美国Sigma-Aldrich公司),罗丹明B、链霉亲和素(强生公司),BCA蛋白定量试剂盒、PBS缓冲液(上海碧云天生物技术公司)、MDA-MB-231和BT-474的细胞株(中国科学院),声诺维(意大利Bracco公司)。
1.1.2 实验仪器:马尔文纳米粒度仪(英国Malvern 仪器公司),颗粒计数分析仪(德国贝克曼库尔特公司),分散机IKA-t25(德国IKA公司),离心机3-30KS(德国Sigma公司),倒置荧光显微镜(上海蔡司光学仪器国际贸易有限公司),超声仪器Philips EPIQ7(荷兰Philips公司),激光扫描共聚焦显微镜(日本Nikon公司)。
1.2 方法
1.2.1 MBs-0的制备:常温下取Triton X-100 (1.0 mL,1.7 mmol/L),置于250 mL容器中,加入超纯水100 mL,将容器置于分散机下,分散机转速调至3×1 000 r/min(25 ℃),加入少许盐酸将溶液pH调至2.0。向溶液中加入罗丹明染料(0.5 mL,1.0 mmol/L)及BCA(1.0 mL,9.4 mmol/L),随后将分散机转速调至10×1 000 r/min(25 ℃),持续 90 min。关闭分散机后静置5 min,取溶液用离心机离心3次(500 r/min),每次20 min,每次离心后将溶液顶部的半固态层提取溶于超纯水中,最后保存于0.5% Triton X-100的溶液中,置于4 ℃冰箱冷藏。
1.2.2 MBs-0的基本特性鉴定及形态学观察:取 1 mL MBs-0混悬液置于贝克曼颗粒计数分析仪以及马尔文纳米粒度仪检测MBs-0的粒径及表面电位,实验至少重复3次。通过荧光显微镜观察MBs-0的形态及分布。
1.2.3 MBs-0与HER2抗体的偶联:利用生物素-亲和素法将MBs-0与HER2抗体偶联。首先对MBs-0进行水解,每5×108个微泡使用0.1 mol NaOH溶液,然后用醋酸钠缓冲液进行中和稀释(10 mmol/L,pH 4.5),随后加入7.5 mg EDC和链霉亲和素300 μg,在室温下反应1 h,在4 ℃下搅拌过夜,然后用离心机离心3次(500 r/min),每次20 min。取用链霉素包裹的5×108个MBs-0和生物素化的HER2抗体(50 μg)在旋转混匀仪上反应30 min获得HER2靶向聚合物微泡(MBs-1),将MBs-1用PBS缓冲液洗涤3次,最后保存到0.5% Triton X-100溶液中,置于4 ℃ 冰箱冷藏。
1.2.4 MBs-1的基本特性鉴定及形态学观察:取 1 mL MBs-1混悬液置于贝克曼颗粒计数分析仪以及马尔文纳米粒度仪检测微泡的粒径及表面电位,实验重复3次。通过荧光显微镜观察MBs-1的形态及分布。
1.2.5 BCA蛋白浓度检测MBs-1的蛋白含量:BCA蛋白浓度检测是根据吸光度值推算出蛋白浓度。测定其在562 nm处的吸光度值,并与标准曲线对比,即可计算待测蛋白的浓度。不同浓度的牛血清白蛋白溶液各5 μL加入96孔板,加入300 μL工作液在37 ℃ 孵化30 min。冷却后用酶标仪测定波长562 nm处的吸光度值,以牛血清白蛋白含量为横坐标,以吸光值为纵坐标,绘制标准曲线。另取待测的样品 5 μL按上述方法操作,并测定波长562 nm处的吸光度值,根据样品的吸光度值从标准曲线上查出样品的蛋白质含量。
1.2.6 MBs-1与细胞结合的体外寻靶实验:按常规方法培养HER2(+)的细胞株BT-474及HER2(-)的细胞株MDA-MB-231,待细胞长至70%~80%时,分别弃掉培养液,轻柔洗涤,加入MBs-1,常温下共孵育30 min。反复洗涤,荧光显微镜下观察并留图。另取BT-474细胞,分别与MBs-1和MBs-0共孵育,具体方法同前。采用激光扫描共聚焦显微镜对激发波长561 nm和发射波长570~620 nm的细胞靶向能力进行评价。
1.2.7 MBs-1的体外超声造影成像效应观察:声诺维超纯水溶液2 mL移至样品管A,空白对照采用超纯水2 mL移至样品管B,取与样品管A相同浓度的MBs-1 2 mL移至样品管C。用Philips EPIQ7超声仪(高频线阵探头,频率13 MHz,机械指数为0.08)进行超声造影成像。
1.2.8 MBs-1稳定性的测定:将MBs-1置于颗粒计数分析仪分别在5 min、30 min、1 h、6 h、12 h检测粒径情况。实验重复3次。比较30 min、1 h、6 h、12 h与5 min时MBs-1的粒径差异。
1.3 统计学处理方法 采用SPSS23.0统计学软件进行数据分析。正态分布的计量资料以±s表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 MBs-0的基本特性与形态观察 MBs-0平均粒径为(1.76±0.43)μm,平均表面Zeta电位为(-38.6±6.86)mV(见图1)。镜下见MBs-0分布均匀,无明显聚集,可见均匀红色荧光,将微泡于4 ℃保存1个月后未见明显粘连与聚集现象(见图2A)。
2.2 MBs-1的基本特性与形态观察 MBs-1平均粒径为(1.78±0.37)μm,平均表面Zeta电位为(-37.40± 5.74)mV(见图1)。MBs-1溶于超纯水后,肉眼观为淡粉色混悬液。在荧光显微镜下,微泡显示带有红色荧光,个别微泡略有聚集(见图2B)。
2.3 MBs-1的蛋白含量 为定量测定MBs-1的蛋白含量,采用BCA蛋白浓度检测法。对照以不同浓度牛血清白蛋白溶液制成的标准曲线,并测定本实验制备的样品在波长562 nm处的吸光度值,确定HER2抗体偶联量为2.67 mg/mL。
2.4 MBs-1与细胞结合的体外寻靶实验 通过观察MBs-1对HER2(+)肿瘤细胞的靶向结合情况来评价其是否与HER2抗体偶联成功。结果显示,在HER2(+) 的乳腺癌BT-474的细胞表面都可见带有红色荧光的类圆形微泡样结构聚集。而在HER2(-)的乳腺癌MDA-MB-231细胞表面未见荧光显示。随后,用MBs-1与MBs-0分别同时与乳腺癌BT-474细胞共孵育,前者可见微泡聚集在细胞表面,而后者未见荧光显示。见图3。

图1 微泡的基本特性
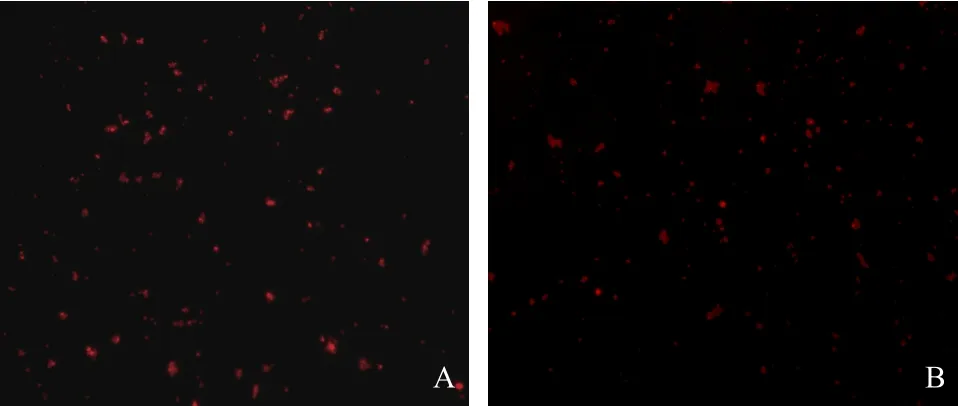
图2 荧光显微镜观察微泡形态(×200)
2.5 MBs-1的体外超声造影成像效应 在超声造影模式下,声诺维微泡超声造影剂呈现为细腻均匀的点状致密高回声;MBs-1呈现为比声诺维更为细腻均 匀的点状致密高回声;超纯水则为无回声。见图4。2.6 MBs-1的稳定性观察 为了解MBs-1的稳定性,我们观察了MBs-1的粒径随时间变化的规律。在 30 min、1 h、6 h和12 h时与5 min时相比差异均无统计学意义(P>0.05)。见表1。
3 讨论
近年来,乳腺癌已成为全世界严重威胁女性健康的头号杀手,发病年龄也趋于年轻化,其中HER2(+)乳腺癌占20%~30%。HER2又称人表皮生长因子受体-2,它是重要的乳腺癌预后判断因子,HER2(+)乳腺癌浸润性强、进展快、易转移和复发、预后差。同时HER2的表达状态对肿瘤全身治疗时的药物选择也是至关重要的[4-5]。近年来,靶向肿瘤分子的影像诊断和治疗已成为研究热点[6-7]。HER2位于细胞表面,易于被抗体接近,是极具发展前途的诊疗靶点。
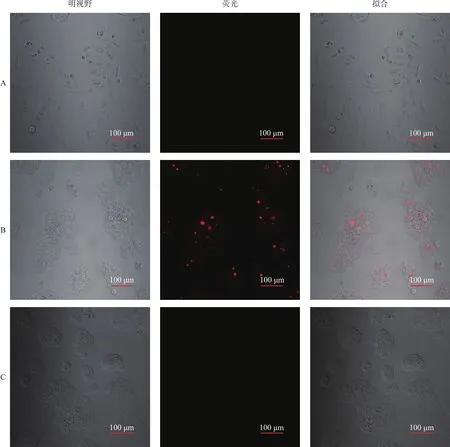
图3 体外寻靶实验(激光扫描共聚焦显微镜)

图4 超声体外显影图像

表1 MBs-1不同时间的粒径大小
随着对超声造影剂材料及其制备技术的深入研究,许多学者发现使用不同材质构建的微泡外壳膜具有不同的表面理化特性,通过生物、化学方法对微泡表面进行修饰,将某种特异性抗体或配体连接于微泡表面,能产生具有靶向能力的新型超声造影剂[8]。当前不乏有学者尝试制备靶向超声造影剂微泡[9],姚继袆等[10]采用碳二亚胺法制备携Herceptin纳米级靶向HER2的脂质微泡造影剂,柯青兰等[11]通过单乳化法和碳二亚胺法制备靶向HER2的液态氟碳高分子超声造影剂。微泡由外壳膜和内部气体核构成,微泡的外壳膜主要影响其黏弹性、稳定性和对超声波的后向散射能力,它还保护核心免受外部微环境的影响,并保持其物理化学性质。外壳膜材料应具有生物相容性,无免疫原性和不良反应,且满足生物降解要求,便于适当的机体清除。PBCA作为一种由聚合物制成的硬壳微泡,它与由脂质、蛋白质等构成的软壳微泡相比具有更高的稳定性、相对较厚的壳体以增强载药量、对破坏性超声具有更好的耐受性、更便于结构修饰等优点,近年来在超声造影剂的研究中越来越受到重视[12-13]。之前的研究报道了PBCA微泡在14周内平均粒径没有明显变化[14],本研究中将PBCA微泡于4 ℃保存1个月后未见明显粘连与聚集现象,说明PBCA微泡稳定性较好。在本研究中,将PBCA微泡与HER2抗体偶联以制备靶向微泡,在5 min、30 min、1 h、6 h、 12 h分别对靶向微泡粒径进行观察,发现12 h内靶向聚合物微泡粒径无明显变化,说明其稳定性较高,较文献报道的自制的HER2靶向脂质微泡[15]更加稳定。分析其原因除了聚合物制成的硬壳泡具有更高的稳定性外,另一原因可能是由于PBCA微泡具有更高的静电斥力。Zeta电位是对颗粒之间相互排斥或吸引力的强度的度量,Zeta电位的绝对值越高,体系越稳定,微泡越不容易粘连和聚集。无论是PBCA微泡的Zeta电位[(-38.60±6.86)mV],还是靶向PBCA微泡的Zeta电位[(-37.40±5.74)mV],都较国内文献报道[15]的自制的HER2靶向微泡的Zeta电位[(-21.48±7.5)mV]以及声诺维的Zeta电位 [(-21.30±10.8)mV]绝对值更大,差异有统计学意义(P<0.05),因此稳定性更高。
将抗体连接到造影剂表面构建靶向微泡的方法有多种[16],其中生物素-亲和素连接法是应用较多的方法。生物素是一种辅酶,利用生物素的羧基加以化学修饰可制成活化生物素,抗体分子上的氨基极易被活性生物素酯的侧链羧基酰化而标记上生物素,而其生物素端仍保持其结构的完整和特有的生物学活性[17]。偶联传统的抗体会增加微泡的体积,对微泡的穿透力会有影响,在本研究中选择了针对肿瘤HER2分子的极小分子类抗体Affibody分子,它是一类新的由58个氨基酸残基组成、相对分子质量约为6.5×103Da的亲和性配体,其功能类似于抗体却又有着一些抗体所不具备的性质,如相对分子质量小、折叠速率快、选择性和亲和力高,以及结构稳定,可耐受化学修饰等,被称为人工抗体[18]。 正由于Affibody分子的相对分子质量小,因此将其与PBCA聚合物微泡偶联后微泡的粒径增加不明显,保证了微泡的穿透力。本研究中通过生物素-亲和素系统成功构建了以HER2为靶点的PBCA聚合物超声造影剂,通过BCA蛋白浓度检测法确定样品中蛋白含量为2.67 mg/mL,表明本研究制备的靶向PBCA聚合物微泡中成功连接了蛋白成分。在体外细胞实验中,无论是用HER2靶向聚合物微泡与HER2分子不同表达状态的肿瘤细胞的结合实验,还是分别用HER2靶向聚合物微泡和单纯的非靶向聚合物微泡与同一种HER2(+)的肿瘤细胞的结合实验,结果都证实了靶向PBCA聚合物微泡与HER2抗体连接成功,在体外能对HER2(+)肿瘤细胞实现靶向结合。此外,在体外超声显像中显示靶向聚合物超声造影剂呈细腻均匀的点状密集高回声,这些都为以后进行体内肿瘤的分子靶向超声造影奠定了基础。
聚合物微泡在临床前功能和分子超声方面具有 广阔的应用前景,本研究在研制靶向HER2分子微泡中取得了一些初步成果,未来我们将进一步致力于靶向聚合物微泡的体内靶向研究,并着力于研制纳米级别的并兼具高稳定性及高靶向性的聚合物微泡。
