大麻素II型受体参与调控低氧微环境下大鼠骨髓间充质干细胞的骨向分化
2019-07-12胡旭治史新连邓辉
胡旭治,史新连,邓辉
(温州医科大学附属口腔医院 牙周科,浙江 温州 325027)
近年来,低氧微环境对牙周组织再生的影响,被广泛关注。牙周炎症时牙周组织血供减少、局部低氧,甚至可能引起有毒物质堆积,牙周炎症组织呈现为低氧微环境[1-3]。本课题组前期研究已证实100 μmol/L CoCl2促进大鼠骨髓间充质干细胞(rat bone mesenchymal stem cells,rBMSCs)低氧,并通过调控骨保护素(osteoprotegerin,OPG)、破骨基因核因子κB受体活化因子配体(RANKL)mRNA的表达,促进骨向分化[4],但其机制尚不清楚。
研究证实大麻素 II型受体(cannabinoid type 2 receptor,CB2)对于调节骨代谢和促进BMSCs成骨分化、抑制破骨关系密切。临床研究发现,CB2基因位点单核苷酸多态性与骨质疏松发病显著相关[5]。 动物实验证实CB2基因敲除小鼠表现出与年龄明显相关的骨量减少,激活CB2则可抑制卵巢切除引起的骨量减少[6]。体外实验进一步证实CB2的特异性激动剂Hu-308可上调ALP活性,促进成骨细胞的骨向分化,亦能促进OPG和成骨转录因子(runtrelated transcription factor 2,RUNX2)的表达,下调RANKL的表达[7-8]。提示CB2在BMSCs的骨向分化中扮演着重要角色。然而,目前CB2在调控低氧微环境下rBMSCs骨向分化中的角色则了解甚少。
1 材料和方法
1.1 材料
1.1.1 实验动物:4周龄体质量为160~200 g的雄性SPF级SD大鼠由温州医科大学实验动物中心提供,实验动物许可证号:SYXK(浙)2015-0009。
1.1.2 试剂:胎牛血清(杭州四季青生物工程材料有限公司),DMEM培养基(美国Gibco公司),六水氯化钴(CoCl2)、二甲基亚砜、地塞米松、甘油磷酸钠、抗坏血酸(美国Sigma公司),AM630(美国Cayman公司)。PCR引物、TRIzol Reagent(美国Invitrogen公司),反转录试剂盒(日本Takara公司),CB2、RUNX2抗体(美国Cell Signaling Technology公司),骨钙素(osteocalcin,OCN)抗体(美国Santa Cruz公司),RIPA细胞裂解液(杭州弗德生物公司),BCA蛋白浓度试剂盒(上海碧云天生物技术有限公司)。
1.1.3 仪器:CO2恒温培养箱(美国Thermo公司),倒置显微镜(日本Nikon公司),全自动酶标分析仪(瑞士Tecan公司),低温高速离心机(美国Beckman公司),PCR扩增仪、凝胶成像分析仪(美国Bio-Rad公司),Step One Plus荧光定量PCR仪(美国Life Technologies公司)。
1.2 方法
1.2.1 rBMSCs的原代培养:采用全骨髓细胞贴壁法体外分离培养rBMSCs。取SD大鼠颈椎脱臼法处死,无菌条件下收集双侧股骨全骨髓,用含10%胎牛血清+100 U/mL青霉素+100 U/mL链霉素的DMEM培养液混匀后,按2×106个/mL接种于培养瓶,于5% CO2、37 ℃培养箱培养。待贴壁细胞融合至80%,0.25%胰蛋白酶消化,按照1:2传代,取3~5代细胞用于后续实验。
1.2.2 实验分组:对照组:rBMSCs培养于DMEM完全培养基;100 μmol/L CoCl2组:rBMSCs分别培养于含100 μmol/L CoCl2的完全培养基;每组设3个复孔,单纯培养基为调零孔,rBMSCs培养于含等量上述完全培养基作为对照。
1.2.3 实时荧光定量PCR:依据TRIzol Reagent产品说明,采用酚-氯仿提取法提取总RNA。利用NanoDrop 2000超微量分光光度计测定总RNA的浓度以及纯度(OD260 nm/OD280 nm)。若两者比值介于1.8~2.0之间,则纯度合格。依据PrimeScriptTM RT-PCR Kit试剂盒说明书,取20 μL反应体系,用于总量为1 000 ng的总RNA的反转录过程。依据实时荧光定量PCR SYBR Green染料法的要求,设计引物序列见表1。按照试剂盒要求,采用PCR仪对所得cDNA模板进行扩增。每个样本设3个复孔,取平均值(复孔间Cterror<0.15为合格)。根据样本目的基因和内参基因反应的Ct值,通过公式2-ΔΔCt,计算mRNA相对表达水平。

表1 PCR引物序列
1.2.4 Western blot:将RIPA裂解液与蛋白酶抑制剂PMSF按照100:1的比例振荡混合;每孔均匀加入100 μL配置好的细胞裂解液,充分裂解20 min,轻柔刮取细胞裂解物;4 ℃,离心,取上清。BCA试剂盒测定蛋白浓度,将各组样本总蛋白调至相同,并在EP管中按样本量:5×loading buffer=4:1的比例加入loading buffer,ddH2O补足至20 μL的上样体积;将配制好的样本置于100 ℃煮沸。配置8%分离胶和5%浓缩胶,上样,电泳、转膜和封闭,一抗孵育(小鼠属抗大鼠RUNX2抗体,1:1 000;山羊属抗大鼠OCN抗体,1:10 000,内参蛋白(小鼠属抗大鼠β-actin抗体,1:2 000),孵育二抗(山羊抗兔二抗1:4 000,兔抗山羊二抗1:8 000,山羊抗小鼠二抗1:8 000)。均匀滴加发光液孵育后曝光。将曝光得到的条带灰度图片导出,使用Quantity One软件测定各组目的蛋白与管家蛋白的灰度值,以目的蛋白与其相对应的管家蛋白灰度值的比值作为最终数据,记录,统计学分析。实验重复3次。
1.3 统计学处理方法 采用SPSS18.0统计软件对数据进行分析。计量资料以s表示,进行重复测量资料的方差分析和LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 低氧微环境促进rBMSCs成骨关键蛋白的表达 低氧刺激不同时间后对成骨关键蛋白包括核心转录因子RUNX2、成骨标记物OCN的表达进行定量PCR分析。与对照组相比,除12 h以外,其余各时间段低氧刺激均能促进RUNX2 mRNA的表达,且差异有统计学意义(P<0.05),24、48 h时尤为明显。Real-time PCR结果显示:低氧刺激rBMSCs上调OCN mRNA的表达,且差异有统计学意义(P<0.05),24、 96 h时尤为明显。Western blot结果显示:与对照组比,低氧组OCN的表达呈时间依赖性上升;RUNX2在12、24 h时表达无明显变化,而在48、72、96 h时上升明显(P<0.05)。结果表明,成骨关键蛋白RUNX2、OCN在低氧微环境下表达上升。见图1。
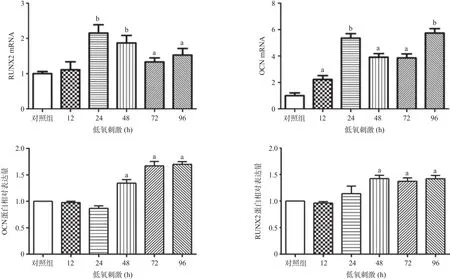
图1 低氧微环境对rBMSCs成骨关键蛋白mRNA及蛋白表达的影响
2.2 低氧微环境下rBMSCs的CB2表达 与对照组比,低氧组rBMSCs表达CB2 mRNA在不同时间点具有上调的趋势,差异均有统计学意义(P<0.05)。Western blot结果显示,与对照组比,低氧组CB2蛋白表达升高,以96 h时明显(P<0.05)。见图2。
2.3 阻断CB2对低氧微环境下rBMSCs成骨关键蛋白表达的影响 低氧组rBMSCs成骨关键蛋白RUNX2、OCN mRNA表达水平高于对照组(P<0.05);经低氧和CB2抑制剂AM630共同刺激48 h后,rBMSCs的成骨关键蛋白RUNX2、OCN mRNA表达较低氧组呈下调趋势(P<0.05),接近对照组。同样,CB2抑制剂AM630抑制低氧所促进的rBMSCs CB2、成骨关键蛋白RUNX2和OCN蛋白的表达(P<0.05)。见图3。
3 讨论
牙周炎症状态下牙周组织呈现低氧状态。生理状况下牙周组织的氧含量2.9%~5.7%[9]。PRADEEP等[1]发现牙周炎患者的牙周组织血供循环显著受阻,局部氧含量下降。NG等[2]免疫组织化学研究发现,牙周炎患者牙周组织中的低氧标志物HIF-1α表达量较牙周健康人群显著升高。TAKEDACHI等[3]发现与正常对照组相比,实验性小鼠牙周炎模型的牙周组织的低氧标记物哌莫硝唑呈高表达。BMSCs作为牙周组织再生理想的种子细胞,其骨向分化的转归是牙周组织再生的关键所在,因此阐明牙周低氧微环境下rBMSCs骨向分化的点及其调控机制对于促进牙周组织再生而言具有重要意义。
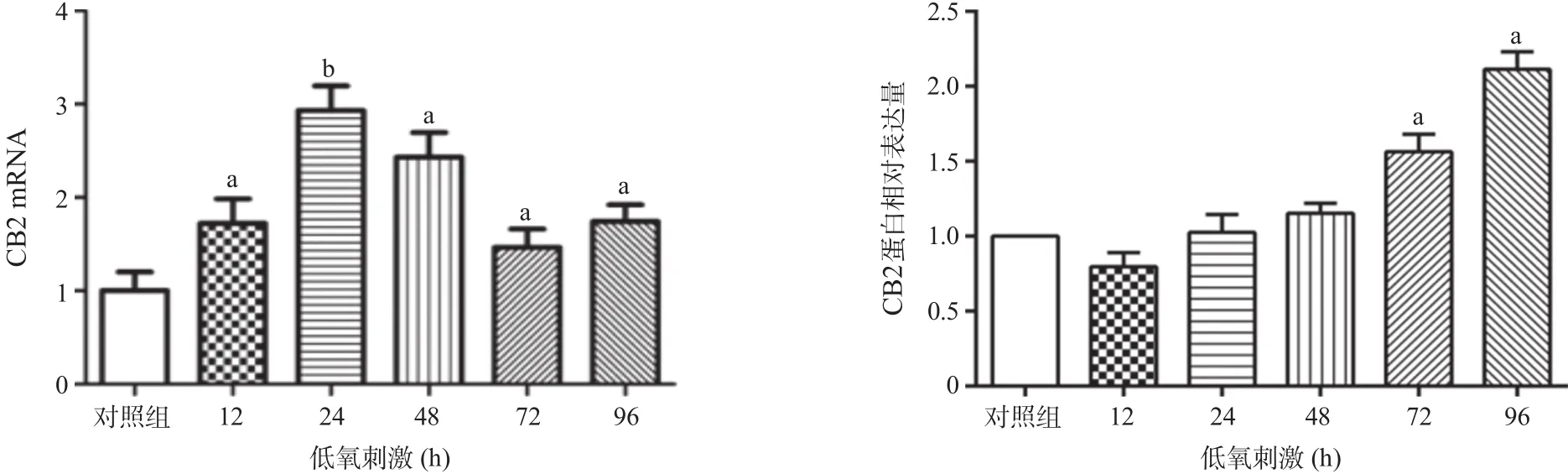
图2 低氧微环境对rBMSCs CB2表达的影响
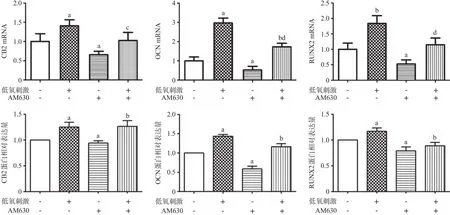
图3 CB2阻断剂对低氧微环境下rBMSCs成骨关键蛋白和CB2表达的影响
CoCl2可作为细胞低氧模拟剂,其模拟的体外低氧与体内低氧状态具有很强的可比性。CoCl2使用简便,条件易控制,在国内外实验研究中已获得广泛应用[10]。本课题组前期研究已证实100 μmol/L CoCl2能较好地模拟体内低氧微环境。
目前对于低氧微环境下BMSCs骨向分化的调控机制尚存较大争议。WAGEGG等[11]发现低氧通过依赖低氧因子HIF-1的方式促进BMSCs骨向分化,抑制成脂分化。然而,ZOU等[12]将HIF-1α转染到BMSCs中,通过Western blot和茜素红染色检测ALP表达及钙结节的形成后发现:与对照组相比,HIF-1α转染组ALP基因及蛋白表达上升,同时钙结节的形成也明显增加。然而亦有学者研究证实低氧微环境能抑制BMSCs的骨向分化[13]。本课题组研究发现rBMSCS经100 μmol/L浓度的CoCl2低氧处理24、48、72、96 h 后,成骨关键蛋白RUNX2、OCN等的表达上调。低氧对rBMSCs骨向分化影响的不同研究结果,可能与细胞种类以及氧浓度、低氧时间等条件不同有关。
近期研究表明,CB2在调节破骨细胞功能和骨吸收方面起着重要作用。CB2属于G蛋白耦联受体(G-protein-coupled receptors,GPCRs)超家族,主要分布在免疫系统,在调节免疫系统的发育,减轻疼痛感觉,抑制炎性反应中发挥重要作用[14]。有研究发现,CB2在骨组织有表达,对骨量和骨改建起重要调节作用[5-6,15]。OFEK等[6]首先报道了CB2基因敲除小鼠在8周龄时未表现出骨量异常,而51周龄时出现明显的骨小梁骨质疏松和骨皮质膨胀,组织形态学检查发现骨的高转换率,提示骨丧失的可能机制为骨吸收增加。IDRIS等[16]研究表明CB2基因敲除小鼠早期骨量相对正常,后可逐渐发展成增龄性骨质疏松。SOPHOCLEOUS等[17]研究报道CB1和CB2基因联合敲除的小鼠表现为峰值骨量增加,但也出现与年龄相关的骨丧失。3个月时,与野生型小鼠相比,CB1和CB2基因联合敲除雄性CD1小鼠由于抑制破骨细胞数量和活性表现出明显更高的峰值骨量。然而CB2是否参与低氧调控rBMSCs骨向分化尚不清楚。
本研究结果表明CoCl2刺激下的低氧环境中rBMSCs的CB2 mRNA和蛋白的表达水平上升;CB2抑制剂AM630抑制低氧对rBMSCs成骨关键蛋白RUNX2、OCN的促进作用。ROSSI等[18]研究亦发现AM630处理BMSCs后,成骨mRNA和蛋白表达水平下降,成骨能力下降。但CB2调控rBMSCs骨向分化的胞内信号机制有待今后进一步明确。
