长链非编码RNA在鼻咽癌组织中的差异表达
2019-07-11彭丽娇李欣晓江丹贤张辉洁吴伟豪广东医科大学附属医院肿瘤中心耳鼻咽喉科广东湛江5400
彭丽娇,李欣晓,江丹贤,张辉洁,陈 竟,吴伟豪,黄 静 (广东医科大学附属医院. 肿瘤中心;. 耳鼻咽喉科,广东湛江 5400)
鼻咽癌是起源于鼻咽上皮的恶性肿瘤,年发病率约高达10万人[1-2]。寻找鼻咽癌早期诊断和预警分子标记有助于鼻咽癌的临床诊治[3]。长链非编码RNA(lncRNA)是一类无法编码蛋白质的RNA分子[4-5],通过与染色质、蛋白质及其他RNAs的相互作用,广泛参与表观遗传调控、细胞周期调控、细胞分化调控等多种生理、病理过程[6],在细胞的生长、凋亡、新陈代谢、机体免疫应答及肿瘤发生中均发挥重要的调节作用[7]。大量研究表明,lncRNA 与多种疾病的发生和发展密切相关,在相关肿瘤中特异性表达,参与了多种肿瘤的调控[8-9]。本研究通过高通量lncRNA芯片技术,对比分析鼻咽癌和正常鼻咽上皮组织的lncRNA表达谱,从中挑选表达差异显著的lncRNA,并通过临床样本进一步验证,初步筛选出鼻咽癌发病特异相关的lncRNA,为寻找鼻咽癌有效的诊治靶点提供实验依据。
1 材料和方法
1.1 标本收集
收集2016年10月至2017年4月在广东医科大学附属医院行内镜下活检的鼻咽癌组织(30例),所有标本经病理学确诊,同时以正常鼻咽上皮组织为对照(25例)。组织标本在离体后立即置入冻存管中投入液氮保存。随机选取3对鼻咽癌组织和正常鼻咽上皮组织(患者临床资料详见表1)作为lncRNA芯片检测样本。实验获得本院伦理委员会批准。
1.2 实验材料
组织总RNA提取试剂RNAiso Plus(Takara,中国),RNA纯化试剂盒(QIAGEN,德国),cRNA合成和标记试剂盒(Agilent technologies,美国),SYBR Green I(Takara,中国),紫外分光光度计ND-2000(NanoDrop, 美 国 ), ABI 7500荧 光 定 量 PCR仪(Applied Biosystems,美国)。lncRNA芯片为上海伯豪公司的4×180 k human ceRNA 表达芯片,包含了68 423条lncRNA和18 853条mRNA。
1.3 实验方法
1.3.1 组织RNA抽提 将冻存管从液氮中取出,用眼科剪将组织样本剪成约1 mm3的小块置入离心管中并加入1 mL RNAiso Plus,用研磨仪充分研磨直至无肉眼可见组织块。加入200 μL氯仿,涡旋混匀后离心,吸取出上清液至另一离心管,加入等体积异丙醇,静置后离心。弃上清,加入1 mL 70%乙醇洗涤,离心弃上清,干燥沉淀后加入适量的RNase-free水溶解沉淀,-80 ℃保存。
1.3.2 芯片杂交、扫描及数据读取分析 按照Agilent公司的表达谱芯片试剂盒(Low Input Quick Amp Labeling Kit,One-Color)说明书对样品RNA进行放大和标记,用RNeasy Mini Kit纯化标记后的cRNA。按照Agilent公司表达谱芯片配套提供的杂交标准流程和配套的试剂盒组装好杂交仓,将标记后的样本置于杂交炉中,65 ℃,10 r/min,杂交17 h后用洗脱试剂盒洗片。采用Agilent Microarray Scanner扫描杂交后的芯片。用Feature Extration软件读取芯片原始数据,归一化处理后分别绘制散点图、火山图和热图,并进行GO分析和KEGG pathway分析。
1.3.3 qRT-PCR 用上海净信研磨仪将组织样本研磨均匀,以Takara公司的RNAiso Plus提取总RNA,并用NanoDrop ND-2000紫外分光光度仪测定产物的浓度和纯度。按PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time)的说明书进行逆转录合成cDNA。以人β-actin为内参基因,用SYBR®Premix Ex Taq™ Ⅱ(Tli RNaseH Plus)在美国ABI7500系统中完成PCR扩增,以2-△CT计算基因的相对表达量。引物信息见表2。
1.4 统计学处理
以SPSS 20.0软件对数据进行统计学分析,用独立样本t检验分析结果,以P<0.05表示差异有统计学意义。
2 结果
2.1 组织RNA抽提结果
NanoDrop ND-2000紫外分光光度仪检测样本总RNA,所有样品RNA的OD 260/280为1.8~2.1,28 s/18 s RNA条带灰度比值均≥1.5,满足芯片实验要求,详见表3。
2.2 lncRNA差异表达分析

表1 患者临床资料

表2 lncRNA引物序列
如图1所示,lncRNA在鼻咽癌组织标本和正常鼻咽组织标本中呈离散分布。鼻咽癌组织中表达上调(红色)和下调(蓝色)的lncRNA,详见图2,其中红色区域代表差异倍数≥2且P<0.05的差异表达lncRNA,蓝色区域代表差异倍数≤0.5且P<0.05的差异表达lncRNA。聚类分析直观显示每个样本中不同lncRNA的表达水平,如图3所示,两组样本中lncRNA的表达存在显著差异(P<0.05)。
2.3 芯片检测结果
比较鼻咽癌组织及正常组织中的lncRNA表达水平,将差异表达倍数≥2且P<0.05的lncRNA定义为差异表达lncRNA。结果筛选出差异表达lncRNA共454个,其中在鼻咽癌组织中上调表达的lncRNA有173个,下调表达的有281个。差异表达上调10倍以上的lncRNA共13个(表4),差异表达下调5倍以上的lncRNA共11个(表5)。同时检测出767个差异表达mRNA,其中上调表达305个,下调表达462个。

图1 鼻咽癌差异表达的lncRNA散点图

图2 鼻咽癌差异表达的lncRNA火山图

图3 鼻咽癌差异表达的lncRNA聚类分析图
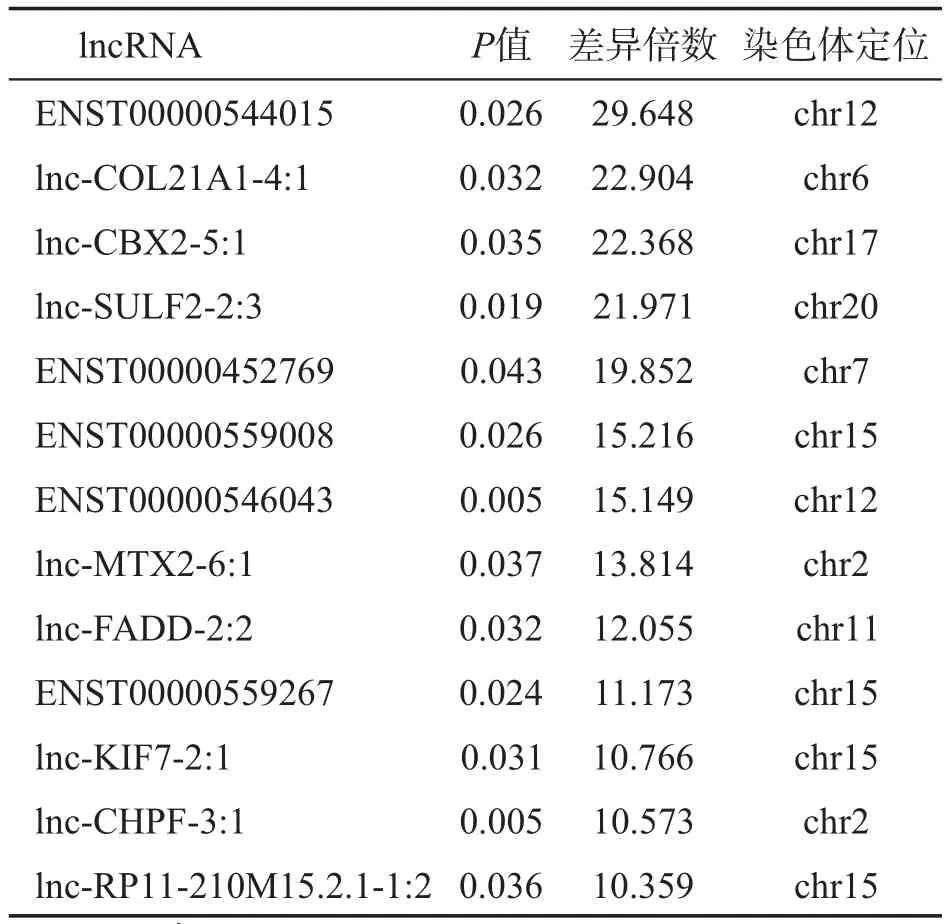
表4 鼻咽癌组织中差异表达上调10倍以上的lncRNAs
2.4差异表达lncRNA的靶基因预测
对差异表达lncRNA的靶基因进行预测,结果显示,11个差异表达上调10倍以上的lncRNA中,9个lncRNA有cis调控的靶基因,1个lncRNA有trans调控的靶基因,1个lncRNA既有cis调控又有trans调控的靶基因,详见表6。
2.5 qRT-PCR验证
为进一步验证基因芯片结果,选取芯片中上调的lnc-RBBP8-1:2和lnc-MICALL2-1:8两个lncRNA,采用qRT-PCR在55例组织标本中检测它们的表达量。结果显示,与正常鼻咽上皮组织相比,lnc-RBBP8-1:2和lnc-MICALL2-1:8在鼻咽癌组织中均明显表达上调,差异有统计学意义(P<0.05)(图4),与芯片检测结果一致。
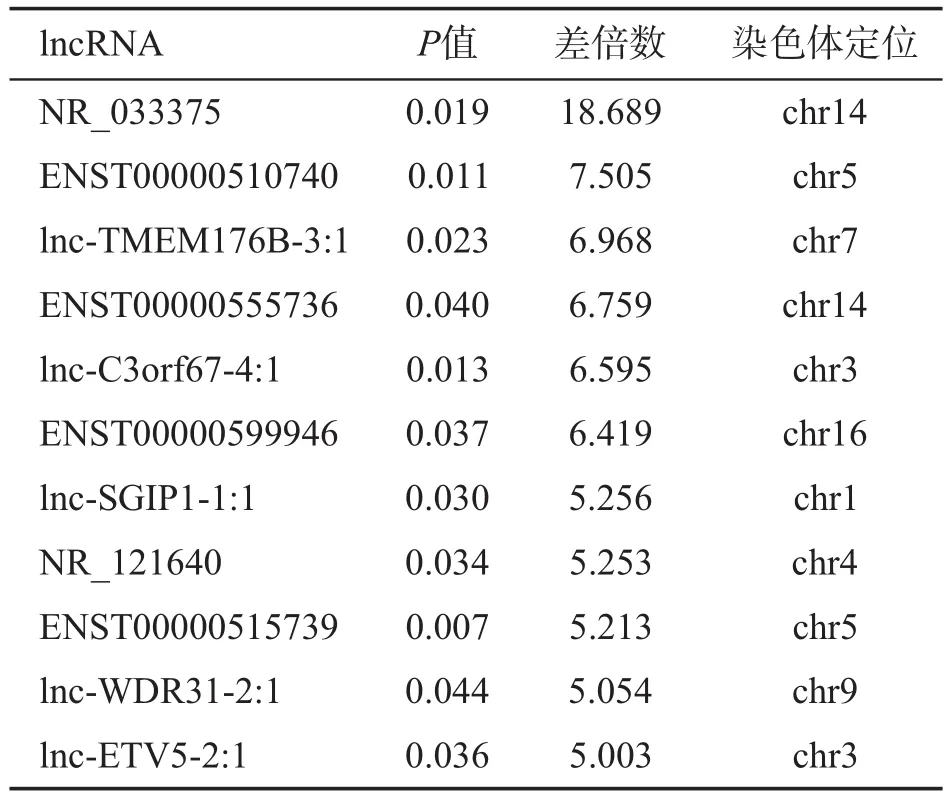
表5 鼻咽癌组织中差异表达下调5倍以上的lncRNAs

表6 差异表达lncRNAs的靶基因预测

图4 lnc-RBBP8-1:2(A)和lnc-MICALL2-1:8(B)在鼻咽癌和正常鼻咽组织中的表达水平
3 讨论
众所周知,真核生物基因组能够转录多种不同大小、丰度和蛋白质编码能力的RNA分子。目前只有少量的非蛋白质编码转录物能在实验室条件下测定其功能,与RNA的多样性形成了鲜明的对比,且除蛋白质编码基因外,很少发现疾病相关的基因突变[10]。因大多数lncRNA在生物体内的表达水平低,这在RNA深度测序方法出现之前,对其研究仍是一大难题[11]。近年来,随着RNA测序技术和生物信息学的飞速发展,越来越多的lncRNA走进了人们视野。根据lncRNA从基因组中被转录的位置不同,可将其分为5大类:独立型(stand-alone lncRNAs),也叫基因间型(lincRNAs),如HOTAIR;反义型(antisense),如Xist/Tsix;假基因型(pseudogenes);长内含子型(long intronic ncRNAs),如COLDAIR;启动子/增强子转录RNA型(Divergent transcripts,promoter-associated transcripts, and enhancer RNAs),如(pas)RNAs、(e)RNA[12]。lncRNA可以在多个层面上调控表观遗传、转录、基因表达,参与X染色体沉默、基因组印记以及染色质修饰、转录激活、转录干扰、核内运输等多种生物学过程,并且在肿瘤发生过程中有重要的调控作用[13-15]。
迄今为止,研究人员已经鉴定了多种肿瘤中异常表达的lncRNA,初步解释了其临床意义。Yu等[16]通过重新利用微阵列探针对GEO数据集分析了人胰腺癌和非肿瘤组织中的lncRNA表达谱,发现数百个lncRNA在胰腺癌组织中差异表达,用基因敲除的方法证明LINC00152和CASC9在胰腺癌细胞中的促进增殖和侵袭的作用。Gu等[17]使用微阵列分析,在6对胃癌和相邻正常组织样品中鉴定了1 297个lncRNA存在差异表达,并进一步证实UCA1、lincRNABBOX1-2在胃癌组织中表达上调,而CR594506和BC015134则表达下调,编码-非编码共表达网络揭示了这4个lncRNA与26个mRNA存在相关性。贾搏等[18]利用lncRNA表达谱芯片检测了3对舌鳞癌组织及正常舌组织中 lncRNA的表达谱,发现3 590 个lncRNA表达失调。越来越多的研究提示lncRNA与肿瘤的发生、发展密切相关,可能成为癌症患者诊断和治疗的潜在分子标记物。
在鼻咽癌研究中, Li等[19]通过深度测序将鼻咽癌放疗抵抗细胞株CNE-2-Rs与亲代细胞CNE-2进行比较,在细胞层面上发现2 835个lncRNA差异表达,并通过qRT-PCR验证和靶基因预测发现lncRNA与鼻咽癌放疗抵抗的潜在关系。目前报道的与鼻咽癌发病 相 关 的 lncRNAs包 括 HOTAIR、 HNF1A-AS、lncRNA-LET、 H19、 NEAT1、 AFAP1-AS1、FOXD2-AS1、MALAT1、CCAT1、XIST等[20-30],说明lncRNA在鼻咽癌的发生、发展过程中起着重要的调控作用。我们对于lncRNA的功能、类型、生物学意义依然了解甚少。本研究借助lncRNA芯片分析了鼻咽癌和鼻咽正常组织表达谱的变化情况,按照表达差异倍数2倍以上且P<0.05条件进行筛选,共获得454个差异表达的lncRNA,其中在鼻咽癌组织中上调173个,下调281个,与鼻咽正常组织相比,鼻咽癌组织中存在明显的lncRNA差异表达,提示lncRNA可能参与了鼻咽癌的发病过程。为了解lncRNA在鼻咽癌中的作用,我们利用生物信息学技术对差异表达的lncRNA进行了靶基因预测,结果显示lncRNA可能通过cis和trans两种方式对靶基因进行调控。为进一步验证芯片结果的准确性,我们从中挑选了在鼻咽癌组织中上调表达的2个lncRNA:lnc-RBBP8-1:2和lnc-MICALL2-1:8。这些lncRNA在既往的研究中均未见报道。通过qRT-PCR检测方法在55例组织标本中进一步验证了它们的表达量,结果发现,与正常鼻咽上皮组织相比,lnc-RBBP8-1:2和lnc-MICALL2-1:8在鼻咽癌组织中的表达量均显著升高,与芯片检测结果一致,提示lnc-RBBP8-1:2和lnc-MICALL2-1:8极有可能与鼻咽癌的发生、发展有密切关系。
本实验初步探索lncRNA在鼻咽癌中的表达变化情况,为进一步研究lncRNA在鼻咽癌中的具体功能和作用机制奠定了基础。后续将继续围绕lnc-RBBP8-1:2和lnc-MICALL2-1:8对鼻咽癌生物学行为的影响展开实验,深入探讨lncRNA在鼻咽癌发病过程中的作用,为鼻咽癌的诊治提供新的靶点。
